基于多种信号放大策略的电致化学发光生物传感器的研究进展
王海军,袁若
(西南大学化学化工学院,重庆 400715)
基于多种信号放大策略的电致化学发光生物传感器的研究进展
王海军,袁若*
(西南大学化学化工学院,重庆 400715)
电致化学发光(ECL)生物传感器技术,结合了ECL分析技术的高灵敏度和高可控性与生物识别的高特异性,能显著提高生物分子检测的灵敏度和选择性,在临床检验学等研究中展现出巨大的应用潜力。提高检测灵敏度一直都是ECL生物传感领域共同的追求目标。目前,研究者们通过引入具有优良性质的纳米材料、酶、DNA等生物放大技术,或研究寻找新型的、具有高发光效率的且生物兼容性好的ECL试剂,并改善发光试剂与共反应试剂的存在与作用方式等来提高ECL传感器的检测灵敏度,并取得了较好的效果。该文主要综述了近几年ECL生物传感器构建中常用的信号放大策略。
电致化学发光;生物传感器;信号放大策略
0 引言
由于其较低的背景信号,较高的灵敏度以及良好的可控性,电致化学发光(ECL)生物传感器广泛应用于疾病诊断与治疗、食品分析、环境监测等领域,并在逐步实现商业化[1-2]。它主要是将ECL试剂置于检测底液、固载于电极表面或直接作为信号标记,通过生物分子间的特异性识别形成复合物之后ECL信号的变化来实现目标生物分子的定量分析,具有很高的选择性、灵敏度及稳定性。在ECL生物传感器的构建中,如何有效地实现信号放大并提高检测灵敏度是其更好应用的关键性问题。该文主要综述了近几年在ECL生物传感器构建中的几种主要的信号放大策略。
1 利用不同纳米材料的固载与催化
纳米材料被认为是21世纪最有前途的材料,其应用价值显而易见。广义而言,它所指的是三维空间中至少有一维处于1~100 nm之间的或者由其作为基本结构单元而形成的材料。而纳米材料所具有的性质与这些基本结构单元的特性紧密相关。这种介于宏观与微观之间的新物质表现出了许多特殊的性质,包括量子尺寸效应、表面效应、宏观量子隧道效应及小尺寸效应等,随之呈现出良好的电、光、磁和化学催化性质,以及比表面积大、导电能力强与生物兼容性好等特性。正是基于此,纳米材料已广泛地运用于陶瓷、军事、电子学、医学、生物学、食品加工及化工等领域。在生物电分析方面,其作用主要分为以下几个方面:首先,基于其较大的比表面积,纳米材料可以很好地作为各种生物分子的载体;其次,由于其良好的生物兼容性,纳米材料在作为固载平台的同时可以很好地保持生物分子的活性,如酶、蛋白质、核酸等;再次,基于其良好的导电性,纳米材料可以很好地促进体系的电子传递;另外,研究表明,很多纳米材料还具有各种特殊的催化功能(如,电催化、过氧化氢催化分解等)。所以,在ECL生物传感器的构建中,纳米材料也扮演着举足轻重的作用[3]。下面列举了几种不同的纳米材料在ECL生物传感器构建中的应用。
贵金属纳米材料是指Au、Ag、Pt、Pd等一类的纳米尺寸级别的材料。它具有优良的导电性、生物兼容性及电催化活性,被广泛地用于ECL生物传感器的构建[4-6]。前面所提到的贵金属纳米簇就是极具代表性的一种,基于其本身的发光特性,可直接应用于ECL生物传感器的构建。除此之外,贵金属纳米材料在ECL生物传感器中应用最多的还是其固载与催化功能。Zhou等[7]以氯金酸及氯铂酸为母体,以发光试剂鲁米诺作为还原剂,经连续还原过程制得了花状的Pt@Au合金材料(Pt@AuNFs)。在该制备过程中,不仅得到了比表面积大、电催化活性好的花状贵金属合金材料,且在合成过程中成功实现了发光试剂鲁米诺的固载,简化了实验操作。以所得的Pt@AuNFs为支撑,固载胆碱氧化酶(ChOx)及二抗蛋白制得了检测心肌肌钙蛋白(cTnI)的夹心型ECL免疫传感器。在含有胆碱的底液中进行测定时,胆碱氧化酶催化胆碱生成过氧化氢,而Pt@AuNFs具有仿辣根过氧化物酶(HRP)的作用可催化氧化氢分解,从而极大地促进鲁米诺的ECL信号,实现对目标物的灵敏检测(如图1所示)。Li等[8]利用鲁米诺作为还原剂制备纳米金并固载适体链,并基于碱基互补配对在电极表面形成了类似于网状的DNA结构。该方法不仅在制备纳米金的同时实现了鲁米诺的固载,也通过DNA杂交成功实现了鲁米诺功能化纳米金的固载量的提高。基于此,成功制备了灵敏检测凝血酶的ECL适体传感器(如图2所示)。
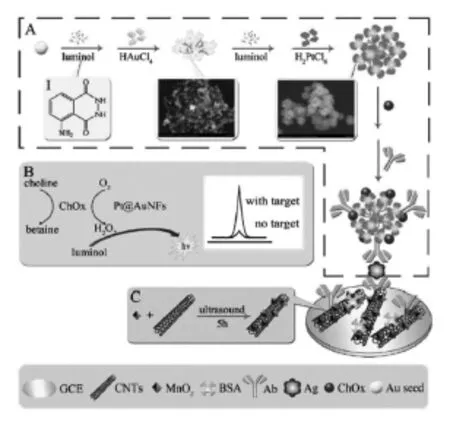
图1 基于Pt@AuNFs二抗复合物的制备及用于检测cTnI的ECL免疫传感器的构建[7]Fig.1The preparation of Ab2/luminol–Pt@AuNFs/ChOx probes and the construction of the ECL immunosensor for cTnI.Copyright 2014 RSC
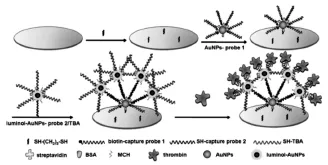
图2 基于luminol-AuNPs的ECL适体传感器的制备示意图[8]Fig.2Schematic illustration for the fabrication of the ECL aptasensor based on luminol-AuNPs.Copyright 2013 Elesiver
碳是组成有机体的基本元素之一。碳纳米材料是纳米材料家族中极其重要的一类。由于其比表面积大,稳定性好、结构强度高及来源丰富等优点,它一直都受到极大的关注[9]。目前,在ECL生物传感器的构建中,石墨烯(Graphene)[10]、碳纳米管(Carbon nanotubes)[11]、富勒烯(C60, Fullerene)[12]及各种基于碳源的量子点[13]等得到了广泛地应用。Zhao等[14]利用牛血清白蛋白(BSA)修饰富勒烯(C60)使其表面富含大量氨基,经Au-N键修饰上金纳米颗粒后得到Au@nano-C60纳米复合物。如此,使C60的溶解性、生物兼容性及对ECL的催化能力都得到了极大的提高,且易于进一步功能化。基于该C60的复合纳米材料及S2O82--O2ECL体系,构建了检测小分子卡那霉素的“on-off-on”型ECL适体传感器(如图3所示)。
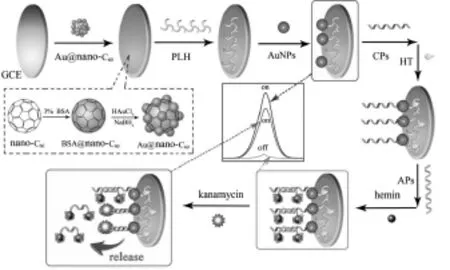
图3 基于纳米金修饰的C60纳米复合物的ECL适体传感器的构建示意图[14]Fig.3The construction of the ECL aptasensor based on Au@nano-C60.Copyright 2015 Elsevier
Zhu等[15]利用纳米金修饰黑碳掺杂的还原石墨烯(Au-rGO@CB)作为一抗固载基质,并用多孔状的银纳米材料固载Ru(bpy)32+及二抗蛋白(NPS-Ru(bpy)32+-Ab2)作为信号标记。从而构建了夹心型的ECL免疫传感器,并实现了甲胎蛋白AFP的灵敏检测(如图4所示)。众多类似于此工作的研究表明,通过表面修饰、元素掺杂等手段可以选择性地改善碳纳米材料的相关性能以满足实际要求,为该类材料的更广泛的应用提供了可能。
半导体纳米材料和磁性纳米材料也是在ECL生物传感器中应用非常广泛的材料[16-17]。其中半导体纳米材料最典型的代表是各种具有ECL性质的量子点,通过简单的修饰及后处理即可直接用于ECL传感器的构建。而磁性纳米材料主要是用于相关材料及传感器制备过程中的分离,且某些磁性材料还具有ECL催化作用。Dong等[18]合成了CdSe@ZnS复合量子点,并将其作为能量受体,鲁米诺作为能量供体,构建了ECL适体传感器。在溶液中鲁米诺与电极表面CdSe@ZnS复合量子点的高效能量转移下,所制备的适体传感器成功实现了对凝血酶的超灵敏检测(如图5所示)。
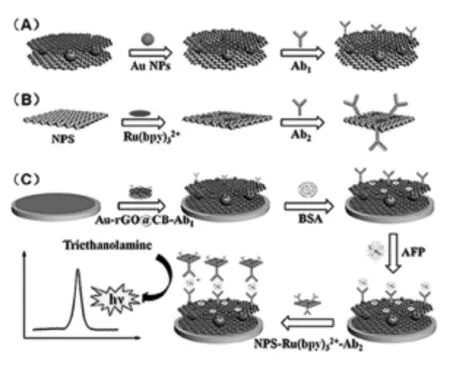
图4 生物耦合物Au-rGO@CB-Ab1(A),NPS-Ru(bpy)32+-Ab2的制备(B)及ECL适体传感器的构建示意图[15]Fig.4The preparation procedure of Au-rGO@CB-Ab1(A), NPS-Ru(bpy)32+-Ab2(B)and the construction of the sandwich-type ECL immunosensor(C).Copyright 2016 Nature
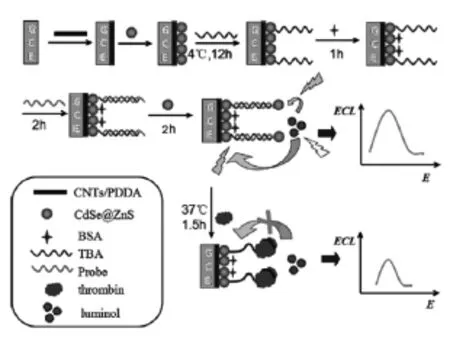
图5 用于测定凝血酶的ECL适体传感器的构建示意图[18]Fig.5The construction of the thrombin ECL biosensor. Copyright 2014 ACS
Wang等[19]以四氧化三铁为载体,并在其表面利用发光试剂鲁米诺作为还原剂原位还原纳米金,形成了发光功能化的磁性纳米复合物(Lu-AuNPs@Fe3O4)。用此磁性纳米复合物固载二抗蛋白作为信号标记,并用金纳米颗粒功能化的氧化锌(AuNPs@ZnO)固载一抗,经夹心免疫反应制得信号增强型的ECL免疫传感器,并实现了对黏蛋白(mucin-1)的检测(如图6所示)。磁性纳米材料Fe3O4在该传感器的构建中不仅能作为二抗复合物的载体,还能催化过氧化氢的分解,显著提高了传感器检测的灵敏度。
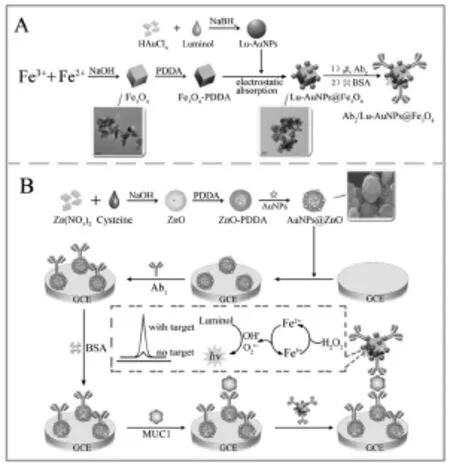
图6 基于Lu-AuNPs@Fe3O4磁性纳米材料的ECL免疫传感器的构建[19]Fig.6The construction of the ECL immunosensor based on Lu-AuNPs@Fe3O4.Copyright 2015 Elsevier
2 引入生物相关辅助放大策略
生物相关辅助放大策略,如酶催化、DNA相关信号放大手段(杂交链式反应、链置换扩增、目标物循环及滚环放大等),是在生物传感器中应用非常广泛的一类方法[20-21]。同样,在ECL生物传感器的构建中,引入上述生物辅助放大手段,也可更好地提高检测灵敏度及检测效率。
Chen等[22]基于目标DNA链引发的杂交链式反应(HCR)在电极表面制备了大量的且无限延伸的DNA双链结构。所形成的大量的双链结构为发光物质邻菲罗啉钌(Ru(phen)32+)提供了丰富的嵌入位点,显著提高了Ru(phen)32+在电极表面的固载量,从而明显提高了目标DNA的检测灵敏度及检测效率(传感器的制备如图7所示)。
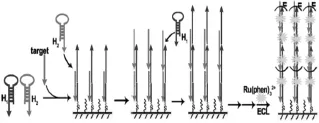
图7 基于HCR的DNA ECL生物传感器的制备[22]Fig.7Illustration of the sensitive HCR-based ECL biosensor for detection of DNA.Copyright 2012 ACS
Xu等[23]在溶液中以Fe3O4/AuNPs复合纳米材料为支撑,经夹心免疫反应和Pb2+剪切后将目标抗原(cTnI)的浓度转化为间接检测物DNA分子步行器(DNA Walker)的浓度。然后,在电极表面通过Au-S键将修饰有二茂铁的DNA双链组装在镀金玻碳电极上,并嵌入大量的发光物质多吡啶钌。此时,因二茂铁对多吡啶钌ECL信号的淬灭作用,体系ECL信号极低(关”状态)。当将所制备的DNA分子步行器被滴加到电极表面之后,DNA Walker与二茂铁修饰的DNA互补配对,经Nt.AlwI核酸内切酶识别、剪切后,DNA Walker继续与下一段二茂铁修饰的DNA互补配对,从而再次被Nt.AlwI核酸内切酶识别、剪切。如此重复,二茂铁修饰的DNA被先后剪切掉,多吡啶钌的ECL信号得到恢复(“开”状态)。通过上述方法,构建了一种基于DNA Walker的“关-开”型ECL免疫传感器,通过目标检测物cTnI到间接检测物DNA分子步行器的转化,得到ECL信号强度与cTnI的定量关系,实现了对cTnI的高灵敏检测(传感器的制备如图8所示)。
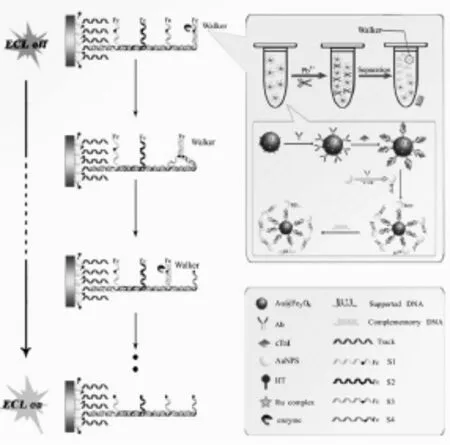
图8 基于DNA walker的ECL免疫传感器的构建[23]Fig.8Principles of the ECL biosensor based on DNA walker.Copyright 2015 RSC
3 寻找新型高效的电致化学发光试剂及共反应试剂
ECL试剂与其对应的共反应试剂是ECL两大基本要素。所以,在ECL技术发展的过程中,对新型发光试剂及高效共反应的试剂的探索一直都是研究的重点。目前,研究比较成熟且应用较为广泛的ECL试剂有:联吡啶钌及其衍生物、鲁米诺及其衍生物以及一些金属量子点(如CdTe及CdS等)。对于这些发光试剂常用的共反应试剂包括胺类物质(如三丙胺TPA)、过氧化氢(H2O2)、过硫酸根(S2O82-)及氧气(O2)等。为了寻求发光效率更高、稳定性更强、生物兼容性更好且更易功能化的发光试剂,以及生物毒性更小、催化效率更高且更易标记的新型共反应试剂,研究者们做着不断地努力。
例如,近期以三聚氰胺为碳源制备的类石墨烯的g-C3N4,作为一种新型的发光材料,就受到了广泛的关注[24-25]。Chen等[26]用纳米金修饰所制备的具有层状结构的g-C3N4形成Au-g-C3N4NHs复合纳米材料。直接将该纳米复合物修饰于电极表面并固载抗体,并将共反应试剂过硫酸根(S2O82-)置于检测底液之中,就制得了检测癌胚抗原CEA的免标记型ECL免疫传感器(如图9所示)。方案中,纳米金不仅很好地改善了g-C3N4的溶解性及稳定性,而且其良好的导电性很好地促进了g-C3N4的ECL信号,提高了检测灵敏度。
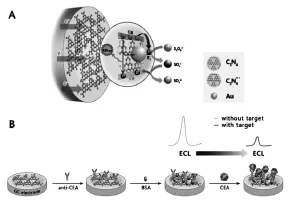
图9 Au-g-C3N4NHs的ECL机理(A)及ECL免疫传感器的构建(B)[26]Fig.9(A)The ECL mechanism of the Au-g-C3N4NHs in the presensce of S2O82-(B)The construction of the ECL immunosensor based on Au-g-C3N4.Copyright 2014 ACS
4 提高发光试剂与共反应试剂的固载并改善二者的作用效率
在研究之初,通常将ECL试剂或共反应试剂置于检测底液中。然而,这种方式不但增加了试剂用量,而且一些发光试剂及共反应试剂具有毒性大、易挥发的缺点,增加了操作难度及测量误差。故而,探寻发光试剂与共反应试剂的新型固载方式,在节约试剂用量的同时,提高二者的固载量,改善二者与电极间电子传递效率,是提高ECL检测灵敏度的有效方式。
Liao等[27]使用含具有良好成膜性质的全氟磺酸-聚四氟乙烯(Nafion)的纳米混合溶液修饰电极,经静电吸附将发光试剂Ru(bpy)32+固载于电极表面,再修饰上纳米金之后即可固载一抗蛋白。同时,利用脱铁蛋白包裹共反应试剂聚乙烯亚胺(PEI)并将其负载于碳纳米管上固载二抗蛋白。经夹心免疫反应后,制得了信号增强型的检测人绒毛膜促性腺激素(HCG)的ECL免疫传感器(如图10所示)。该方案同时实现了发光试剂与共反应试剂的固载,并且在不同的pH作用下,脱铁蛋白可以解体并释放出PEI,极大地增强了Ru(bpy)32+的ECL信号,提高了检测灵敏度。
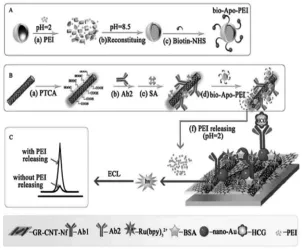
图10 检测HCG的ECL免疫传感器的构建[27]Fig.10The construction of the ECL immunosensor for detection of HCG.Copyright 2012 RSC
与上述例子类似,在ECL生物传感器的构建中,发光试剂与共反应试剂的固载通常会引入各种比表面积大、生物兼容性好的纳米材料作为支撑。为了进一步提高固载量,研究者们做了很多尝试。如,Li等[28]直接利用常用的发光试剂Ru (bpy)32+为母体,经溶剂蒸发诱导的自成核过程形成线状的纳米材料(如图11所示)。相比于单分子状态的Ru(bpy)32+,通过这种自成核方式制备的纳米结构的发光体显著提高了Ru(bpy)32+分子的固载量及ECL效率,也使得基于该纳米材料所构建的ECL传感器的灵敏度明显增加。这也为其它发光试剂及共反应试剂的固载提供了很好的思路。
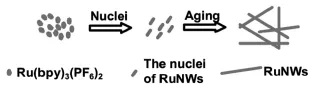
图11 RuNWs的制备示意图[28]Fig.11Schematic illustration for the formation of the RuNWs.Copyright 2012 Wiley
研究表明,通过吸附、交联、包埋或嵌入等方式可以将发光试剂或共反应试剂固载于电极表面。然而,不同固载方式的固载效率却存在很大的差别。并且,一些物质易溶于水、易挥发、难标记的缺点(如TPrA、H2O2、O2、S2O82-等)使其难于固载。所以,如何更好地提高共反应试剂对发光试剂的作用效率是另一关键问题。2015年,Ma等[29]提出了共反应促进剂(co-reaction accelerator)的概念,即指一类对发光试剂-共反应试剂体系有促进作用的一类物质。CdTe QDs-S2O82-是一种研究较成熟的ECL共反应体系。Ma等在研究中发现,向CdTe QDs-S2O82-体系中加入氨基脲(Sem)后,Sem可以很好地促进共反应试剂S2O82-的氧化,并催化CdTe QDs-S2O82-的ECL反应。基于此,研究中构建了信号增强型的、并用于检测凝血酶的ECL适体传感器(如图12所示)。体系中Sem就是S2O82-的共反应促进剂,在其作用下传感器的检测灵敏度得到了极大的提高。
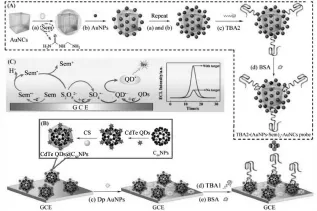
图12 适体传感器的制备过程及可能的发光机理示意图[29]Fig.12Preparation process illustration of ECL aptasensor and possible luminescence mechanism. Copyright 2015 ACS
利用酶催化反应原位产生共反应试剂,不仅可以解决某些共反应试剂难标记、不稳定等缺点,还可很好地提高其对发光试剂的催化效率。Kurita等[30]在电极表面利用乙酰胆碱酯酶催化底物乙酰硫胆碱反应产生硫胆碱,并通过Au-S使其在电极表面累积。当发光试剂Ru(bpy)32+存在时,硫胆碱作为共反应试剂极大地增强了ECL强度(如图13所示)。
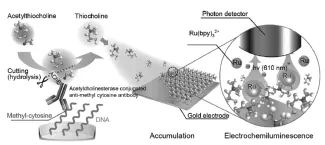
图13 基于酶催化反应的ECL传感器的构建示意图[30]Fig.13Schematic illustration of methyl-cytosine determination with the ECL method.Copyright 2012 ACS
然而,通过各种固载及酶催化反应等方式虽然在一定程度上增强了ECL强度、减少了误差,但仍存在以下不足:(1)基于表面固载和酶催化原位产生共反应试剂的方法获得的ECL稳定性不理想,且酶存在易失活、反应条件苛刻等问题;(2)共反应试剂与发光试剂分子间的相互作用通常伴有能量损失,且存在电子传递速度慢、效率低等缺点,限制了发光强度的提高。鉴于此,自增强型ECL试剂被提了出来,即是指在分子结构中同时含有发光基团及共反应基团的分子。这种自增强分子将发光试剂与共反应试剂两个分子之间的相互作用转换到同一分子内的不同基团的相互作用,从而缩短了两个作用基团的作用距离、减少了能量损失,显著增强了发光试剂的ECL强度。例如,一些基于钌配合物的自增强型ECL试剂如图14所示[31]。将这种自增强型的ECL试剂引入到ECL生物传感器的构建中可简化操作步骤、并显著提高检测的灵敏度。然而,有关这类型的ECL试剂的研究尚处于起步阶段,关于其结构特点和发光效率增强的作用机制尚不完全明确。因此,设计分子结构合理的自增强型ECL分子,探讨其发光作用机制及其在ECL生物传感器构建中的应用研究具有重要的理论意义和实用价值。
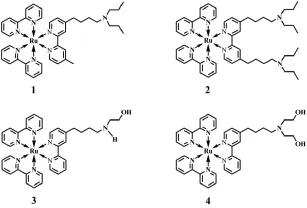
图14 一些自增强型钌配合物结构图[31]Fig.14Structures of some self-enhanced ruthenium(II) tris-bipyridyl complexes.Copyright 2009 RSC
5 展望
近年来,ECL生物传感器的研究得到了飞速的发展,在传感器的设计、分析性能以及应用范围等研究方面取得了显著的进展,并被广泛地应用于各种疾病相关生物分子的灵敏检测。然而,随着临床检验学的进一步发展,对分析方法的构建提出了更高的要求,也促使ECL生物传感器相关研究的进一步发展。如何制备新的具有更高灵敏度、选择性及特异性的ECL生物传感器,并不断实现微型化、功能多样化及集成化是后面所要解决的主要问题。
[1]Jie G F,Zhang J J,Wang D C,et al.Electrochemiluminescence immunosensor based on CdSe nanocomposites [J].Anal.Chem.,2008,87:4033-4039.
[2]Xu S J,Liu Y,Wang T H,et al.Positive potential operation of a cathodic electrogenerated chemiluminescence immunosensor based on luminol and graphene for cancer biomarker detection[J].Anal.Chem.,2011,83:3817-3823.
[3]Bertoncello P,Forster R J.Nanostructured materials for electrochemiluminescence(ECL)-based detection methods:Recent advances and future perspectives[J]. Biosens.Bioelectron.,2009,24:3191-3200.
[4]Li J X,Yang L X,Luo S L,et al.Polycyclic aromatic hydrocarbon detection by electrochemiluminescence generating Ag/TiO2nanotubes[J].Anal.Chem.,2010,82: 7357-7361.
[5]Han M,Li Y R,Niu H Y,et al.Facile synthesis of PbSe hollow nanostructure assemblies via a solid/liquid-phase chemical route and their electrogenerated chemiluminescence properties[J].Chem.Eur.J.,2011,17:3739-3745.
[6]Wang H J,Yuan R,Chai Y Q,et al.An ultrasensitive peroxydisulfate electrochemiluminescence immunosensor for Streptococcus suis serotype 2 based on L-cysteine combined with mimicking bi-enzyme synergetic catalysis to in situ generate coreactant[J].Biosens.Bioelectron., 2013,43:63-68.
[7]Zhou Y,Zhuo Y,Liao N,et al.Ultrasensitive immunoassay based on a pseudobienzyme amplifying system of choline oxidase and luminol-reduced Pt@Au hybrid nanoflowers[J].Chem.Commun.,2014,50:14627-14630.
[8]Li F,Cui H.A label-free electrochemiluminescence aptasensor for thrombin based on novel assembly strategy of oligonucleotide and luminol functionalized gold nanoparticles[J].Biosens.Bioelectron.,2013,39:261-267.
[9]Li D,Muller M B,Gilje S,et al.Processable aqueous dispersions of graphene nanosheets[J].Nat.Nanotechnol., 2008,3:101-105.
[10]Wang J,Han H Y,Jiang X C,et al.Quantum dot-based near-infrared electrochemiluminescent immunosensor with gold nanoparticle-graphene nanosheet hybrids and silica nanospheres double-assisted signal amplification [J].Anal.Chem.,2012,84:4893-4899.
[11]Guo Z H,Dong S J.Electrogenerated chemiluminescence from Ru(BPY)32+ion-exchanged in carbon nanotube/perfluorosulfonated ionomer composite films[J].Anal. Chem.,2004,76:2683-2688.
[12]Lei Y M,Huang W X,Zhao M,et al.Electrochemiluminescence resonance energy transfer system:mechanism and application in ratiometric aptasensor for lead ion[J]. Anal.Chem.,2015,87:7787-7794.
[13]Li L L,Ji J,Fei R,et al.A facile microwave avenue to electrochemiluminescent two-color graphene quantum dots[J].Adv.Funct.Mater.,2012,22:2971-2979.
[14]Zhao M,Zhuo Y,Chai Y Q,et al.Au nanoparticles decorated C60nanoparticle-based label-free electrochemiluminesence aptasensor via a novel“on-off-on”switch system[J].Biomaterials,2015,52:476-483.
[15]Zhu W J,Lv X H,Wang Q,et al.Ru(bpy)32+/nanoporous silverbased electrochemiluminescence immunosensor for alpha fetoprotein enhanced by gold nanoparticles decorated black carbon intercalated reduced graphene oxide [J].Sci.Rep.,2016,6:20348.
[16]Jie G F,Liu P,Zhang S S.Highly enhanced electro-chemiluminescenceofnovelgold/silica/CdSe-CdS nanostructures for ultrasensitive immunoassay of protein tumor marker[J].Chem.Commun.,2010,46:1323-1325.
[17]Zhang L H,Liu B F,Dong S J.Bifunctional nanostructure of magnetic core luminescent shell and its application as solid-state electrochemiluminescence sensor material [J].J.Phys.Chem.B,2007,111:10448-10452.
[18]Dong Y P,Gao T T,Zhou Y,et al.Electrogenerated chemiluminescence resonance energy transfer between luminol and CdSe@ZnS quantum qots and its sensing application in the determination of thrombin[J].Anal. Chem.,2014,86:11373-11379.
[19]Wang J X,Zhuo Y,Zhou Y,et al.Electrochemiluminescence immunosensor based on multifunctional luminolcapped AuNPs@Fe3O4nanocomposite for the detection of mucin-1[J].Biosens.Bioelectron.,2015,71:407-413.
[20]Maxwell D J,Taylor J R,Nie S M.Self-assembled nanoparticle probes for recognition and detection of biomolecules[J].J.Am.Chem.Soc.,2002,124:9606-9612.
[21]Li D,Song S P,Fan C H.Target-responsive structural switching for nucleic acid-based sensors[J].Accounts Chem.Res.,2010,43:631-641.
[22]Chen Y,Xu J,Su J,et al.In situ hybridization chain reaction amplification for universal and highly sensitive electrochemiluminescent detection of DNA[J].Anal. Chem.,2012,84:7750-7755.
[23]Xu Z Q,Dong Y W,Li J Y,et al.A ferrocene-switched electrochemiluminescence“off-on”strategy for the sensitive detection of cardiac troponin I based on target transduction and a DNA walking machine[J].Chem. Commun.,2015,51:14369-14372.
[24]Cheng C M,Huang Y,Tian X Q,et al.Electrogenerated chemiluminescence behavior of graphite-like carbon nitride and its application in selective sensing Cu2+[J]. Anal.Chem.,2012,84:4754-4759.
[25]Cheng C M,Huang Y,Wang J,et al.Anodic electrogenerated chemiluminescence behavior of graphite-like carbon nitride and its sensing for Rutin[J].Anal.Chem., 2013,85:2601-2605.
[26]Chen L C,Zeng X T,Si P,et al.Gold nanoparticlegraphite-like C3N4nanosheet nanohybrids used for electrochemiluminescent immunosensor[J].Anal.Chem., 2014,86:4188-4195.
[27]Liao N,Zhuo Y,Chai Y Q,et al.Amplifed electrochemiluminescent immunosensing using apoferritin-templated poly(ethylenimine)nanoparticles as co-reactant[J]. Chem.Commun.,2012,48:7610-7612.
[28]Li Q,Zheng J Y,Yan Y L,et al.Electrogenerated chemiluminescence of Metal-Organic complex nanowires:reduced graphene oxide enhancement and biosensing application[J].Adv.Mater.,2012,24:4745-4749.
[29]Ma M N,Zhuo Y,Yuan R,et al.New signal amplification strategy using semicarbazide as co-reaction accelerator for highly sensitive electrochemiluminescent aptasensor construction[J].Anal.Chem.,2015,87:11389-11397.
[30]Kurita R,Arai K,Nakamoto K,et al.Determination of DNA methylation using electrochemiluminescence with surface accumulable coreactant[J].Anal.Chem.,2012, 84:1799-1803.
[31]Sun S G,Yang Y,Liu F Y,et al.Intra-and intermolecular interaction ECL study of novel ruthenium trisbipyridyl complexes with different amine reductants[J]. Dalton Trans.,2009,38:7969-7974.
Progress of electrochemiluminescence biosensor based on multiple signal amplification strategies
Wang Hai-jun,Yuan Ruo*
(School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
Electrochemiluminescence(ECL)immunoassay technology,combined the high sensitivity and controllability of ECL analysis technique with high specificity of biological recognition,can significantly improve the detection sensitivity and selectivity of biological molecules,which shows great potential in clinical laboratory science.Improving the detection sensitivity has become common goal in the construction of ECL biosensor.Currently,by introducing nano-materials with excellent properties,enzymes,DNA and other biological amplification technology,finding new ECL reagents with high luminous efficiency and improving reaction efficiency of co-reagents,researchers constructed a lot of ECL biosensors with high detection sensitivity.This paper mainly reviews some commonly used signal amplification strategies in the construction of ECL biosensors in recent years.
electrochemiluminescence;biosensor;signal amplification strategies
国家自然科学基金资助项目(21575116,21275119,51473136)
*通信联系人,E-mail:yuanruo@swu.edu.cn

