复习元素化合物的“十大观念”
黑龙江 卢国锋
复习元素化合物的“十大观念”
黑龙江 卢国锋
元素化合物知识以描述性为主,记忆困难,出题角度多样,学生普遍存在记不住、不会用、用就错的顽疾。本文结合元素化合物知识的自身特点,总结归纳复习中应树立的“十大观念”。
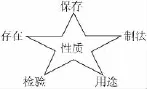
观念一:一体观
每种物质按以下图示进行联想:
【例1】
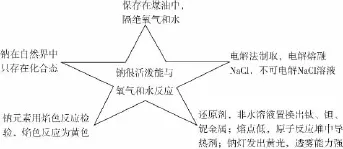
观念二:强弱观
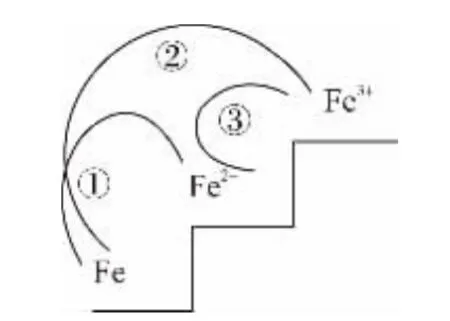
(1)铁是化学界的变色龙,遇到氧化性弱的氧化剂失去2个电子呈+2价,遇到氧化性强的氧化剂失去3个电子呈+3价。
【例2】
①如非金属(S、I2)、非氧化性酸(HCl、稀H2SO4)、盐(CuSO4、FeCl3)。反应如下:
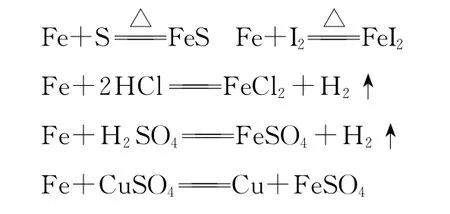

②如非金属(Cl2、Br2)、氧化性酸(HNO3)。反应如下:

铁与氧化性强的HNO3反应也能生成+2价铁,这取决于铁的量,过量的铁和稀硝酸反应:3Fe+8HNO3(稀)3Fe(NO3)2+2NO↑+4H2O。非溶液中不存在此问题,如足量Fe和少量Cl2反应仍为FeCl3。
Fe遇冷或常温下浓H2SO4或浓HNO3会发生钝化反应,表面生成致密氧化膜阻止继续反应,如果加热会破坏致密层反应能进行。
③+2价Fe遇到氧化性强的非金属(Cl2、Br2)、氧化性酸(HNO3)强氧化性的盐(KMnO4、K2Cr2O7)、过氧化物(H2O2),被氧化成+3价Fe。

(2)同主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,失电子能力逐渐增强,得电子能力逐渐减弱。金属性强则其单质与水(或酸)反应置换出氢的越容易,或其氢氧化物碱性强。
【例3】ⅠA族金属性:Li<Na<K<Rb<Cs<Fr,推知K、Rb、Cs、Fr与水剧烈反应,甚至爆炸;碱性:LiOH<NaOH<KOH<RbOH<CsOH<FrOH。ⅦA族氯、溴、碘非金属性逐渐减弱,因此氯气能把溴、碘从它们的卤化物溶液或氢化物溶液中置换出来,。
(3)同周期元素从左到右核电荷数依次增多,原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强。非金属性强则最高氧化物的水化物酸性强,与氢气反应容易,生成气态氢化物稳定。
【例4】第三周期Na、Mg、Al、Si、P、S、Cl,金属性:Na>Mg>Al,推知Na与冷水剧烈反应,Mg与沸水反应迅速,与酸剧烈反应,Al与酸反应平缓。NaOH是强碱Mg(OH)2中强碱Al(OH)3是两性氢氧化物。非金属性:Si<P<S<Cl,推知Si→Cl与氢气反应由难到易,气态氢化物稳定性:SiH4<PH3<H2S<HCl;最高价氧化物对应水化物(含氧酸)酸性:H2SiO3<H3PO4<H2SO4<HClO4。
观念三:粒子观
物质有哪些微观粒子,其粒子就会体现相关性质,粒子不同导致性质差异。
【例5】新制氯水的性质可以从以下方面去考虑:
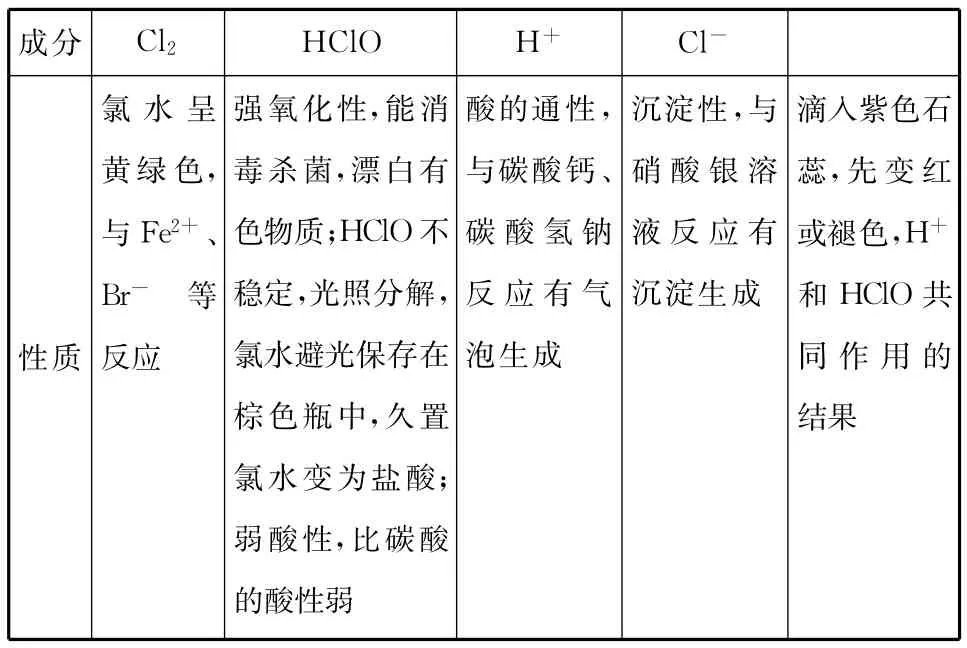
成分 Cl2 HClO H+ Cl -沉淀性,与硝酸银溶液反应有沉淀生成性质氯水呈黄绿色,与Fe2+、Br-等反应强氧化性,能消毒杀菌,漂白有色物质;HClO不稳定,光照分解,氯水避光保存在棕色瓶中,久置氯水变为盐酸;弱酸性,比碳酸的酸性弱酸的通性,与碳酸钙、碳酸氢钠反应有气泡生成滴入紫色石蕊,先变红或褪色,H+和HClO共同作用的结果
【例6】


观念四:类别观
【例7】

观念五:价态观
高价氧化低价还,中间价态两俱全。
【例8】

【例9】

观念六:特性观
【例10】硅的特殊性
①自然界中没有游离态的硅,以二氧化硅、硅酸盐等形式存在,不能从硅的原子结构和化学性质不活泼解释,而从硅是亲氧元素解释。
②非金属氧化物一般由分子构成的,而二氧化硅却由原子构成,因此二氧化硅硬度大、熔点高。
②非金属单质与强碱溶液反应一般不生成氢气,而硅可与强碱反应:Si+2NaOH+H2ONa2SiO3+2H2↑。
③因硅还有亲氟性。非金属单质一般不与弱氧化性酸反应,而硅能与氢氟酸反应:S i+4HFSiF4↑+2H2↑。酸性氧化物一般不与酸反应,而SiO2能与HF反应:SiO2+4HFSiF4↑+2H2O。
④二氧化硅是酸性氧化物,却不能用SiO2与水不反应制备硅酸,一般用可溶性硅酸盐跟酸作用来制备:Na2SiO3+2HClH2SiO3↓+2NaCl。
⑤较强酸可以把较弱酸从其盐溶液中制取出来,如Na2SiO3+CO2+H2ONa2CO3+H2SiO3↓,而反应也能进行,因前者为溶液,后者体系为非溶液,并有气体放出。
【例11】铝的特性
酸盐2Al+2NaOH+2H2O2NaAlO2+3H2↑
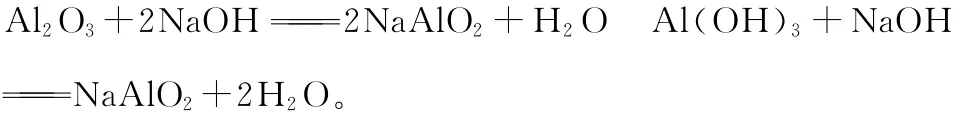
Al3+只存在于酸性溶液中,只存在于碱性溶液中,两者之间发生反应生成沉淀,+Al3++6H2O4Al(OH)3↓。
②铝是活泼金属,在空气中或遇到浓硫酸(浓硝酸),表面生成致密氧化膜,起到保护作用。
观念七:浓度观
Cl2↑+2H2O,1mol MnO2与含4mol HCl浓盐酸加热反应,随着反应的进行,浓盐酸消耗挥发及水的生成,使浓盐酸浓度降低转变为稀盐酸,导致反应停止,生成氯气小于1mol,溶液中含剩余HCl。
【例13】Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O,若足量的铜与一定量的浓硝酸反应,同样随着反应的进行,浓硝酸浓度减低转变为稀硝酸,反应为3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O,生成气体是NO2、NO混合气体。
观念八:顺序观
物质的性质强弱差异,导致反应物遵循强强优先反应原则,即体系中最强氧化剂与最强还原剂优先反应;体系中最强碱与最强酸反应;体系中生成溶解度小的优先反应。
【例14】(1)向含有Fe3+和Cu2+的溶液中加铁粉,因为Fe3+的氧化性强于Cu2+,依次发生:2Fe3++Fe3Fe2+,Cu2++FeCu+Fe2+。
(2)向FeBr2溶液中逐滴加入氯水,因为Fe2+的还原性强于Br-,依次发生:2Fe2++Cl22Fe3++2Cl—,2Br—+Cl22Cl—+Br2。
连续反应即反应的生成物能与反应物继续反应,使反应滴加顺序不同现象不同,可应用在不用任何试剂相互滴加即可检验。
【例15】(1)NaOH溶液和AlCl3溶液的反应
①向含有AlCl3溶液的试管中滴加NaOH溶液至过量。
实验现象:开始时产生沉淀,且逐渐增多,当NaOH足量时,沉淀开始溶解至消失。
反应的化学方程式:
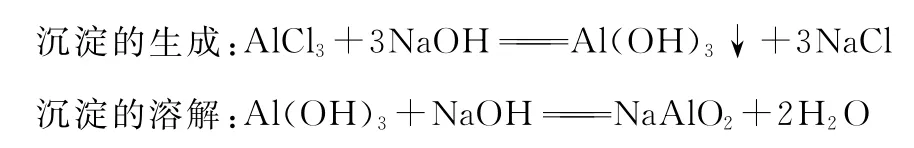
②向装有NaOH溶液的试管中滴加AlCl3溶液至过量。
实验现象:局部产生白色沉淀,振荡溶解,AlCl3足量时产生的沉淀不再溶解至产生沉淀最大量。
反应的化学方程式:

观念九:符号观
化学符号是国际上统一规定的,用来表示化学物质的组成、结构和化学过程的科学符号。化学符号不仅是中学化学知识的重要组成部分,而且是学习化学知识或化学事实的重要表征形式之一,具有知识性和工具性的高度统一。
表示物质的符号:元素符号、离子符号、同位素符号、最简式、分子式、电子式、原子结构示意图、离子结构示意图。

表示化学变化的符号:化学方程式、电离方程式、离子方程式、电极反应方程式。
①切记“所问所答”,书写哪种表达式;②物质化学式书写正确,不能漏写;③有反应条件的必须准确注明反应条件,“点燃、△、催化剂、高温等”;④原子守恒、电荷守恒、电子守恒;⑤有气体参加的反应 ,生成物有气体不标“↑”,有机化学方程式都用“→”。
【例17】①足量的碳酸氢钠溶液与少量的石灰水反应的离子方程式:___________________;
②足量的石灰水与少量的碳酸氢钠溶液反应的离子方程式:___________________。
NaHCO3与Ca(OH)2反应包含中和与沉淀两种反应,中要与Ca2+结合为沉淀,则首先解决H+与的电离问题,推断NaHCO3与Ca(OH)2反应先中和后沉淀,写两者反应的离子方程式时,遵循少量者为1mol,先中和后沉淀的原则分析粒子的反应。假设①中少量的石灰水Ca(OH)2为1mol,电离出2mol OH-,中和需要2mol,生成2mol H2O和2mol,其中1mol与1mol Ca2+结合生成CaCO3,剩余1mol,①的离子方程式为。同理分析②得离子方程式为。
观念十:实验观
实验不仅是一种实践活动,还是科学方法论的重要组成成分,实验方法论包括很多具体的实验方法,如测定、实验条件的控制、实验观察、实验记录、实验数据的表格化和线图化处理。科学逻辑方法如比较、分类、归纳、概括、模型、假说。
【例18】分离、提纯方法选择。

【例19】铝热反应联想实验的引发物是氯酸钾和镁带,点燃镁带释放热量引发反应,现象有耀眼强光、火星四射、熔融物落入盛沙子的蒸发皿中,此反应可应用在铁轨焊接高熔点金属的冶炼。实验细节的思考,内层纸漏斗底部剪一小孔用水润湿的目的是:使熔融物易于落下且防止纸漏斗着火。
(作者单位:黑龙江省大庆市第五十六中学)

