反应热计算的考核途径及热量大小比较
湖南 龙 威
反应热计算的考核途径及热量大小比较
湖南 龙 威
不少同学在学习化学热效应时,不会计算反应热,总是抱怨热量计算的复杂及热量大小比较的困难,这方面的计算确实是一个知识难点,现归纳反应热计算的考核途径及盖斯定律,希望能对这方面的学习发挥促进和激励作用。
一、利用热化学方程式进行有关计算
根据已知的热化学方程式和已知的反应物或生成物的物质的量或反应吸收或放出的热量,可以把反应热当作“产物”,计算反应放出或吸收的热量。
【例1】已知16g固体硫完全燃烧时放出148.4kJ的热量,写出表示硫燃烧的热化学方程式:___________________。
【解析】16g固体硫完全燃烧时放出148.4kJ的热量,则1mol固体硫完全燃烧放出296.8kJ的热量,据此可写出表示硫燃烧的热化学方程式。
【答案】S(s)+O2(g)SO2(g)
ΔH=-296.8kJ/mol
二、根据燃烧热数据进行计算
灵活利用公式:Q=燃烧热×n(可燃物),可进行相关计算。如已知H2的燃烧热为ΔH=-285.8kJ·mol-1,燃烧H2的物质的量为2mol,则H2燃烧放出的热量为2mol× 285.8kJ·mol-1=571.6kJ。
【例2】1.5g火箭燃料二甲基肼(CH3—NH—NH—CH3)完全燃烧,放出50kJ热量,则二甲基肼的燃烧热ΔH为( )
A.-1 000kJ/mol B.-1 500kJ
C.-2 000kJ/mol D.-2 000kJ
【解析】1.5g二甲基肼的物质的量是0.025mol,根据燃烧热的定义可知,1mol二甲基肼完全燃烧放出的热量应该为:1/0.025×50kJ/mol=2 000kJ/mol,即二甲基肼的燃烧热ΔH为-2 000kJ/mol。
【答案】C
三、根据图示进行反应热的计算
公式:ΔH=H(生成物)-H(反应物)
如图Ⅰ:ΔH=H1-H2<0,该反应为放热反应;图Ⅱ:ΔH=H2-H1>0,该反应为吸热反应。

【例3】如图是某条件时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )

A.该反应的热化学方程式为:N2+3H22NH3ΔH=-92kJ·mol-1
B.正反应的活化能大于逆反应的活化能
C.b曲线是加入催化剂时的能量变化曲线
D.使用催化剂能改变反应的焓变
【解析】A项中未标状态;B项中正反应的活化能为508 kJ·mol-1,逆反应的活化能为600kJ·mol-1,逆反应的活化能大;D项,焓变是反应的热效应,催化剂不能改变反应的热效应。
【答案】C
四、根据旧键断裂和新键形成过程中的能量差计算
若反应物旧化学键断裂吸收能量E1,生成物新化学键形成放出能量E2,则反应的ΔH=E1-E2。
【例4】已知1g氢气完全燃烧生成水蒸气时放出热量
A.920kJ B.557kJ
C.436kJ D.188kJ
【解析】根据能量守恒定律,拆开旧键所需的能量等于新键形成释放出的能量加吸收的能量(或减放出的能量)463kJ×4-121kJ×4=496kJ+2Q(H—H),得Q(H—H)=436kJ。
【答案】C
五、盖斯定律及应用
(1)内容:化学反应不管是一步完成还是分几步完成,其反应热是相等的,即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
(2)意义:间接计算某些反应的反应热。
(3)应用:

方程式 反应热间的关系aAΔH→1B、AΔH→21aB ΔH1=aΔH2AΔH1ΔH2B ΔH1=-ΔH2ΔH=ΔH1+ΔH2
【例5】肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
(1)找关键人,选聘离退休老党员,如离退休支部书记、老协负责人、有特长外向的老专家,使他们离职不离心,搭建平台,使得他们有机会继续发挥余热,活跃在学院,全方位地搞好青年教育,做到全员育人。如,深入学生支部开展讲座,深入开学典礼和毕业典礼,开展“院士关怀”报告,讲述历史、讲述文化传承、讲述科技报国,以及自身发展奋斗的经验。
已知:①N2(g)+2O2(g)N2O4(l)
ΔH1=-19.5kJ/mol
②N2H4(l)+O2(g)N2(g)+2H2O(g)
ΔH2=-534.2kJ/mol
写出肼和N2O4反应的热化学方程式:______________。
【解析】肼与N2O4反应生成N2和水蒸气:2N2H4+ N2O43N2+4H2O,观察已知的两个热化学方程式运用盖斯定律可知,②×2-①得:2N2H4(l)+N2O4(l3N2(g)+4H2O(g) ΔH=ΔH2×2-ΔH1=-1 048.9kJ/mol。
【答案】2N2H4(l)+N2O4(l3N2(g)+4H2O(g)
ΔH=-1 048.9kJ/mol
【方法技巧点津】
“五步”解决有关盖斯定律的计算问题

六、反应热大小的比较
对于放热反应来说,ΔH=-QkJ·mol-1,虽然“-”仅表示放热的意思,但在比较大小时要将其看成真正意义上的“负号”,即放热越多,ΔH反而越小。另外,要注意同种物质在不同状态时所具有的能量关系(相同物质的量时):固体<液体<气体。
1.同一反应,生成物状态不同时
2.同一反应,反应物状态不同时


ΔH2+ΔH3=ΔH1,则ΔH3=ΔH1-ΔH2,
又ΔH3<0,所以ΔH1<ΔH2。
也可以用图示法比较:如图中很直观得出数值大小关系,因放热反应,数值越大,ΔH越小,则有ΔH1<ΔH2。

3.两个有联系的不同反应相比

根据常识可知:

ΔH3<0又因为ΔH2+ΔH3=ΔH1,所以ΔH2>ΔH1。
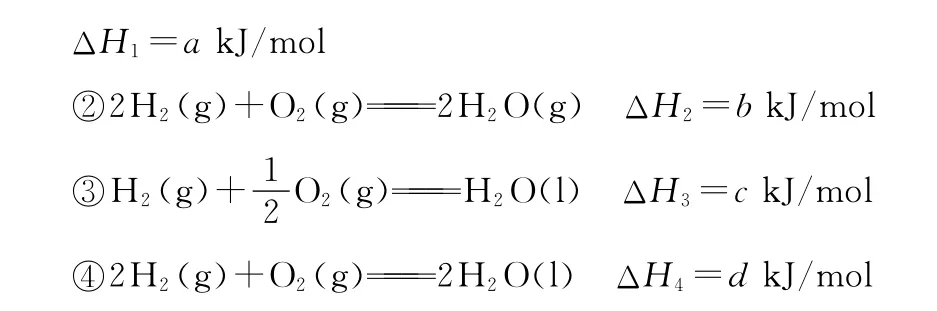
下列关系式正确的是 ( )
A.a<c<0 B.b>d>0
C.2a=b<0 D.2c=d>0
【解析】H2在O2中燃烧为放热反应,a、b、c、d都小于0,所以B、D均错误;反应①-③得H2O(l)H2O(g) ΔH= ΔH1-ΔH3=(a-c)kJ/mol,而ΔH>0,即a-c>0,a>c,A错误;比较①②两个热化学方程式得b=2a。
【答案】C
(作者单位:湖南省湘乡市湖铁实验学校)

