突破非金属元素单质及其化合物认识误区
江苏 张志立
突破非金属元素单质及其化合物认识误区
江苏 张志立
非金属单质及其化合物既是中学的基础,又与考生们的生活息息相关,因此考生在学习时要尽量做到知识与用途相结合,理论与实际相结合。要采用对比,归纳异同,非金属及其化合物的种类非常多,应该学会用对比的方法来认识物质的共性和特性、联系和区别,走出误区,加深理解和记忆,从而提高学习效率。
一、辨别不清碳、硅及其化合物的特殊性 注意抓共性与特殊性
【考情分析】碳、硅及其化合物的特殊性,部分考生不能准确辨别,导致有些问题解答错误。平时应常将化学性质与框图题相结合,重点考查考生的创新思维以及理论联系实际的能力。硅及其化合物既具有一般的非金属元素及其化合物的共性、又有其特性。如酸性氧化物一般不与酸反应,但SiO2能与HF发生反应。再如硅的还原性比碳的强,而碳在高温下能从SiO2中还原出硅等。学习时要注意对比,才能顺利解答问题。
【例1】二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(如下图)。下列说法正确的是 ( )

A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B.玛瑙和红宝石的主要成分都是SiO2,SiO2和Si都是制造光导纤维的材料
C.虽然高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3
D.图中所示转化反应中非氧化还原反应的数目少于氧化还原反应的数目
【易错分析】本题考查了SiO2的化学性质,易错选A,SiO2是酸性氧化物,但能与氢氟酸反应。有的考生对C项解释不清,在水溶液中碳酸的酸性比硅酸强,依据“强酸制弱酸”原理,CO2可与硅酸盐溶液反应生成硅酸,但在高温下SiO2能与Na2CO3反应生成Na2SiO3和CO2,是因为在高温下生成CO2的离开体系而使反应进行到底。这就要求考生在学习过程中加强对研究对象的性质的对比,找出共性以及特殊性。
【解析】SiO2只能与特殊酸反应,而与其他酸不反应,与酸反应没有普遍性,所以不能说明其是两性氧化物,A项错误;玛瑙的主要成分是SiO2,而红宝石的主要成分是Al2O3,硅是半导体材料,二氧化硅是光导纤维材料,B项错误;高温下SiO2能与Na2CO3反应生成Na2SiO3和CO2,常温下SiO2不与Na2CO3反应,所以不能说明H2SiO3的酸性强于H2CO3,C项正确;图中所示有3个氧化还原反应,6个非氧化还原反应,所以图中所示转化反应中非氧化还原反应的数目多于氧化还原反应的数目,D项错误。
【答案】C
二、卤素及其化合物的性质掌握不牢 注意抓氧化还原反应的应用
【考情分析】解答卤素及其化合物的性质及应用时,如对氯气的实验室制取,氯水的成分及性质不能正确分析应用。以氯气为参照物,要抓住氯气的氧化性,以氧化还原反应知识作为理论指导进行分析:氯气与金属反应时生成高价金属氯化物;氯气与水、碱溶液反应时,氯气发生自身氧化还原反应。卤素单质有毒,要求考生根据所学知识,谨慎进行氯气的制备,提高绿色环保意识。
【例2】下列说法正确的是 ( )
①Cl2的化学性质活泼,它与H2混合后立即发生爆炸
②实验室制取Cl2时,为了防止环境污染,多余的氯气可以用澄清石灰水吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2的方法是将气体通入AgNO3溶液
⑤除去Cl2气体中的HCl气体,可将气体通入饱和食盐水
⑥验证Br2的氧化性强于I2:将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
A.③⑤ B.③⑤⑥ C.①②③ D.②③④
【易错分析】该题以Cl2实验为主,易错点:①反应条件把握不准;②溶液浓度大小对环境的影响;③氯水成分的复杂性和性质的多样性进行分析,确定参与反应的微粒及发生反应的实质。大多将它与其他元素及其化合物知识相结合,设置成选择题,考查氯气的氧化性、氯水的酸性和漂白性等,侧重考查考生对基础知识的掌握及应用能力。
【解析】①Cl2的化学性质活泼,它与H2混合后只有在点燃或光照条件下才立即发生爆炸;②由于澄清石灰水的浓度太低,不能很好地将多余Cl2除尽;③由于久置氯水的最终是盐酸溶液,则新制氯水的氧化性强于久置氯水;④由于氯气与水反应产生盐酸和次氯酸,遇到AgNO3溶液也会产生AgCl白色沉淀,则不能用AgNO3溶液来检验HCl气体中是否混有Cl2;⑤由于HCl极易溶于水,而Cl2在饱和食盐水中溶解度很小,可以用饱和食盐水除去Cl2气体中的HCl气体。⑥CCl4的密度大于水,I2溶于CCl4所得溶液呈紫色(或紫红色)。KI溶液中加入溴水,再加入CCl4后,下层呈紫色(或紫红色),说明CCl4中溶解了I2,从而说明溴水将KI氧化生成了I2,故Br2的氧化性强于I2。
【答案】B
三、硫及其化合物的实验无法判断注意抓硫元素的价态变化
【考情分析】硫及其化合物的实验,常考查的知识点有SO2的漂白性、氧化性、还原性和酸性氧化物的性质,浓硫酸的氧化性,的检验等。部分考生对有些实验无法判断。解答时,要以氧化还原反应知识为理论指导,分析含硫化合物中S元素的化合价,确定能否发生变化,并利用不同价态含硫化合物的转化规律解答相关问题。
【例3】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。对实验现象的“解释或结论”错误的是 ( )

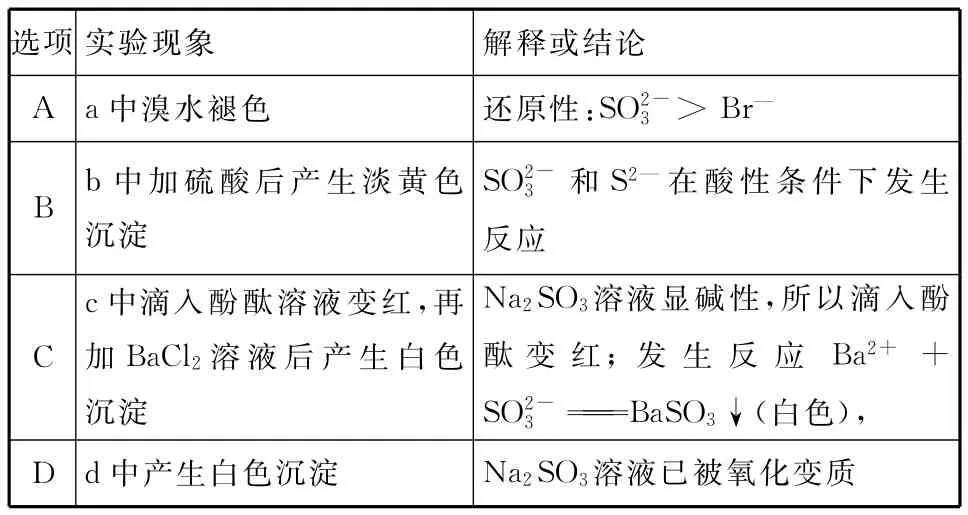
选项实验现象 解释或结论A a中溴水褪色 还原性:SO2-3>Br—B b中加硫酸后产生淡黄色沉淀SO2-3 和S2—在酸性条件下发生反应C c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀Na2SO3溶液显碱性,所以滴入酚酞变 红;发 生 反 应 Ba2++SO2-BaSO3↓(白色3),D d中产生白色沉淀 Na2SO3溶液已被氧化变质
【易错分析】本题根据含硫化合物之间的转化规律,判断四个凹槽中溶液发生的反应,并结合产生的现象,判断相应解释或结论是否合理。但有的考生对与Br—还原性强弱判断模糊。无法解释Na2SO3是否变质。正确检验Na2SO3是否变质的正确方法是:Na2SO3固体加水变成Na2SO3溶液,加入BaCl2溶液,若出现白色沉淀,再加入稀盐酸观察现象:(1)若白色沉淀全部溶解,说明Na2SO3未变质;(2)若白色沉淀部分溶解,说明Na2SO3部分变质;(3)若白色沉淀不溶解,说明Na2SO3完全变质。
【解析】Na2SO3中S显+4价,具有还原性,而Br2具有强氧化性,在溶液中发生:,该反应中是还原剂,Br—是还原产物,所以还原性:>Br—,A项正确;Na2SO3中S元素是+4价,硫化钠中S元素是-2价,二者可以在硫酸溶液中发生氧化还原反应,S元素归中到0价,即生成淡黄色硫单质沉淀,,B项正确;酚酞遇碱性溶液显红色,c中滴入酚酞后溶液变红,说明Na2SO3溶液显碱性,Na2SO3与BaCl2发生复分解反应生成BaSO3沉淀,C项正确;加入盐酸酸化的Ba(NO3)2溶液,在酸性溶液中,易被氧化为,与结合Ba2+生成BaSO4沉淀,但不能说明Na2SO3溶液已被氧化变质,因为BaSO3也是白色沉淀,D项错误。
【答案】D
四、忽略氮及其化合物的连续反应 注意反应的变化过程的分析
【考情分析】氮及其化合物的转化,如硝酸与金属、非金属单质的反应、硝酸、硝酸盐及铵盐的性质;NH3、NO2的制取及性质等知识。部分考生容易忽略氮及其化合物的连续反应,因此注意反应的变化过程的分析。侧重考查对课本基础知识的掌握及应用能力。
【例4】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是 ( )
A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B.将湿润的红色石蕊试纸放在试管口,若试纸变蓝色,则表明收集满
C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D.将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2

【易错分析】本题考查了氨气的性质,熟悉氨气的物理性质、化学性质是解题关键,注意氨气催化氧化反应实质。本题易错点是D项,非金属元素经过连续氧化有:

【解析】氨气极易溶于水,使试管内压强迅速降低,液体迅速充满试管,A项正确;因为,所以碱能使湿润的红色石蕊试纸变蓝色,B项正确;加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明碳酸氢铵受热分解,不稳定,C项正确;氨气催化氧化生成一氧化氮,一氧化氮与空气中氧气氧化生成二氧化氮,D项错误。
【答案】D
(作者单位:江苏省淮州中学)

