河北省衡水中学2016—2017学年度小学期高三年级一调考试
命题人 李兵妹
河北省衡水中学2016—2017学年度小学期高三年级一调考试
化 学
命题人 李兵妹
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间110分钟。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Mg—24 Al—27 S—32 Cl—35.5 K—39
第Ⅰ卷(选择题 共50分)
一、单项选择题(1~10每小题1分,11~30每小题2分)
1.盐是一类常用物质,下列物质可直接形成盐的是( )
①金属 ②碱性氧化物 ③碱 ④非金属 ⑤酸性氧化物 ⑥酸
A.只有①②③ B.只有④⑤⑥
C.只有①②③⑤⑥ D.全部
2.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯
②氧化性最强的是钾离子
③在自然界中均以化合态形式存在
④Li的密度最小,熔点最高
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的氧化物都只有M2O和M2O2两种形式
⑦粒子半径:Rb+>K+>Na+,Cs>Cs+
A.①②③④ B.④⑤⑥⑦
C.②⑥ D.①②③④⑤⑦
3.下列说法中正确的是 ( )
A.为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化
B.将一定量的Na2O2和NaHCO3的混合物放在一密闭容器中充分加热后,所得固体中一定含有Na2CO3
C.硫酸、纯碱、偏铝酸钠和过氧化钠分别属于酸、碱、盐和氧化物
D.将足量的稀盐酸加到Mg、AlCl3、NaAlO2组成的混合物中,只能发生一种反应
4.设NA是阿伏加德罗常数的数值,下列说法正确的是 ( )
A.1mol·L-1NaCl溶液含有NA个Na+
B.1mol Cl2与足量的铝反应,转移的电子数为3 NA
C.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
D.铁和酸反应,放出标准状况下的气体22.4L,转移的电子数必为2 NA
5.下列物质的制备方法正确的是 ( )
A.氯化铝溶液和硫化钠溶液反应制备Al2S3
B.用镁粉和空气反应制备Mg3N2
C.用铝粉和MnO2制得锰
D.用电解熔融氯化铝的方法制得单质铝
6.下列各组溶液只需通过相互滴加就可以鉴别出来的是 ( )
A.NaAlO2溶液和盐酸
B.NaHCO3溶液和Ca(OH)2溶液
C.Ba(OH)2溶液和浓MgCl2溶液
D.稀硫酸和碳酸氢钠溶液
7.如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是( )
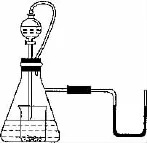
A.过氧化钠 B.氧化钠
C.钠 D.钾
8.科学的假设与猜想是科学探究的先导和价值所在。在下列假设或猜想引导下的探究肯定没有意义的是( )
A.探究SO2和Na2O2可能化合生成Na2SO4
B.探究NO和N2O可能化合生成NO2
C.探究NO2可能被NaOH溶液完全吸收,生成NaNO2和NaNO3
D.探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白
9.下列有关Na2CO3和NaHCO3性质的比较中正确的是 ( )
A.与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3
B.配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3
C.106g Na2CO3和84g NaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3
D.在Na2CO3和NaHCO3的稀溶液中加CaCl2溶液,都有白色沉淀生成
10.下列反应与Na2O2+SO2→Na2SO4相比较,Na2O2的作用相同的是 ( )
A.2Na2O2+2CO2→2Na2CO3+O2
B.2Na2O2+2SO3→2Na2SO4+O2
C.Na2O2+H2SO4→Na2SO4+H2O2
D.3Na2O2+Cr2O3→2Na2CrO4+Na2O
11.根据下图海水综合利用的工业流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在过程④⑥反应中每氧化0.2mol Br需消耗2.24L Cl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
12.取一定质量的某物质在ag氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后容器内有b g氧气,测得b>a。下列物质中满足上述结果的是 ( )
A.HCOOH B.HCHO
C.CH4D.C6H12O6
13.120mL含有0.20mol碳酸钠的溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是 ( )
A.2.0mol/L B.1.5mol/L
C.0.18mol/L D.0.24mol/L
14.向50g CuSO4溶液中放入一小块Na,待反应完全后,过滤,得到仍显蓝色的溶液44.6g,则投入的Na的质量为 ( )
A.4.6g B.4.1g
C.6.9g D.9.2g
15.不能正确表示下列反应的离子方程式是 ( )
A.Na与稀硫酸反应的离子方程式为2Na+2H+2Na++H2↑
B.Na2O2溶于水产生O2:2Na2O2+2H2O4Na++4OH-+O2↑
C.碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀:Ca2++HCO-3+OH-CaCO3↓+H2O
D.饱和碳酸钠溶液中通入过量二氧化碳气体:CO2-3+CO2+H2O2HCO3
16.下列化学实验事实及其解释不正确的是 ( )
A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,因为NaHCO3分解生成了Na2CO3
B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气
C.用洁净玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应
D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和CO2反应
17.有钠、镁、铝各n mol,分别与等体积、均含x mol HCl的盐酸反应,下列说法不正确的是 ( )
A.x<n时,钠生成的氢气最多
B.x=n时,钠、镁、铝生成的氢气一样多
C.n<x≤2n时,生成的氢气:钠<镁=铝
D.x≥2n时,生成的氢气:钠<镁<铝
18.向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )
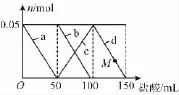
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9g
19.某同学利用下列实验探究金属铝与铜盐溶液反应:

下列说法正确的是 ( )
A.由实验1可以得出结论:金属铝的活泼性弱于金属铜
B.实验2中生成红色物质的离子方程式:Al+Cu2+Al3++Cu
C.溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
D.由上述实验可推知:用砂纸打磨后的铝片分别与H+浓度均为0.2mol·L-1的盐酸和硫酸反应,后者更剧烈
20.中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮。这种“碱剂”可能是 ( )
A.食盐 B.火碱
C.草木灰 D.胆矾
21.过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
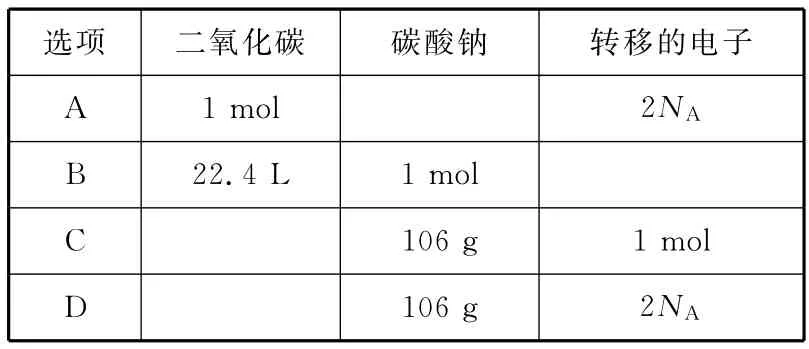
选项 二氧化碳 碳酸钠 转移的电子A 1mol 2 NAB 22.4L 1mol C 106g 1mol D 106g 2 NA
22.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且a、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是 ( )
A.a一定为KOH溶液
B.b一定为KHSO4溶液
C.c一定为AlCl3溶液
D.e一定为MgCl2溶液
23.如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量。下列反应对应的曲线错误的是( )

A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
D.向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D.向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至沉淀消失
24.一定质量的Al、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体(不含结晶水)质量比原固体增加了7.2g,则该合金的物质的量可能为 ( )
A.0.06mol B.0.05mol
C.0.08mol D.0.09mol
25.某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1盐酸,发生的现象:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.435g
下列说法中正确的是 ( )
A.该溶液中一定不含Ba2+、Mg2+、Al3+、SiO2-3、Cl-
B.该溶液中一定含有K+、AlO-2、CO2-3、Cl-
C.该溶液是否有K+需做焰色反应(透过蓝色钴玻)
D.可能含有Cl-
26.下列有关实验操作或判断正确的有 ( )
①用10mL量筒准确量取稀硫酸溶液8.0mL
②用干燥的pH试纸测定氯水的pH
③圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
④除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
⑤用食醋除去水壶中的水垢
⑥用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,熔化后的液态铝不会滴落
⑦提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
A.3个 B.4个
C.5个 D.6个
27.某固体混合物可能含有Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2、NaCl中的一种或几种,现对该混合物做如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),下列说法不正确的是 ( )
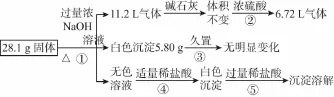
A.混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3
C.混合物中一定不存在FeCl2和NaCl
D.5.80g白色沉淀是Mg(OH)2
28.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:

下列说法不正确的是 ( )
A.固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3
B.使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为
C.试剂a选用盐酸,从溶液Ⅲ得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D.若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也叫得到纯净CaCl2·6H2O
29.加热HCOONa固体,发生的反应:
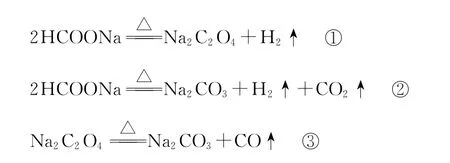
HCOONa加热分解时,固体失重率与温度的关系如图所示。下列说法正确的是 ( )

A.T<415℃时,只有反应①发生
B.反应①②不可能同时发生
C.570℃<T<600℃时,残留固体的主要成分是Na2CO3
D.残留固体中m(Na2C2O4)=m(Na2CO3)时,反应①②的反应速率相等
30.向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )

A.图中C点铝元素的存在形式是AlO-2
B.向D点溶液中通入CO2气体,立即产生白色沉淀
C.原混合液中c[Al2(SO4)3]∶c(AlCl3)=1∶2
D.OA段反应的离子方程式为3Ba2++2Al3++
第Ⅱ卷(非选择题 共50分)

(以上反应中,反应物和生成物均已给出,有的反应方程式未配平)
其中A、G为常见金属单质,L是家庭厨房必备的一种盐,主要由海水中获得。
请回答:
(1)电解L稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:______________________________________________。
(2)写出F的一种工业用途:_______________________。
(3)反应②的离子方程式为________________________。
(4)除反应⑥外,还有多种化学反应可由H生成K。下列物质能与H反应生成K的是________(填选项字母)。
a.CO2b.NaHCO3c.NaHSO4d.NaClO
e.HN4NO3f.NH3·H2O
写出你所选任意一种试剂和H反应生成K的离子方程式:_______________________________________________。
32.(10分)硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约50%。目前我国已经在技术上取得突破——用硫酸渣炼铁。Fe3+开始沉淀为氢氧化物的pH=1,沉淀完全时的pH为3.7。
Ⅰ.某探究性学习小组的同学没计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:

请回答:
(1)写出固体E的化学式:_____________________。试剂①是________。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是________。
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)写出溶液H中溶质的化学式:__________________。
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为________。
方案二:

(5)此方案制得的氧化铝含有的主要杂质是_________。
(6)写出由溶液M→固体乙这个过程中,主要化学反应的离子方程式:______________________________________;_____________________。
33.(10分)A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:

(1)向酚酞试液中加入化合物A的粉末,现象为______ ______________________________________________________。
(2)单质甲与化合物B反应的离子方程式为________。5.05g单质甲-钾合金溶于200mL水,生成0.075mol氢气,确定该合金的化学式为_________________。
(3)向一定体积某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况。

①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为_____________________________________________。
②B对应的溶液M低温蒸干后得到固体a克,将a克固体充分加热至恒重后,固体质量减少________克。
③由A、B可知,两次实验通入的CO2的体积比为________。
34.(10分)某过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如图所示仪器测定样品的纯度。
仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。
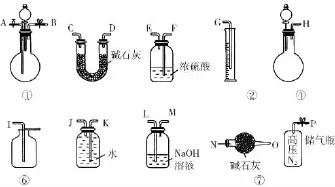
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:

(1)甲同学想通过实验测得的数据是________,他选用的装置________(填序号)是没有必要的。实验中甲同学测得气体体积为VL(20℃,1大气压),计算时他未将VL换算到标准状况,则他得到的Na2CO4的质量分数________(填“偏高”或“偏低”)。
(2)乙同学想通过实验测得的数据是________。按他测得的数据计算出的实验结果有可能偏高,原因是______ ___________________;也有可能偏低,原因是____________。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________(填序号)。
35.(12分)(1)已知20℃时的溶解度:S(Na2CO3)=21.2g;S(NaHCO3)=9.6g。则20℃恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3______________g(小数点后保留一位)。
(2)向500mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入CO2气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为________ mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________。
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液。现做如下实验:
①取440mL甲与120mL乙反应,产生1.56g沉淀;
②取440mL乙与120mL甲反应,也产生1.56g沉淀;
③取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀。
通过必要的计算和推理判定:
甲溶液为_________________溶液,其物质的量浓度为________mol·L-1;
乙溶液为_________________溶液,其物质的量浓度是________mol·L-1。
参考答案
1-5 DDBCC 6-10 ABBBD
11-15 DABAD 16-20 ADDCC
21-25 CBDAB 26-30 BADCD
31.(8分)
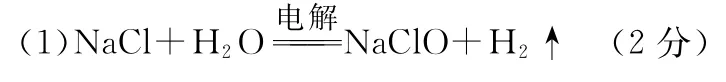
(2)用作冶炼铝的原料;用作耐火材料 (任意一条,1分)

(4)bdf (2分,选1或2个且正确1分,有错0分)
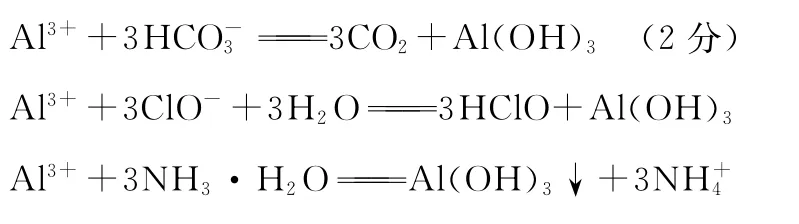
32.(10分)
Ⅰ.(1)Mg(OH)2(1分) A (1分)
(2)C (1分)
(3)NaCl、NaHCO3(只要写出NaHCO3就可给1分)
(4)灼烧(或加热) (1分)
(5)二氧化硅 (1分)
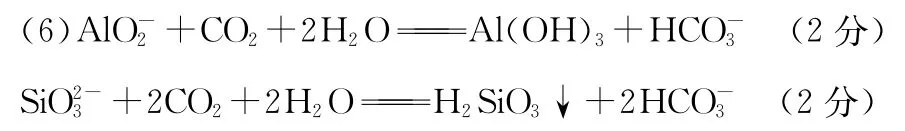
33.(10分,除标注外每空2分)
(1)溶液先变红后褪色,并有气泡生成

34.(10分)
(1)生成的氧气的体积 (1分) ③ (1分) 偏低(1分)
(2)生成的二氧化碳的质量 (1分)
空气中的水与二氧化碳进入②,增重使结果偏大(2分)
产生的二氧化碳在装置⑤③及导管中没有完全被②吸收使结果偏小 (2分)
(3)⑩①③②⑨ (2分)
35.(12分)
(1)24.3 (2分)
(2)0.3 (2分)
(3)20% (2分)
(4)AlCl3(1分) 0.5 (2分) NaOH (1分)0.5 (2分)

