不可忽视的铁及其化合物复习点津
湖南 黄银飞
不可忽视的铁及其化合物复习点津
湖南 黄银飞
纵观高考试题的命制与形式,元素化合物知识是化学中的基础,特别是金属元素的化合物的性质,在历年的高考试题中常以必考形式出现。高中所学的金属元素种类不多,所以设题的焦点几乎总集中在铁元素上,这部分内容也是高中生学习金属的难点,在这里再度提出并归纳学习,希望引起大家的高度注意。
一、铁的存在和主要性质
1.铁的存在和位置

2.铁的化学性质
铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。

二、铁的重要化合物
1.铁的氧化物
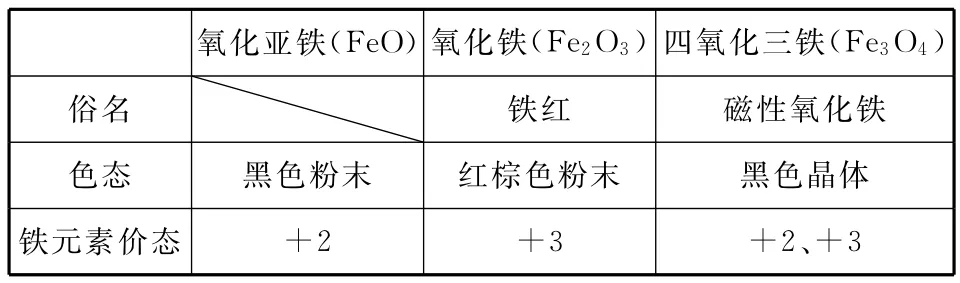
氧化亚铁(FeO)氧化铁(Fe2O3)四氧化三铁(Fe3O4)俗名 铁红 磁性氧化铁色态 黑色粉末 红棕色粉末 黑色晶体铁元素价态 +2 +3 +2、+3
说明:①Fe3O4与盐酸反应的离子方程式:

②FeO与硝酸反应的化学方程式:
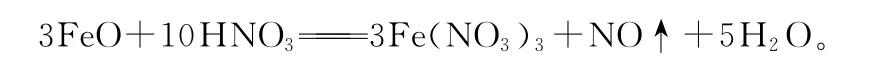
2.铁的氢氧化物

Fe(OH)2 Fe(OH)3色态 白色固体 红褐色固体与H+反应 Fe(OH)2+2H+Fe2++2H2O Fe(OH)3+3H+Fe3++3H2O二者关系在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应方程式为4Fe(OH)2+O2+2H2O 4Fe(OH)3
说明:Fe(OH)2、Fe(OH)3的制备可利用相应亚铁盐、铁盐与碱液反应。
3.亚铁盐与铁盐
(1)亚铁盐:含有Fe2+的溶液呈浅绿色,Fe2+既有氧化性,又有还原性,Fe2+与Zn、Cl2反应的离子方程式分别为。
(2)铁盐:①氧化性,含有Fe3+的溶液呈棕黄色,Fe3+具有氧化性,Fe3+与Fe、Cu反应的离子方程式分别为2Fe3++。
②特性:含有Fe3+的盐溶液遇到KSCN溶液时变成红色。
【秘籍归纳】

②铁的3种氧化物,2种氢氧化物,2种离子的颜色:FeO与Fe3O4均为黑色,Fe2O3为红棕色;Fe(OH)2为白色,Fe(OH)3为红褐色;Fe2+为浅绿色,Fe3+为棕黄色。
③铁的3种价态转化
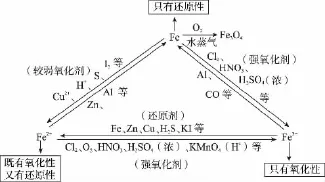
④2个特殊现象:Fe(OH)2→Fe(OH)3是白色→灰绿色→红褐色;Fe3+遇SCN-,溶液变红色。
【灵活运用】
(1)除杂上的运用

主要物质 杂质 除杂方法Fe2+ Fe3+加过量铁屑后过滤FeCl3 FeCl2 加氯水或H2O2Fe2+ Cu2+加过量铁屑后过滤Fe Al 加过量强碱溶液后过滤Fe2O3 Al2O3、SiO2加过量强碱溶液后过滤
(2)判断离子共存
Fe2+不能共存于(H+)、ClO-、(H+)。Fe3+不能共存于S2-、I-、。Fe2+、Fe3+不能共存于、等水解相互促进的离子。
(3)盐溶液的配制与保存
含Fe2+的盐溶液的配制:加入少量铁粉,防止Fe2+被氧化,同时加入少量的对应的酸,防止Fe2+发生水解;含Fe3+的盐溶液的配制:加入少量对应的酸,防止Fe3+离子发生水解。
(4)Fe2+、Fe3+的检验方法

鉴别方法 Fe2+ Fe3+直接观色 浅绿色 棕黄色利用显色反应 与KSCN 溶液 无现象 显红色利用Fe3+的氧化性蓝绿色与KI-与铜片 无现象 Cu溶解,溶液变为淀粉溶液 无现象 溶液变蓝利用Fe2+的还原性与溴水 溴水褪色 无现象与酸性KMnO4溶液紫色褪去 无现象利用加碱生成沉淀反应Fe2++2OH-Fe(OH)2↓白色→灰绿色→红褐色Fe3++3OH-Fe(OH)3↓红褐色沉淀
【特别提示】
(1)检验Fe2+时不能先加氯水后加KSCN溶液;当溶液的浓度较稀时,利用观察法或加NaOH溶液的方法都不宜检验Fe2+和Fe3+的存在。
(2)检验Fe2+和Fe3+混合溶液时,要分两次分别检验Fe2+和Fe3+,检验Fe2+时要选择酸性高锰酸钾溶液,检验Fe3+时最好选择KSCN溶液。
【精要总结】
(1)Fe2+具有较强的还原性,Fe3+水解能力强,实际上pH>4时,Fe3+几乎完全生成Fe(OH)3沉淀。
(2)欲除去某溶液中含有的Fe2+杂质时,先向溶液中加入氧化剂(如H2O2),使Fe2+被氧化为Fe3+,然后加入溶于酸的难溶物调节pH,使Fe3+转化为Fe(OH)3沉淀除去。
【典例剖析】
【例1】用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
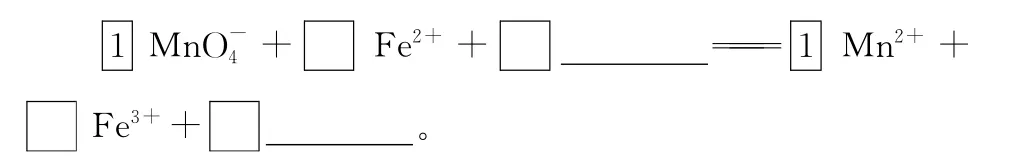
(2)已知:生成氢氧化物沉淀的pH数值如下表。

注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:_________________。
【答案】(1)5 8H+5 4H2O (2)pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
【例2】工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:

用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在________(填离子符号),检验溶液中还存在Fe2+的方法是__________(注明试剂、现象)。
【答案】Fe3+取少量溶液,滴加KMnO4溶液,KMnO4褪色
【解析】溶液中滴加KSCN溶液呈红色,说明含有Fe3+。可利用Fe2+的还原性来检验溶液中其是否存在,加入酸性KMnO4溶液,KMnO4溶液褪色,说明还存在Fe2+。
综上所述,铁元素及它的化合物在元素化合物知识中是非常重要,相信大家通过阅读体会到知识的深度和纵向结合,只要用心坚持学习,定能找出规律,找到最佳的方法。
(作者单位:湖南省湘乡市湖铁实验学校)

