血管分叉角度对冠状动脉分叉病变介入治疗中分支血管闭塞的影响
刘倩倩,张冬,杨浩瀚,徐晗,尹栋,窦克非
血管分叉角度对冠状动脉分叉病变介入治疗中分支血管闭塞的影响
刘倩倩,张冬*,杨浩瀚,徐晗,尹栋,窦克非
摘要
关键词冠状动脉疾病;血管成形术,经腔,经皮冠状动脉;冠状动脉分叉病变
作者单位:100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 心内科
Impact of Bifurcation Angle on Side Branch Occlusion During Coronary Bifurcation Intervention in Relevant Patients
LIU Qian-qian, ZHANG Dong, YANG Hao-han, XU Han, YIN Dong, DOU Ke-fei.
Department of Cardiology, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Corresponding Author: YIN Dong, Email: pumcyd@163.com
Abstract
Objective: To investigate the impact of bifurcation angle (BA) on side branch occlusion (SBO) during percutaneous coronary intervention (PCI) in relevant patients.
Methods: A total of 1171 consecutive patients with 1200 bifurcation lesions who received one stent technique were studied.Based on the median BA of 52°, the patients were divided into 2 groups: Low angle group, n=587 patients with 600 bifurcation lesions and High angle group, n=584 patients with 600 bifurcation lesions.SBO was defined by either side branch blood flow disappeared or TIMI grade decreased after PCI.The occurrence rate of SBO was investigated and the impact of BA on SBO during PCI was evaluated by multivariate Logistic regression analysis.
Results: SBO occurred in 88/1200 (7.33%) bifurcation lesions.The occurrence rate of SBO in High angle group was igher than Low angle group (10.5% vs 4.2%, P<0.001).Multivariable Logistic regression analysis showed that high angle was the independent predictor of SBO occurrence (OR=1.026, 95% CI 1.014-1.037, P<0.01).
Conclusion: High BA was an independent predictor of SBO after the main vessel stent implantation, which should not be ignored in clinical practice.
Key words Coronary artery disease; Angioplasty, transluminal percutaneous; Coronary bifurcation lesion
(Chinese Circulation Journal, 2016, 31:108.)
血管分叉病变是经皮冠状动脉介入治疗(PCI)中最具挑战的病变之一,大约占总介入治疗的15%~16%[1]。既往研究报道,分叉病变的解剖结构(例如分叉角度)及PCI的手术过程等多种因素均可影响分支血管闭塞及分叉病变PCI术的治疗效果[2,3]。血管分叉角度在分叉病变介入中的重要性已经被认识到,PCI围手术期及长期预后均受到分叉角度的影响[4,5]。但是,血管分叉角度对分支血管闭塞的确切影响目前仍没有详细阐明,既往研究的结果也存在争议[6-8]。本研究旨在探索PCI术治疗血管分叉病变时,血管分叉角度对分支血管闭塞率的影响。
1 资料与方法
研究对象:本研究中涉及的冠状动脉分叉病变遵循欧洲分叉病变俱乐部的定义:冠状动脉狭窄邻近或累及重要分支血管开口部。重要分支血管是指基于对患者的综合判断(与症状有关、缺血部位、存活心肌、提供侧支循环以及对左心功能意义重大等)、在介入治疗过程中不可以丢失的分支[9]。
入选标准为:(1)冠状动脉分叉病变接受PCI术的患者;(2)分叉病变累及重要的分支血管(由介入专家及核心实验室决定)。接受选择性分支支架置入的患者除外。我们筛选了从2012-01至2012-07在我院接受PCI的连续5 288例患者(6 808处病变),1 171例患者满足所有入选标准,共1 200处分叉病变入选本研究。
手术及围手术期处理:所有分叉病变的介入策略及器械的选择均由术者决定。围手术期抗血小板及抗凝药物的使用遵循术者的判断及最新指南的要求。必须在术前24 h内完成氯吡格雷300 mg及阿司匹林300 mg的负荷剂量。术后所有患者至少服用12个月氯吡格雷(75 mg/d)并长期服用阿司匹林(100 mg/d)。
定义及数据采集:血管分叉角度是指主支血管远段和分支血管中心线的角度。PCI术成功是指支架置入后残余狭窄<20%,同时主支血管和分支血管心肌梗死溶栓治疗临床试验(TIMI)血流3 级。分支血管闭塞是指在主支血管支架置入后分支血流消失或TIMI血流分级下降(<3级)。
通过病例查阅获得临床数据。所有基线和冠状动脉造影的手术过程均由阜外医院核心实验室评估和分析。详细记录冠状动脉造影结果,包括分叉位置、Medina分型、基线TIMI血流分级、主支血管支架置入后主支及分支的TIMI血流分级。
冠状动脉造影定量(QCA)分析:QCA分析的完成遵循标准的定量分析和定义,由阜外医院独立的实验室应用Qangio XA软件( version 7.3、Medis、Leiden、Netherlands)完成分析。根据既往研究[10],所有QCA分析都是采用T型分段分析的模式完成的。我们获得分叉病变的四段定量冠状动脉造影测量数据(图1),包括主支近段、主支远段、分支段及分叉核心段。分叉核心是分叉部位的中心部分,起始于一支血管开始分成两个分支的部位,结束于隆突点(Carinal点)。在血管投影缩减最小的冠状动脉造影切面测量分叉角度。
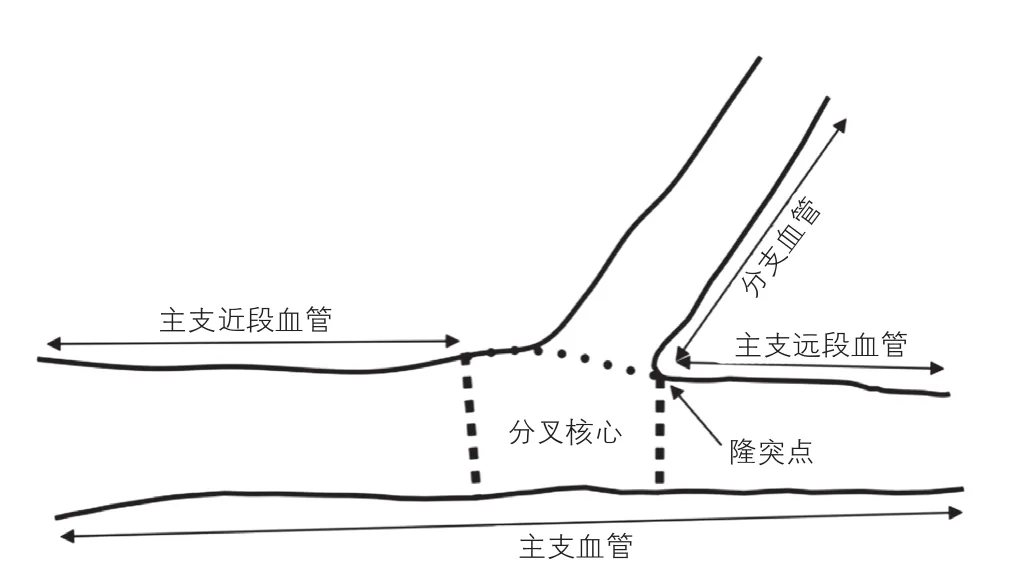
图1 冠状动脉造影定量分析原理图
统计学分析:连续数据用均值±标准差表示,采用t检验进行比较。分类变量用计数及百分数表示,采用卡方检验或Fisher精确检验进行比较。采用多因素Logistic回归分析识别分支闭塞的独立预测因子。危险性调整差异的估计值以差异的95%可信区间(CI)表示。所有统计检验均为双侧,且P<0.05为差异有统计学意义。所有数据应用SAS 9.3 (SAS Institute,Cary,NC,USA)系统进行分析。
2 结果
血管分叉角度的描述及患者分组:本研究采用血管分叉角度的中位数作为高低角度的分界节点,在本研究的全部队列中(n=1 200),分叉角度的中位数为52°。分叉角度的四分间距为29°(40°~69°)。参照早期研究[6, 11],根据分叉角度的中位数将这些病灶分为低角度组和高角度组,其中600处病灶(587例患者)属于低角度组(≤52°),600处病灶(584例患者)属于高角度组(>52°)。在低角度组中,分叉角度的中位数及四分间距分别为40°和12° (34°~46°),在高角度组中,分叉角度的中位数及四分间距分别为69°和20°(60°~80°)。
两组患者临床、病变及手术特征:患者的临床特征见表1。所有基线特征在两组间无明显差异。病变的一般特征见表2,分叉病变的位置在两组间差异具有统计学意义。手术过程相关内容(表3),低角度组分支血管的预扩张比例明显高于高角度组(17.7% vs13.2%,P=0.03);为预防分支血管闭塞,低角度组中分支保留导丝技术的使用率明显高于高角度组(31.7% vs 22.2%,P<0.001)。QCA分析的数据(表4),两组之间在主支血管近段及分支血管病变长度、主支血管远段及分叉核心处管腔直径狭窄率、主支血管支架置入前分支管腔直径狭窄率比较差异均有统计学意义(P均<0.05)。
主支血管支架置入后分支血管闭塞情况:在采用单支架技术方案的1 200处分叉病变中,有88处(7.33%)出现分支血管闭塞。其中,65处(73.9%)血流无恢复,23处(26.1%)出现TIMI血流分级下降。高角度组的分支血管闭塞的发生率(63/600,10.5%)明显高于低角度组(25/600,4.2%)(P<0.001)。分支血管闭塞发生率随着分叉角度的增大明显升高:从分叉角度第一四分位内的3.63%,第二四分位内的4.71%,第三四分位内的8.14%到第四四分位内的12.97%(P<0.001)。
分支血管闭塞的预测因子:在单因素分析中有统计学意义(P<0.05)的协变量或重要的协变量(P<0.25)被纳入多因素回归模型中。总计25个协变量纳入多因素模型中,包括急性心肌梗死、临床症状、支架置入前主支血管TIMI血流分级、分叉病变的位置、术前主支血管近段管腔直径狭窄率,术前分叉核心处管腔直径狭窄率、术前主支血管远段管腔直径狭窄率、主支及分支病灶长度、主支血管/分支血管直径、分支预扩张、在主支血管支架置入前分支血管的管腔直径狭窄率、分支保留导丝技术的使用。
多因素分析结果表明,血管分叉角度大是分支血管闭塞的独立预测因素(比值比=1.026,95%CI:1.014~1.037,P<0.001)。分叉角度的比值比为1.026,即分叉角度每增加1°,分支血管闭塞风险上升1.026倍,因此随着血管分叉角度的增加,分支血管闭塞的风险及发病率会大大增加。
将主支血管支架置入术后分支血管闭塞作为一个状态变量,分叉角度作为一个检验变量,得出受试者工作特征(ROC,图2)曲线。ROC曲线下面积为0.655(95% CI: 0.594~0.716,P<0.001),预测分支血管闭塞的界值为51.5°,敏感性和特异性分别为73.9%和49.5%。

表1 两组患者临床特征[例(%)]

表2 两组患者病变的一般特征[处(%)]

表3 两组患者手术情况[处(%)]
表4 两组患者冠状动脉造影定量分析(±s)

表4 两组患者冠状动脉造影定量分析(±s)
项目 低角度组(n=600处)高角度组(n=600处) P值主支血管近段参考直径 (mm) 3.0±0.5 3.0±0.5 0.22直径狭窄率 (%) 55.1±28.1 56.3±26.9 0.46病灶长度 (mm) 13.8±8.1 12.7±7.4 0.01主支血管远段参考直径 (mm) 2.6±0.5 2.6±0.5 0.48直径狭窄率 (%) 49.8±25.9 54.6±25.4 0.001病灶长度 (mm) 9.1±6.8 9.7±7.1 0.12分支血管参考直径 (mm) 1.9±0.4 2.0±0.4 0.16直径狭窄率 (%) 30.6±20.2 32.5±20.5 0.11病灶长度 (mm) 3.7±2.6 3.3±2.5 0.002分叉核心参考直径 (mm) 2.9±0.5 2.9±0.5 0.47直径狭窄率 (%) 30.2±26.7 38.3±29.3 <0.001病灶长度 (mm) 3.0±1.8 3.1±1.6 0.21主支血管/分支血管直径 1.5±0.3 1.5±0.3 0.09主支血管最大直径狭窄率 (%) 72.6±17.3 74.2±16.0 0.09主支血管病灶总长度 (mm) 25.9±9.9 25.5±10.2 0.47主支血管支架置入前分支血管直径狭窄率 (%) 31.2±18.8 33.7±20.6 0.03主支血管支架置入前主支血管直径狭窄率 (%) 52.2±15.0 52.7±15.6 0.55

图2 血管分叉角度的受试者工作特征曲线图
3 讨论
血管分叉角度被认为是影响分叉病变介入治疗的重要因素之一[4, 5]。但分叉角度对单支架策略治疗分叉病变后分支血管闭塞的影响尚无定论。在本研究中,我们通过一组连续的冠状动脉分叉病变患者,探讨了分叉角度对分支血管闭塞风险的影响。这项研究的主要发现是:高分叉角度与分支血管闭塞明显相关。
血管分叉角度对分支血管闭塞的影响目前尚无定论。基于早期小样本量的研究,较小的分叉角度被认为更容易发生主支支架置入后的界嵴移位,导致分支丢失[7]。但是,一项通过血管内超声评估44处分叉病变的研究表明,分叉角度与分支丢失并没有明显关联[12]。斑块及界嵴移位均被认为是主支支架置入术后导致分支丢失的潜在机制[13]。但是分叉角度可以通过多种因素共同对分支造成影响,除斑块及界嵴移位外,还包括分叉处的解剖结构、几何特征以及血流动力学。为了阐明在主支支架置入术后分叉角度对分支血管闭塞的确切影响,需要进行大样本的连续性研究。本研究分析了1 171例患者的1 200处分叉病灶,发现当分叉角度逐渐增加时,分支血管闭塞的风险也随之增加。
其机制包括:(1)过大的分叉角度会增加血流压力损失及增加血流阻力,因此增加分支血管闭塞的风险。(2)对于相同直径的分支来说,分叉角度大有更小的开口面积和长度。分支开口的面积和长度是影响分叉病变PCI中分支丢失的重要因素[14]。对分叉角度与开口面积相关性的研究表明,随着分叉角度的增大,开口面积逐渐变小[15]。根据既往研究,分支的开口长度可以通过下列方法计算:分支直径/sin(主支远段与分支的角度),这与血管内超声直接测量的分叉病变分支开口长度具有良好的相关性[16]。通过三角函数计算,对具有相同直径的分支,开口长度随着分叉角度变大而缩短,因而减少了分支开口的面积。分支开口部的管腔面积可以用来预测分支丢失,并具有很高的敏感性[14];因此,分叉角度大与分支开口相对较小的管腔面积相关,是导致分支血管闭塞的因素之一。(3)分叉角度是分叉处早期动脉粥样硬化的独立危险因素[17]。增大分叉角度会降低血管壁的剪切力,明显增加基底处的震荡剪切力指数[18],最终可能会导致分叉区域斑块的增殖[19, 20]。分叉核心处斑块的体积越大,越增加分支闭塞的风险。本研究发现高角度组分叉处的病灶比低角度组分叉处病灶的直径狭窄程度更严重[(38.3±29.3)% vs (30.2±26.7)%,P<0.001]。高角度组分叉核心处更重的斑块负荷是增加分支血管闭塞发生率的原因之一。
本研究中,分支保留导丝及分支预扩张都是影响分支血管闭塞的潜在影响因素。两者均被纳入了多因素分析模型,但是它们并没有成为预测分支血管闭塞的独立影响因素,这与既往研究结果一致[8],即操作技术不能作为分支血管闭塞的独立预测因素。尽管分支保留导丝及其它手术因素可能会影响分支血管闭塞及血流,但本研究均没有将其作为分支血管闭塞的独立预测因素。更多的前瞻性临床研究可以进一步阐明该问题。
研究局限性:首先,本研究是一项回顾性、单中心的研究,很多未知的混合因素不能被排除。其次,治疗策略、支架类型和其他器械的选择均遵照术者的判断要求,因此可能存在选择性偏差。第三,本研究中,低角度组的分支平均血管参考直径为(1.9±0.4 )mm,高角度组为(2.0±0.4) mm (P=0.16),因此可能与纳入较大分支的研究结果不同。这也一定程度上解释了本研究中血管分叉角度在分支血管闭塞中的不同影响。最后,所有分叉角度均是从二维的QCA分析中获得的,而分叉病变的三维重建及定量分析将更加准确精密的测量分叉角度。
结论:血管分叉角度大是主支血管支架置入后分支血管闭塞的独立预测因素。分叉角度大的分支血管闭塞风险不能被忽视。该结论仍需要在其他患者人群中进一步验证。
参考文献
[1] 盖鲁粤.冠状动脉分叉病变介入治疗——没有解决的技术问题.中国循环杂志, 2004, 19: 313-315.
[2] Hayashi S, Tohyama S, Shindo T, et al.Risk of side branch occlusion after coronary Palmaz-Schatz stenting.J Cardiol, 1997, 29: 261-266.
[3] Kralev S, Poerner TC, Basorth D, et al.Side branch occlusion after coronary stent implantation in patients presenting with ST-elevation myocardial infarction: clinical impact and angiographic predictors.Am Heart J, 2006, 151 : 153-157.
[4] Vassilev D, Alexandrov A, Le D, et al.Importance of bifurcation angle in bifurcation stenting.Chin Med J (Engl), 2012, 125: 4122-4125.
[5] Freixa X, Almasood AA, Asif N, et al.Long-term outcomes using a two-stent technique for the treatment of coronary bifurcations.Int J Cardiol, 2013, 168: 446-451.
[6] Yang JH, Song YB, Song PS, et al.Impact of coronary bifurcation angle on clinical outcomes after percutaneous coronary intervention in realworld practice: results from the COBIS registry.Cardiology, 2012, 122: 216-224.
[7] Vassilev D, Gil R.Clinical verification of a theory for predicting side branch stenosis after main vessel stenting in coronary bifurcation lesions.J Interv Cardiol, 2008, 21: 493-503.
[8] Hahn JY, Chun WJ, Kim JH, et al.Predictors and outcomes of side branch occlusion after main vessel stenting in coronary bifurcation lesions: results from the COBIS II Registry (COronary BIfurcation Stenting).J Am Coll Cardiol, 2013, 62: 1654-1659.
[9] Louvard Y, Medina A, Stankovic G.Definition and classification of bifurcation lesions and treatments.EuroIntervention, 2010, 6 (Suppl J): J31-35.
[10] Holm NR, Hojdahl H, Lassen JF, et al.Quantitative coronary analysis in the Nordic Bifurcation studies.Int J Cardiovasc Imaging, 2011, 27: 175-180.
[11] Adriaenssens T, Byrne RA, Dibra A, et al.Culotte stenting technique in coronary bifurcation disease: angiographic follow-up using dedicated quantitative coronary angiographic analysis and 12-month clinical outcomes.Eur Heart J, 2008, 29: 2868-2876.
[12] Xu J, Hahn JY, Song YB, et al.Carina shift versus plaque shift for aggravation of side branch ostial stenosis in bifurcation lesions: volumetric intravascular ultrasound analysis of both branches.Circ Cardiovasc Interv, 2012, 5: 657-662.
[13] Koo BK, Waseda K, Kang HJ, et al.Anatomic and functional evaluation of bifurcation lesions undergoing percutaneous coronary intervention.Circ Cardiovasc Interv, 2010, 3: 113-119.
[14] Kang SJ, Mintz GS, Kim WJ, et al.Preintervention angiographic and intravascular ultrasound predictors for side branch compromise after a single-stent crossover technique.Am J Cardiol, 2011, 107: 1787-1793.
[15] Louvard Y, Lefevre T, Morice MC.Percutaneous coronary intervention for bifurcation coronary disease.Heart, 2004, 90: 713-722.
[16] Ryu HM, Kim BK, Kim JS, et al.Comparison between measured and calculated length of side branch ostium in coronary bifurcation lesions with intravascular ultrasound.Yonsei Med J, 2012, 53: 680-684.
[17] Sitzer M, Puac D, Buehler A, et al.Internal carotid artery angle of origin: a novel risk factor for early carotid atherosclerosis.Stroke, 2003, 34: 950-955.
[18] Huo Y, Finet G, Lefevre T, et al.Optimal diameter of diseased bifurcation segment: a practical rule for percutaneous coronary intervention.EuroIntervention, 2012, 7: 1310-1316.
[19] 惠波, 于忠祥, 许文亮, 等.心绞痛患者冠状动脉分叉处病变特点分析.中国循环杂志, 2013, 28: 599-601.
[20] Rodriguez-Granillo GA, Garcia-Garcia HM, Wentzel J, et al.Plaque composition and its relationship with acknowledged shear stress patterns in coronary arteries.J Am Coll Cardiol, 2006, 47: 884-885.
(编辑:漆利萍)
(收稿日期:2015-06-30)
中图分类号:R54
文献标识码:A
文章编号:1000-3614(2016)02-0108-05
doi:10.3969/j.issn.1000-3614.2016.02.002
作者简介:刘倩倩 住院医师 硕士 主要从事心血管病临床研究 Email:missylucky@163.com*本文共同第一作者 通讯作者:尹栋Email:pumcyd@163.com
基金项目:首都临床特色应用研究基金(编号:Z141107002514096);北京协和医学院“协和青年基金”(编号:33320140039)
目的:探讨在冠状动脉分叉病变经皮冠状动脉介入治疗(PCI) 中,血管分叉角度对分支血管闭塞的影响。
方法:连续入选1 171例接受分叉病变行PCI的患者(1 200处分叉病变)。所有分叉角度的中位数为52°,以此为界分为低角度组(587例,600处分叉病变)和高角度组(584例,600处分叉病变)两组。分支血管闭塞是指PCI术后分支血流消失或心肌梗死溶栓治疗临床试验(TIMI)血流分级下降。分析两组患者分支血管的闭塞率,并通过多因素Logistic回归分析评价血管分叉角度对分支血管闭塞在介入治疗后的影响。
结果:入选的1 200处分叉病变中,在PCI后共有88例病变出现分支血管闭塞(发生率为7.33%)。分支血管闭塞在高角度组的发生率明显高于低角度组(10.5% vs 4.2%,P<0.001)。多因素Logistic回归分析结果显示血管分叉角度大是分支血管闭塞的独立预测因素(比值比=1.026,95%可信区间:1.014~1.037,P<0.01)。
结论:血管分叉角度大是主支血管支架置入后分支血管闭塞的独立预测因素。分叉角度大的分支血管闭塞风险不能被忽视。

