阿魏酸酯酶O42807在毕赤酵母GS115中的表达
陈云华, 李慧, 张光亚, 葛慧华, 李夏兰
(华侨大学 化工学院, 福建 厦门 361021)
阿魏酸酯酶O42807在毕赤酵母GS115中的表达
陈云华, 李慧, 张光亚, 葛慧华, 李夏兰
(华侨大学 化工学院, 福建 厦门 361021)
摘要:研究阿魏酸酯酶O42807基因(fae)在巴斯德毕赤酵母GS115中的表达及重组阿魏酸酯酶的酶学特性.化学合成fae基因序列,构建分泌型重组质粒pPIC9K-fae,经线性化后电转化至毕赤酵母GS115,对筛选出的高活性转化子进行诱导表达.SDS-PAGE分析显示:发酵上清液为单一条带,表观相对分子质量为42 ku,酶活为78.49 nkat·mL-1,比活力为524.38 nkat·mg-1,最适反应温度为50 ℃,在40~45 ℃温度范围内较稳定,最适反应pH值为5.0~5.5,且在pH值为6.0时,稳定性较好;金属离子K+,Ca2+,Na+对其活性有促进作用,Fe2+,Zn2+有一定的抑制作用,而Mn2+,Cu2+对其有明显的抑制作用.
关键词:阿魏酸酯酶; 表达; 毕赤酵母; 酶学性质
植物细胞壁中,酚酸类物质(如阿魏酸、咖啡酸、对香豆酸等)通过酯键与多糖(如阿拉伯木聚糖、果糖)的阿拉伯糖基或半乳糖基相连,或者通过醚键与木质素相连,形成致密的网状结构[1].阿魏酸酯酶(feruloyl esterase,FAE,EC 3.1.1.73) 又名肉桂酸酯酶,能水解阿魏酸酯、低聚糖阿魏酸酯和多糖阿魏酸酯中的酯键,释放出阿魏酸等功能性物质.FAE可以协同木聚糖酶、木质素酶破坏木质纤维的致密网状结构,使细胞壁结构变得疏松,从而促进木质纤维素完全降解[1-2].FAE对木质纤维废弃物利用有着重要意义[3].至今,已经从细菌和真菌中分离得到40多种FAE,但目前报道的FAE的酶活及表达量都达不到工业需要[4-6].毕赤酵母(Pichiapastoris)可高密度地发酵培养,其菌体量可达130 g·L-1干细胞重,在生产单细胞蛋白动物饲料方面发挥重要作用[7-8].毕赤酵母表达系统比大肠杆菌(Escherichiacoli)体系有更完备的基因表达调控机制及对表达产物的加工修饰能力,并具有原核细胞系统生长速度快、便于基因操作和可工业化大规模培养等优点[9].本文对阿魏酸酯酶O42807基因(fae)在巴斯德毕赤酵母GS115中的表达及重组阿魏酸酯酶的酶学特性进行研究.
1材料和方法
1.1主要材料
1.1.1菌株和质粒E.coliDH5α为本实验室保存;毕赤酵母GS115,载体pAO815,pPIC9K均购自美国Invitrogen公司.
1.1.2主要试剂和培养基 限制性内切酶(EcoRⅠ,HindⅢ,SnaBⅠ,NotⅠ,BglⅡ),T4 DNA连接酶(立陶宛Fermenstas公司);质粒抽提试剂盒、胶回收试剂盒(上海Sangon公司);标准蛋白质marker(14.4~116.0 ku),SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术研究所);阿魏酸甲酯(美国Sigma公司);其他试剂均为国产或进口分析纯产品.MD培养基、YPD种子培养基、BMGY种子培养基、BMMY诱导培养基按《毕赤酵母操作表达手册》(美国Invitrogen公司)配制.
1.2pAO815-fae表达载体的构建
根据阿魏酸酯酶O42807的氨基酸序列,以毕赤酵母标准密码子优化设计阿魏酸酯酶的基因序列,在基因序列的两端引入HindⅢ和EcoRⅠ酶切位点,化学合成基因序列fae.用HindⅢ,EcoRⅠ分别双酶切合成的基因序列和质粒pAO815,胶回收双酶切片段后用T4 DNA连接酶连接并转化至E.coliDH5α感受态细胞.筛选出的阳性克隆子由Sangon测序,测序正确的重组质粒命名为pAO815-fae.
1.3pPIC9K-fae表达载体的构建
以质粒pAO815-fae为模板,采用上游引物5′- TACGTAGCCTCTACTCAGGGGATCAGT- 3′ 和下游引物5′-AATATGCGGCCGCTTACCAAGTACAAGCCCCG- 3′ 扩增成熟阿魏酸酯酶编码序列.聚合酶链反应(PCR)反应条件如下:94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,反应30个循环,最后,72 ℃延伸10 min.PCR产物经胶回收用SnaBⅠ和NotⅠ进行双酶切,然后,连接到经同样双酶切的pPIC9K上并转化至E.coliDH5α.筛选出的阳性克隆子由Sangon测序,测序正确的重组质粒命名为pPIC9K-fae.
1.4fae在毕赤酵母中的表达
pPIC9K-fae用BglⅡ线性化,电转化毕赤酵母GS115,涂布于MD平板上筛选重组子,取MD平板上生长良好的菌落用牙签点种至含G418的YPD摇瓶中,筛选抗G418的重组子,命名为GS115/pPIC9K-fae.提取GS115/pPIC9K-fae及以质粒pPIC9K转化菌株(GS115/pPIC9K)基因组DNA,利用通用引物5′AOX,3′AOX进行PCR鉴定.重组酵母GS115/pPIC9K-fae诱导表达参见《毕赤酵母操作表达手册》.用Bradford法测定蛋白质量浓度,SDS-PAGE分析发酵上清液.
1.5重组阿魏酸酯酶酶活测定
取250 μL酶液, 加入250 μL的柠檬酸-磷酸氢二钠缓冲溶液(pH=5.0)配制的阿魏酸甲酯溶液,50 ℃反应10 min,加入500 μL 冰乙酸(体积分数为10%),4 ℃,10 000 r·min-1离心20 min,高效液相色谱法(HPLC)测定阿魏酸的质量浓度[10].空白对照为煮沸失活的酶液.在50 ℃,pH值为5.0条件下,每分钟水解阿魏酸甲酯.
1.6重组阿魏酸酯酶粗酶酶学性质的研究
1.6.1最适反应温度的测定取250 μL酶液保温5 min后,加入250 μL 阿魏酸甲酯溶液(由pH值为5.0的柠檬酸-磷酸氢二钠缓冲溶液配置),在40~65 ℃中反应10 min,测定重组阿魏酸酯酶的酶活.以所测的最高酶活为100%,计算相对酶活(Ar).
“两票制”执行后,药品批发企业需直接从生产企业进货,生产企业为避免资金风险,一般对资金承付要求较为严格,承付期限比以往代理商分销时要短,且不少生产企业要求现款或预付款发货。而药品销售到下游医疗机构后,一般有3至6个月的滞账期,部分情况下甚至更长。在上游垫资负担增大和下游回款延长的双重作用下,药品批发企业的资金压力进一步加大,大部分企业现金流非常紧张,特别是中小企业,抗风险能力较弱,如果下游回款出现问题,很容易造成资金链断裂,严重时可能导致企业的破产。
1.6.2温度稳定性的测定将FAE酶液置于40~65 ℃下,保温12 h,每隔3 h取样测定残留酶活,以0 h酶活为100%,计算相对酶活.
1.6.3最适反应pH值的测定取250 μL酶液50 ℃保温5 min后,加入250 μL的阿魏酸甲酯溶液(0.2 mol·L-1的柠檬酸-磷酸氢二钠缓冲溶液调节pH值在4.0~7.0之间),50 ℃下反应10 min,测定重组阿魏酸酯酶的酶活.以所测的最高酶活为100%,计算相对酶活.
1.6.4pH值稳定性的测定将酶液置于0.2 mol·L-1,pH值为4.0~7.0的柠檬酸-磷酸氢二钠缓冲液中,50 ℃保温2 h,测定残留酶活,以各pH值的0 h酶活为100%,计算相对酶活.
1.6.5金属离子对重组阿魏酸酯酶酶活的影响将FAE酶液与含有10 mmol·L-1的各种金属离子(Na+,K+,Mn2+,Fe2+,Cu2+,Mg2+,Ca2+,Zn2+) 的柠檬酸-磷酸氢二钠缓冲溶液(pH=5.0)混合,于50 ℃保温2 h,测定残留酶活,以不添加抑制剂的酶活为100%,计算相对酶活.
2结果与分析
2.1pAO815-fae和pPIC9K-fae表达载体的构建
构建的表达载体,如图1所示.由图1可知:测序结果显示fae基因序列正确,重组表达载体pAO815-fae构建成功.以质粒pAO815-fae为模板,PCR产物在约800 bp处出现一条特异性条带,其大小与预期的相符.将目的产物用SnaBⅠ和NotⅠ双酶切切胶回收后,与经同样双酶切后回收的质粒pPIC9K连接,转化E.coliDH5α 筛选获得重组质粒.表达载体pPIC9K-fae双酶切结果和示意图,如图2所示.图2(a)中:泳道1为重组质粒双酶切片段;泳道2为DNA mark.由图2(a)可知:酶切条带相对分子质量与载体基因大小吻合,两条条带分别为9.3 kbp和800 bp.

(a) 双酶切结果 (b) 示意图 图1 表达载体pAO815-fae示意图 图2 表达载体pPIC9K-fae双酶切结果及示意图 Fig.1 Schematic representation of Fig.2 Cleavage map and schematic representation the expression vector pAO815-fae of the expression vector pPIC9K-fae
2.2fae在毕赤酵母中的表达
挑取上述阳性转化子,按照节1.3进行培养和诱导表达.甲醇诱导每隔12 h或24 h取样,测定其表达量,筛选到一个产酶活性最高的GS115/pPIC9K-fae重组子.取其发酵上清液进行SDS-PAGE分析,如图4所示.图4中:1为GS115/pPIC9K发酵上清液;2为蛋白marker;3~10为GS115/pPIC9K-fae诱导培养 0,12,24,48,72,96,120,144 h的发酵上清液.由图4可知:在42 ku得到一条清晰条带,而且几乎没有杂条带,初步说明fae得到成功表达.SDS-PAGE结果显示的表观相对分子质量(Mr)明显大于其理论值28.48 ku,这主要有以下2个原因:1) FAE的理论等电点(pI)为3.3,这可能降低了FAE与SDS的结合,以及在SDS-PAGE凝胶中的迁移;2) FAE蛋白序列的N端有一个糖基化位点,而毕赤酵母表达外源蛋白时,会对其进行糖基化修饰,从而使相对分子质量增大[9].

图3 GS115/pPIC9K-fae转化子PCR电泳图 图4 SDS-PAGE分析产物的表达 Fig.3 Cleavage map of the PCR analysis of Fig.4 Products expression analyzed GS115/pPIC9K-fae transformants by SDS-PAGE
GS115/pPIC9K-fae表达量的测定结果,如图5所示.图5中:培养液上清中阿魏酸酯酶酶活力(z)在诱导培养96 h后达最高,为78.49 nkat·mL-1,比活(u)为524.38 nkat·mg-1,之后酶活逐渐降低.菌体浓度(D)在培养24 h后基本稳定,但发酵液中的蛋白量(ρp)一直持增长趋势,这可能是由于发酵后期由于营养物质缺乏,造成部分菌体自溶使蛋白量增加.
2.3重组阿魏酸酯酶粗酶的酶学性质
通过研究在40~65 ℃时酶活的变化,探究酶反应的最适温度(θ),如图6所示.由图6可知:50 ℃之前,重组阿魏酸酯酶的酶活较高,相对酶活(Ar)都在80%以上.FAE的最适作用温度为50 ℃,超过50 ℃后,FAE的酶活下降较快,可能是随着温度的升高,酶出现失活现象.

图5 GS115/pPIC9K-fae表达量的测定 图6 温度对重组阿魏酸酯酶活性的影响 Fig.5 Determination of the products expression Fig.6 Effect of temperature on the activity in GS115/pPIC9K-fae of recombinant FAE

图7 温度对重组阿魏酸酯酶稳定性的影响Fig.7 Effect of temperature on the stability of recombinant FAE
将重组阿魏酸酯酶在40~65 ℃保温 0,3,6,9,12 h后,测定其残余酶活,结果如图7所示.重组阿魏酸酯酶在40~65 ℃温度下,随着保温时间(t)的延长,FAE的酶活(Ar)逐渐下降.40~45 ℃保温12 h后,酶活为初始酶的50%左右;50 ℃以后,酶活下降较快,保温12 h后,剩余酶活不足10%.
2.3.1最适反应pH值和pH值稳定性的测定pH值为4.0~7.0时,酶的最适反应pH值,如图8所示.由图8可知:pH值为5.0~5.5,重组阿魏酸酯酶的酶活最大.pH值稳定性结果,如图9所示.由图9可知:pH值为4.0~6.0时,随着pH值的增大,重组酶的稳定性随之增大;pH值为6.0时,稳定性相对较高,为63%;pH值大于6.0时,酶活稳定性逐渐下降.重组酶对pH值比较敏感,这可能是因为pH值过低或过高会改变酶的空间结构[11].
2.3.2金属离子重组阿魏酸酯酶酶活性的影响无金属离子,K+,Ca2+,Na+,Mg2+,Fe2+,Mn2+,Zn2+,Cu2+的相对酶活分别为100%,106%,109%,101%,98%,66%,41%,60%,55%.由此可知:K+,Ca2+,Na+对FAE有促进作用;Fe2+,Zn2+对其有一定的抑制作用;Mn2+,Cu2+对其有显著抑制作用.
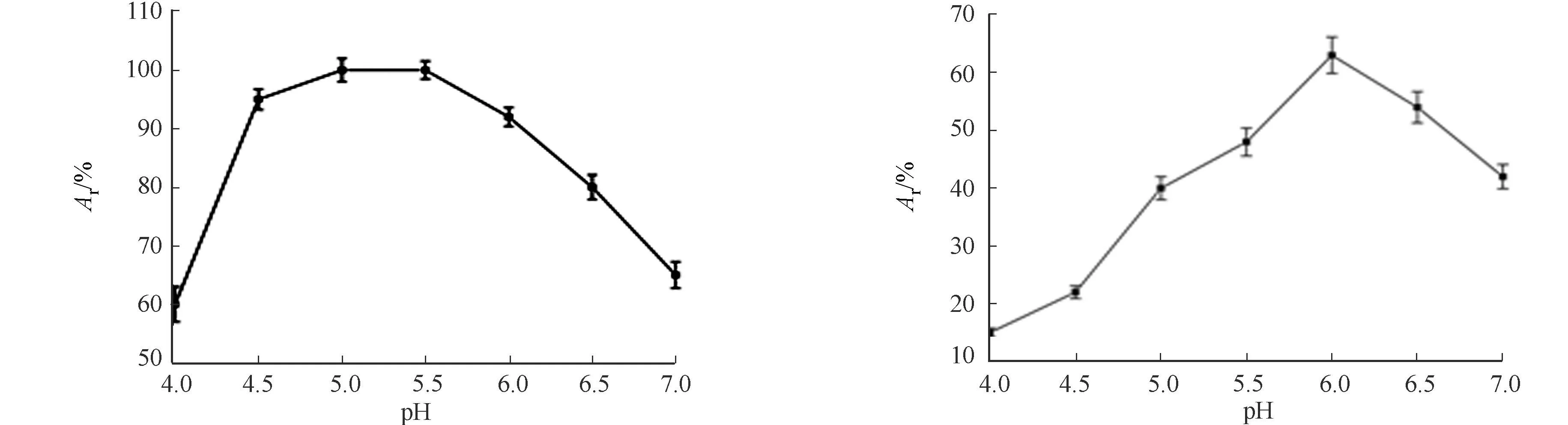
图8 pH对重组阿魏酸酯酶酶活性的影响 图9 pH对重组阿魏酸酯酶稳定性的影响 Fig.8 Effect of pH on the activity Fig.9 Effect of pH on the stability of recombinant FAE of recombinant FAE
3讨论
为了提高阿魏酸酯酶的表达量,已对多个阿魏酸酯酶编码基因进行了外源表达.国内外学者主要采用大肠杆菌、毕赤酵母表达系统对阿魏酸酯酶进行重组表达,如表1所示.文中研究的产FAE工程菌目标是应用于饲料中,所以选择已增补至《饲料添加剂品种目录(2013)》中的黑曲酶的FAE序列.FAE的氨基酸序列来源于UniProt数据库中的O42807.该FAE是DE Vries等[1]从黑曲霉(Aspergillusniger)CBS120.49中分离得到的,当A.nigerCBS120.49在含质量分数为0.1% 葡萄糖和1% 燕麦木聚糖的混合植物细胞壁中培养4 d后,酶比活(u)为20.875 nkat·mg-1(以阿魏酸甲酯为底物),其最适温度(θ)为55~60 ℃, 最适pH值为5.0, 属于胞外酶. 此FAE含有281个氨基酸(1~21位为信号肽序列,21位为信号肽序列,22~281为成熟肽链),其中,含有30个酸性氨基酸残基(Asp,Glu)和10个碱性氨基酸残基(Lys,Arg),含有7个Cys和1个糖基化位点,pI为3.3,理论相对分子质量为28.48 ku.

表1 阿魏酸酯酶基因工程菌的研究进展
根据毕赤酵母偏好性表达对FAE O42807的基因序列进行改造后,人工合成该酶的基因序列fae.这段序列与表达载体pPIC9K相连,FAE在α-factor信号肽的引导下分泌到胞外.由表1可知:酵母表达系统与大肠杆菌表达系统相比,其酶比活较高;该重组阿魏酸酯酶的酶比活可达524.38 nkat·mg-1,酶活力介于文献报道之间,比原始菌株酶活大大提高;重组阿魏酸酯酶最适温度在40~60 ℃,最适pH值在5.2~7.0之间,文中重组阿魏酸酯酶的最适温度为50 ℃,最适pH值为5.0.
先前尝试用胞内表达载体pAO815在毕赤酵母中表达,但不能检测到酶活.这可能是由于阿魏酸酯酶O42807是一种糖基化蛋白,胞内表达时未进行糖基化修饰,不能产生有活性的阿魏酸酯酶[9,16-17].
4结束语
文中报道的重组阿魏酸酯酶在40 ℃中保温3 h后,保留了80%以上的酶活;40~45 ℃保温12 h后,仍保留50% 左右的酶活.Fe2+,Zn2+对重组阿魏酸酯酶酶活有一定的抑制作用,而Mn2+,Cu2+对其有明显抑制作用.这与Donaghy等[18]报道的阿魏酸酯酶的酶学性质一致.构建的基因工程菌在胞外表达时,发酵液中背景蛋白较少,重组蛋白纯度较高.阿魏酸酯酶在毕赤酵母中的高效分泌表达为后续定向改进酶学特性奠定了基础.
参考文献:
[1]FAULDS C B,WILLIAMSON G.Purification and characterization of a ferulic acid esterase (FAE-Ⅲ) fromAspergillusniger: Specificity for the phenolic moiety and binding to microcrystalline cellulose[J].Microbiology,1994,140(4):779-787.
[2]FAULDS C B,MANDALARI G,BISIGNANO G.Arabinoxylan and mono-and dimeric ferulic acid release from brewer′s grain and wheat bran by feruloyl esterases and glycosyl hydrolases from Humicola insolens[J].Applied Microbiology and Biotechnology,2004,64(5):644-650.
[3]TOPAKAS E,VAFIADI C,CHRISTAKOPOULOS P.Microbial production, characterization and applications of feruloyl esterases[J].Process Biochemistry,2007,42(4):497-509.
[4]周燕燕,刘新利,陈静,等.黑曲霉h408阿魏酸酯酶基因的克隆及在毕赤酵母中的高效表达[J].微生物学报,2014(8):876-881.
[5]WONG D W,CHAN V J,LIAO H,et al.Cloning of a novel feruloyl esterase gene from rumen microbial metagenome and enzyme characterization in synergism with endoxylanases[J].Journal of Industrial Microbiology and Biotechnology,2013,40(3/4):287-295.
[6]KOSEKI T,HORI A,SEKI S,et al.Characterization of two distinct feruloyl esterases, AoFaeB and AoFaeC, fromAspergillusoryzae[J].Applied Microbiology and Biotechnology,2009,83(4):689-696.
[7]FELBER M,PICHLER H,RUTH C.Strains and molecular tools for recombinant protein production inPichiapastoris[M].New York:Springer,2014:87-111.
[8]WEGNER G H.Emerging applications of the methylotrophic yeasts.[J].FEMS Microbiology Letters,1990,7(3/4):279-283.
[9]JUGE N,WILLIAMSON G,PUIGSERVER A,et al.High-level production of recombinant Aspergillus niger cinnamoyl esterase (FAEA) in the methylotrophic yeastPichiapastoris[J].FEMS Yeast Reseasrch,2001,1(2):127-132.
[10]李夏兰,范韵敏,方柏山.来自桔青霉的阿魏酸酯酶的分离纯化、理化性质[J].微生物学报,2010,50(8):1058-1064.
[11]方园,欧仕益,张宁.阿魏酸酯酶的制备及其酶学性质[J].暨南大学学报(自然科学与医学版),2012,33(5):481-485.
[12]MOUKOULI M,TOPAKAS E,CHRISTAKOPOULOS P.Cloning, characterization and functional expression of an alkalitolerant type C feruloyl esterase fromFusariumoxysporum[J].Applied Microbiology and Biotechnology,2008,79(2):245-254
[13]张帅兵,裴小琼,吴中柳.黑曲霉阿魏酸酯酶A的克隆、表达及快速酶活检测体系的建立[J].应用与环境生物学报,2009,15(2):276-279.
[14]曾妍,龚燕燕,邬敏辰,等.阿魏酸酯酶A的基因克隆与表达及其水解产物的纯化[J].生物工程学报,2014,30(3):425-434.
[15]FAZARY A E,HAMAD H A,LEE J C,et al.Expression of feruloyl esterase fromAspergillusawamoriinEscherichiacoli: Characterization and crystal studies of the recombinant enzyme[J].International Journal of Biological Macromolecules,2010,46(4):440-444.
[16]CEREGHINO J L,CREGG J M.Heterologous protein expression in the methylotrophic yeastPichiapastoris[J].FEMS Microbiology Reviews,2000,24(1):45-66.
[17]MIZUNO T,SHIONO Y,KOSEKI T.Biochemical characterization ofAspergillusoryzaenative tannase and the recombinant enzyme expressed inPichiapastoris[J].Journal of Bioscience and Bioengineering,2014,118(4):392-395.
[18]DONAGHY J A,BRONNENMEIER K,SOTO-KELLY P F,et al.Purification and characterization of an extracellular feruloyl esterase from the thermophilic anaerobeClostridiumstercorarium[J].Journal of Applied Microbiology,2000,88(3):458-466.
(责任编辑: 钱筠 英文审校: 刘源岗)
Expression of Feruloyl Esterase O42807 inPichiapastorisGS115
CHEN Yunhua, LI Hui, ZHANG Guangya, GE Huihua, LI Xialan
(College of Chemical Engineering, Huaqiao University, Xiamen 361021, China)
Abstract:This paper studied the expression of the feruloyl estrase O42807 in Pichia pastoris GS115 and the enzymatic properties of the recombinant feruloyl estrase. Based on the amino acids of feruloyl estrase O42807, the gene (fae) of feruloyl estrase was synthesized chemically. The secreted expression vector pPIC9K-fae was constructed by the ligation of the fae gene into the shuttle vector pPIC9K. The plasmid pPIC9K-fae was linearized and then electrotransformed into Pichia pastoris GS115. Afterwards, the recombinant strain with high level of feruloyl estrase activity was obtained through activity screening. The SDS-PAGE result showed a single band in the fermentation supernatant. The molecular weight of the recombinant feruloyl estrase was about 42 ku and the enzyme activity was 78.49 nkat·mL-1. The specific activity of the recombinant feruloyl estrase was 524.38 nkat·mg-1. The results also showed that the optimal reaction temperature was 50 ℃, and stable from 40 ℃ to 45 ℃. And the optimal pH was from 5.0 to 5.5, stable at pH 6.0. Furthermore, the enzymatic activity was slightly enhanced by K+, Ca2+, Na+, whereas it was slightly inhibited by Fe2+, Zn2+, and strongly inhibited by Mn2+, Cu2+.
Keywords:feruloyl esterase; expression; Pichia pastoris; enzymatic properties
中图分类号:Q 78; Q 556+.1
文献标志码:A
基金项目:福建省厦门市科技计划项目(2014S006); 福建省发改委投资基金资助项目(2013-886)
通信作者:李夏兰(1965-),女,教授,博士,主要从事生物化工的研究.E-mail:xialan@hqu.edu.cn.
收稿日期:2014-10-31
doi:10.11830/ISSN.1000-5013.2016.02.0224
文章编号:1000-5013(2016)02-0224-06

