缺血/再灌注时豚鼠左心室流出道自律组织电活动的改变及药物干预效应*
赵兰平, 薛淑芳, 陈彦静, 王雪芳, 陈立锋, 范玉宏, 张祥宇
(1. 河北北方学院生理教研室, 张家口 075000; 2. 中国中医科学院中医基础理论研究所, 北京 100700; 3. 河北北方学院第一临床医学院, 张家口 075000)
缺血/再灌注时豚鼠左心室流出道自律组织电活动的改变及药物干预效应*
赵兰平1△, 薛淑芳1, 陈彦静2, 王雪芳1, 陈立锋1, 范玉宏3, 张祥宇1
(1. 河北北方学院生理教研室, 张家口 075000; 2. 中国中医科学院中医基础理论研究所, 北京 100700; 3. 河北北方学院第一临床医学院, 张家口 075000)
目的:研究缺血/再灌注(I/R)时豚鼠离体左心室流出道自律组织电活动的改变及其药物干预效应。方法:采用标准玻璃微电极细胞内电位记录技术,记录豚鼠离体左心室流出道标本的自发慢反应电位,观测模拟I/R时该电位的改变,以及临床上常用的抗心律失常药物灌流标本时对I/R电生理效应的干预作用。观测指标:4相自动除极速度(VDD)、自发放电频率(RPF)、最大舒张电位(MDP)、0相最大除极速度(Vmax)、动作电位幅度(APA)、复极50%和90%时间(APD50和APD90)。结果:①与对照组相比,I 10 min组VDD和RPF明显减慢(P<0.05),Vmax加快(P<0.01),APA增大(P<0.01)。与I 10 min组和对照组相比,R 2 min组VDD和RPF明显加快(P<0.01),且在R至5 min过程中可出现明显节律不齐,MDP绝对值明显增大(P<0.05),Vmax与对照组相比明显加快(P<0.05),APA与I 10 min组相比明显下降(P<0.05),但仍显著高于对照组(P<0.05),APD50和APD90显著缩短(P<0.01)。R 15 min组自发慢反应电位各项指标逐渐恢复至对照组水平。②与I 10 min/R 2 min组相比,1 μmol/L利多卡因、10 μmol/L普罗帕酮、1 μmol/L胺碘酮、1 μmol/L维拉帕米、50 μmol/L腺苷和10 μmol/L硝普钠均可明显改善R过程中VDD和RPF的改变以及由此引起的节律不齐。结论:I/R可触发左心室流出道自律组织电活动异常,这种效应在应用不同的抗心律失常药物灌流时可显著恢复。
缺血/再灌注;左心室流出道;自律组织;药物干预;豚鼠
缺血/再灌注(ischemia/reperfusion,I/R)损伤是急性冠脉综合征尤其是急性心肌梗死导致室性心动过速和室性纤维颤动,甚至再灌注后猝死的最主要原因。国外报道80%的特发性室性心动过速(idopathic ventricular tachyarrhythmias,IVT)起源于右心室流出道,起源于左室流出道的IVT约占所有流出道室速的10%[1]。课题组前期的研究表明,心室流出道的特定部位存在慢反应自律细胞,其电活动可能同样接受自主神经的调控[2],在心脏自律性电活动异常时可作为另一潜在起搏点参与IVT的发生,从而提示急性心肌梗死时I/R损伤导致的心室流出道自律性电活动异常可能参与再灌注心律失常的发生和发展。为进一步探讨心室流出道自律性电活动在I/R损伤时的改变,本研究采用停灌/复灌方法[3,4]模拟I/R,观察左心室流出道自发慢反应动作电位的改变,以及临床一些常用的抗心律失常药对上述电位改变的干预作用,为心肌梗死后再灌注心律失常的发病机制的研究提供直接的电生理实验依据。
1 材料与方法
1.1 标本制备
健康豚鼠,250~350 g,击昏后迅速开胸取出心脏,并用O2饱和的改良Locke液(mmol/L: NaCl 157,KCl 5.6,CaCl22.1,NaHCO31.8,葡萄糖5.6,pH 7.3~7.4)经冠脉进行灌注冲洗后,从主动脉瓣的左瓣与后瓣间向下剪开心室,保留各瓣膜完整,并以此为宽度,向下切取约4 mm的前庭组织制成标本。制好的标本用不锈钢针固定于灌流槽(1.5 cm×2 cm)内的硅橡胶上。用O2饱和的改良Locke液进行恒温(35℃±1℃)、恒速(10 ml/min)灌流,标本在灌流液中稳定30 min后开始实验。
1.2 电位引导
采用常规玻璃微电极细胞内电位记录技术,引导心室流出道自律细胞的动作电位。如能直接记录到自发电位,则不再进行刺激,若记录不到,则将刺激电极置于标本远离瓣膜一端的心肌组织上,给予波宽2 ms、1 Hz、两倍阈强度的方波刺激,刺激时间由数秒至数分钟不等,直至诱发出稳定的自发节律,即停止电刺激开始实验。引导出的自发慢反应电位,经SWF-1B高阻抗微电极放大器放大,一路输入监听器监听,另一路采用RM6280多道生理信号采集处理系统,自动显示电信号,并分析自发慢反应电位的各项参数指标,即4相自动除极速度(velocity of diastolic depolarization,VDD)、自发放电频率(rate of pacemaker firing,RPF)、最大舒张电位(maximal diastolic potential,MDP)、0相最大除极速度(maximal rate of depolarization,Vmax)、动作电位幅度(amplitude of action potential,APA)、复极50%和90%时间(50% and 90% of duration of action potential,APD50and APD90)。
1.3 实验过程和分组
待自发节律稳定30 min后,开始采集一组正常的自发慢反应电位做对照,然后进行各项实验操作,实时记录并分析自发慢反应电位的变化。63只豚鼠随机分成7组,每组9只。为保证药效,各种药液均在实验前1 h内配制。实验分组如下:(1)I/R时豚鼠左心室流出道自发慢反应电位的改变研究(n=9):采集对照自发慢反应电位,停灌10 min,然后以正常灌流液再灌模拟I/R,分别记录对照组、停灌10 min组(I 10 min)、再灌2 min组(R 2 min)、和再灌15 min组(R 15 min)自发慢反应电位的改变。(2)不同药物对I/R时豚鼠左心室流出道自发慢反应电位改变的影响研究(n=9):采集对照自发慢反应电位,停灌10 min模拟缺血,然后以正常灌流液再灌至2 min时,换用含有不同浓度的各种药液再灌10 min,分别记录对照组、停灌10 min/再灌2 min组(I 10 min/R 2 min)、1 μmol/L利多卡因(lidocaine)10 μmol/L普罗帕酮(propafenone)1 μmol/L胺碘酮(amiodarone)1 μmol/L维拉帕米(verapamil)50 μmol/L腺苷(adenosine)10 μmol/L硝普钠(sodium nitroprusside,SNP)再灌10 min组自发慢反应电位的改变。
1.4 统计学处理
2 结果
2.1 左心室流出道I/R过程中自发慢反应电位的改变
与对照组相比,I 10 min组VDD和RPF明显减慢(P<0.05),MDP绝对值有所增大,但无显著性差异,APA明显增大(P<0.01),Vmax明显加快(P<0.01),APD50和APD90轻度延长,但无显著性差异。
与I 10 min组和对照组相比,R 2 min组VDD和RPF明显加快(P<0.01),MDP绝对值明显增大(P<0.05)。Vmax与对照组相比明显加快(P<0.05),与I 10 min组相比有所减慢,但无显著性差异。APA与I 10 min组相比明显下降(P<0.05),但仍显著高于对照组(P<0.05)。APD50和APD90与I 10 min组和对照组相比均显著缩短(P<0.01)。
再灌至5 min的过程中,自发节律不稳定,容易出现节律不齐,有二联律、三联律的出现,再灌至13 min时自发节律逐渐恢复稳定。
与R 2 min组相比,R 15 min组VDD和RPF明显减慢(P<0.05),与对照组相比VDD仍明显加快(P<0.05),RPF基本恢复至对照组水平。与对照组相比,Vmax仍明显加快(P<0.01),MDP绝对值、APA、APD50和APD90基本恢复至对照组水平(图1、表1)。
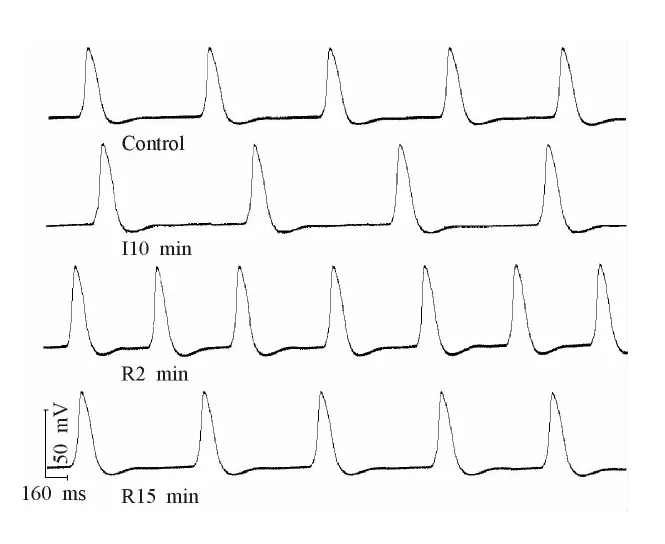
Fig. 1 Effects of I/R on the spontaneous action potentials of guinea-pig left ventricular outflow tract

Tab. 1 Effects of I/R on the spontaneous action potentials of guinea-pig left ventricular outflow tract(±s, n=9)
VDD: Velocity of diastolic depolarization; RPF: Rate of pacemaker firing; MDP: Maximal diastolic potential; Vmax: Maximal rate of depolarization; APA: Amplitude of action potential; APD50and APD90: 50% and 90% of duration of action potential; I: Ischemia; R: Reperfusion
*P<0.05,**P<0.01vscontrol;?#P<0.05,##P<0.01vsI 10 min;?△P<0.05,△△P<0.01vsR 2 min
2.2 不同药物对I/R左心室流出道自发慢反应电位改变的影响
1 μmol/L利多卡因、10 μmol/L普罗帕酮、1 μmol/L胺碘酮、1 μmol/L维拉帕米和50 μmol/L腺苷再灌10 min组均可使I 10 min/R 2 min时的VDD和RPF加快显著减慢,与I 10 min/R 2 min组相比有统计学差异。外源性NO供体SNP(10 μmol/L)再灌10 min组RPF明显减慢,与I 10 min/R 2 min组相比有显著差异(P<0.01),但仍高于对照组水平,VDD与I 10 min/R 2 min组相比无明显改变。与I 10 min/R 2 min组相比,MDP绝对值在利多卡因组、胺碘酮组、维拉帕米组均显著减小(P<0.05),SNP再灌组显著增大(P<0.05)。APA在利多卡因组、胺碘酮组、维拉帕米组和腺苷组明显减小(P<0.05),SNP组显著增大(P<0.01)。利多卡因、普罗帕酮、胺碘酮、维拉帕米、腺苷和SNP均可使I/R过程中APD50的缩短明显恢复至接近对照组水平。与I 10 min/R 2 min组相比,APD90在普罗帕酮组、胺碘酮组、维拉帕米组和SNP组明显延长(P<0.05),其余各组无明显改变。I/R过程中利多卡因再灌1 min之内节律有所加快,但无显著性差异,随后自发节律逐渐减慢,灌流10 min时节律明显减慢。I/R过程中,胺碘酮和SNP再灌,可明显改善R造成的节律不齐,使自发节律较快恢复,并维持在相对稳定状态(图2、表2)。
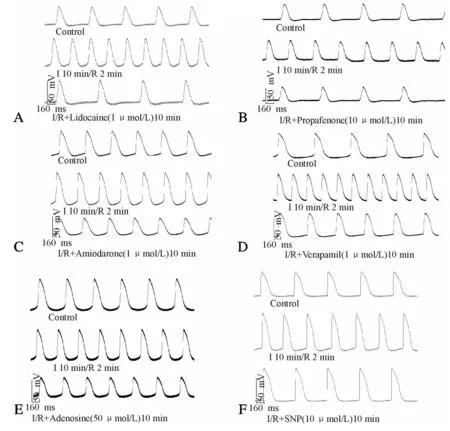
Fig. 2 Effects of different antiarrhythmic drugs on the spontaneous action potentials of guinea-pig left ventricular outflow tract under the conditions of I/R A: Effects of lidocaine(1 μmol/L) on I/R; B: Effects of propafenone(10 μmol/L) on I/R; C: Effects of amiodarone(1 μmol/L) on I/R; D: Effects of verapamil(1 μmol/L) on I/R; E: Effects of adenosine(50 μmol/L) on I/R; F: Effects of SNP (10 μmol/L) on I/R
Tab. 2 Effects of different antiarrhythmic drugs on the spontaneous action potentials of guinea-pig left ventricular outflow tract under the conditions of I/R(±s,n=9)

VDD(mV/s)RPF(beats/min)MDP(mV)Vmax(V/s)APA(mV)APD50(ms)APD90(ms)Control34.97±4.84138.53±11.72⁃45.37±2.238.06±1.0855.31±6.53139.20±10.85185.60±18.91I10min/R2min36.13±4.27∗161.73±19.40∗⁃50.84±3.6311.14±1.15∗60.20±4.76124.00±16.00∗165.60±18.01∗I/R+Lidocaine(1μmol/L)10min31.62±1.82#105.09±13.16##⁃42.19±3.337.90±1.39#46.75±3.47#141.60±9.67##177.60±24.74Control33.51±3.48133.89±8.93⁃50.78±3.758.16±1.3461.82±7.90147.80±16.08187.80±19.45I10min/R2min39.62±4.44∗169.21±23.10∗⁃56.12±1.07∗11.72±1.28∗66.43±7.61129.96±19.25∗161.30±17.97∗I/R+Propafenone(10μmol/L)10min33.18±2.28#114.15±15.49#⁃50.98±2.6610.86±1.2761.51±3.01156.80±21.82#182.40±10.54#Control31.79±3.26145.32±16.67⁃53.64±5.848.67±1.4657.16±6.92143.20±10.55189.80±26.14I10min/R2min38.62±5.02∗171.50±23.49∗∗⁃59.66±6.29∗10.62±1.6862.55±5.91∗130.80±13.00∗∗178.40±18.04I/R+Amiodarone(1μmol/L)10min32.53±2.83#134.86±15.79##⁃53.02±4.879.06±1.35#55.59±5.60##146.40±11.20##196.00±23.08#Control33.19±4.00135.39±8.92⁃41.64±3.187.92±1.2049.22±1.35144.80±11.97193.60±20.53I10min/R2min35.96±3.74∗179.52±10.76∗∗⁃53.60±6.40∗9.46±1.09∗∗58.15±6.60∗132.00±11.31∗∗180.00±21.32I/R+Verapamil(1μmol/L)10min32.47±3.52#137.80±8.77##⁃42.45±5.11#8.13±1.1651.18±3.94#144.20±8.73#196.40±20.54#Control33.34±5.87148.71±11.64⁃51.46±1.978.81±1.1659.04±8.18141.40±19.87188.00±20.34I10min/R2min35.89±5.85∗∗180.38±8.61∗∗⁃56.89±1.01∗10.25±1.3365.06±7.70∗125.60±11.31∗178.20±13.72I/R+Adenosine(50μmol/L)10min30.19±2.48#158.67±14.42#⁃55.54±3.299.00±0.7352.12±6.76#145.80±14.95#191.60±26.86Control32.72±3.45130.34±9.70⁃54.07±8.898.36±0.4860.10±5.18137.40±26.12175.00±17.20I10min/R2min43.22±11.70∗163.75±7.54∗∗⁃59.01±10.11∗10.10±1.38∗63.27±11.41116.60±11.69∗146.00±11.80∗I/R+SNP(10μmol/L)10min34.97±4.67146.42±10.66##⁃61.24±11.04#10.34±1.3769.63±10.52#134.80±13.92#173.20±19.00#
*P<0.05,**P<0.01vscontrol;?#P<0.05,##P<0.01vsI 10 min/R 2 min
3 讨论
心室流出道在发生上起源于心脏内不同种类的细胞,也可由心脏外细胞移行而来[5],因此决定了该部位组织细胞的动作电位较复杂,具有电生理异质性。左心室流出道自发慢反应动作电位的产生机制与窦房结起搏细胞类似,但节律较慢[2]。
缺血后再灌注常可导致心律失常。缺血诱导L-型钙通道开放,大量Ca2+内流,使缺血心室流出道自发慢反应电位Vmax加快,APA增大。缺血过程中伴随的能量合成障碍、缺氧、酸中毒等可激活ATP敏感性钾电流(IKATP),表现为外向电流增加,K+外流的进行性衰减减慢,以及缺血对If的抑制作用,可导致VDD和RPF减慢。模拟缺血液灌流豚鼠心室肌细胞20 min,IK明显减小[6],可部分抵消KATP,故本实验模拟缺血过程中APD50和APD90有所延长,但与对照组相比无显著性差异。再灌注时的钙超载使ICa-L受到抑制,L型钙电流峰值电流密度明显下降[7],而导致再灌注时心室流出道自发慢反应电位Vmax减慢,APA减小。I/R时的K+大量外流,可缩短该自发慢反应动作电位时程,表现为APD50和APD90显著缩短,使有效不应期(ERP)缩短而导致再灌注心律失常的发生。有文献报道[8],离体大鼠心脏再灌注后心律失常的发生率为100%,表现为室性心动过速及室颤。
临床上的抗心律失常药主要作用于起搏细胞的离子流而发挥作用。利多卡因、普罗帕酮、腺苷均可抑制4期Na+内流(If)[9],利多卡因和腺苷还可促进K+外流,其中腺苷可作用于细胞膜上的A1受体,通过Gi蛋白激活腺苷依赖性钾通道(IK-Ado),引起细胞膜过度极化,导致K+外流进行性衰减减慢,胺碘酮可抑制ICa-T,使I/R过程中的心室流出道自律组织VDD和RPF减慢,自发节律减慢。本实验中,各种抗心律失常药均可明显抑制ICa-L,从而导致I/R过程中的Vmax减慢和APA减小。利多卡因和腺苷可促进复极化过程中的K+外流,而导致心室流出道自发慢反应电位的APD50和APD90缩短,胺碘酮可显著抑制特异性延迟整流钾电流,包括IKr和IKs,延长自发慢反应电位的APD50和APD90以及ERP,有效终止各种微折返。普罗帕酮可阻断IKr,使复极过程中的K+外流速度减慢,而导致APD50和APD90延长。维拉帕米具有显著的抑制ICa-L作用,使再灌注过程中Ca2+内流减少,APD50和APD90延长,并可减轻钙超载而明显减轻心肌缺血/再灌注损伤。另外,利多卡因还可通过增加Bcl-2表达,降低Caspase-3活性而减少再灌注损伤[10]。胺碘酮还可提高血清中超氧化物歧化酶和降低丙二醛水平,增加Bcl-2蛋白、减少Bax蛋白的表达,降低心肌细胞凋亡率减轻心肌缺血/再灌注损伤[11]。NO是参与心肌I/R病理生理过程中的重要气体分子。在大鼠心脏缺血/再灌注早期,总NOS(tNOS)和内皮型NOS(eNOS)活性降低,心肌NO含量明显减少[12],再灌注过程中补充不同浓度外源性NO供体SNP可显著改善R造成的节律不齐,但若诱导型NOS(iNOS)活性升高,NO含量可升高[13]。
临床上特发性左心室流出道室速发作时首选维拉帕米,部分可对腺苷和迷走神经兴奋剂敏感,特发性右心室流出道室速多数患者对传统的抗心律失常药物特别是β-受体阻断剂有效。本研究表明各种抗心律失常药可显著改善再灌注时的心室流出道节律异常,其中胺碘酮和SNP再灌时可使心室流出道自发节律的异常较快恢复,且较稳定。腺苷和利多卡因也可促使再灌注时的节律改变较快恢复,但持续时间相对较短,期望通过本研究对临床上源于流出道的再灌注心律失常的治疗提供指导。
[1] Altemose GT, Buxton AE. Idiopathic ventricular tachycardia[J].AnnuRevMed, 1999, 50: 159-177.
[2] 赵兰平, 张晓云, 陈彦静, 等. 神经递质对豚鼠左心室流出道自律细胞电活动的影响[J]. 生理学报, 2005, 57(5): 593-598.
[3] Zhang LP, Ma HJ, Bu HM,etal. Polydatin attenuates ischemia/reperfusion-induced apoptosis in myocardium of the rat[J].ActaPhysiologicaSinica, 2009, 61(4): 367-372.
[4] 王 静, 姜玉新, 崔凤娟, 等. 银杏达莫注射液抑制大鼠离体心脏缺血/再灌注损伤的机制研究[J]. 中国病理生理杂志, 2013, 29(9): 1573-1578.
[5] Rentschler S, Jain R, Epstein JA. Tissue-tissue interactions during morphogenesis of the outflow tract[J].PediatrCardiol, 2010, 31(3): 408-413.
[6] 刘爱华, 张志雄, 王星禹. 银杏酮酯对模拟缺血豚鼠心室肌细胞IK的影响[J]. 中国应用生理学杂志, 2010, 26(4): 444-448.
[7] 贺 熙, 毕学苑, 王 皓, 等. 心血管缺血再灌注损伤钙调控的研究进展[J]. 生理学报, 2012, 64(3): 321-326.
[8] 郭丽丽, 王 阶, 陈 雯, 等. 制备大鼠离体心脏损伤模型的最佳缺血再灌注时间[J]. 中国药理学与毒理学杂志, 2012, 26(3): 353-356.
[9] Thollon C, Vilaine JP. I(f) inhibition in cardiovascular diseases[J].AdvPharmacol, 2010, 59: 53-92.
[10]赵福平, 王鹏飞, 孟俊鹏. 利多卡因对缺血再灌注离体大鼠心脏Bcl-2与Caspase-3表达的影响[J]. 中国现代药物应用, 2010, 4(9): 33-34.
[11]信栓力, 杨 华, 常 超, 等. 胺碘酮对兔心肌缺血/再灌注心肌细胞凋亡及Bcl-2、Bax蛋白表达的影响[J]. 心脏杂志, 2013, 25(4): 400-403,407.
[12]韩宇博, 田 苗, 郭维毅, 等. 苓桂术甘汤预防性给药对心肌缺血再灌注损伤NO、NOS含量的影响[J]. 中医药信息, 2014, 31(5): 84-86.
[13]李 乐, 丁宝兴, 王本兰. 绞股蓝总黄酮对低氧/复氧心肌细胞Ca2+及NOS-NO系统的作用[J]. 中国应用生理学杂志, 2011, 27(3): 269-269.
Electrophysiological effects of ischemia/reperfusion (I/R) on pacemaker cells in guinea-pig left ventricular outflow tract and the effects of antiarrhythmic drugs treatment
ZHAO Lan-ping1△, XUE Shu-fang1, CHEN Yan-jing2, WANG Xue-fang1, CHEN Li-feng1, FAN Yu-hong3, ZHANG Xiang-yu1
(1. Department of Physiology, Hebei North University, Zhangjiakou 075000; 2. Institute of Basic Theories, China Academy of Chinese Medical Sciences, Beijing 100700; 3. The First Clinical Medical College, Hebei North University, Zhangjiakou 075000, China)
Objective: To investigate the electrophysiological effects of ischemia/reperfusion (I/R) on the spontaneous slow response action potentials in guinea-pig left ventricular outflow tract and the effects of antiarrhythmic drugs on I/R. Methods: The action potentials of pacemaker cells in guinea-pig left ventricular outflow tract were recorded by conventional intracellular microelectrode technique. The influences of ischemia(I) 10 min, reperfusion(R) 2 min, and R 15 min on the spontaneous slow response potentials were investigated. The effects of lidocaine, propafenone, amiodarone, verapamil, adenosine, and sodium nitroprusside (SNP) on I/R were also studied. Electrophysiological parameters were examined: velocity of diastolic depolarization(VDD), rate of pacemaker firing(RPF), maximal diastolic potential(MDP), maximal rate of depolarization(Vmax), amplitude of action potential(APA), 50% and 90% of duration of action potential(APD50and APD90). Results: ①In I 10 min group, the values of VDD, RPF, Vmaxand APA were decreased markedly compared with control group (P<0.05,P<0.01).In R 2 min group, VDD and RPF were increased significantly(P<0.01), MDP was increased notably(P<0.05), APD50and APD90were shortened significantly compared with I 10 min and control group. Vmaxwas increased markedlyvscontrol group(P<0.05). APA was decreased notablyvsI 10 min group (P<0.05), but was increased markedlyvscontrol group(P<0.05). In R 15 min group, the action potentials recovered gradually to the levels of control group. ② Compared with I 10 min/R 2 min group, 1 μmol/L lidocaine, 10 μmol/L propafenone, 1 μmol/L amiodarone, 1 μmol/L verapamil, 50 μmol/L adenosine, and 10 μmol/L SNP decreased VDD and RPF significantly. Conclusion: I/R injury can trigger abnormal spontaneous activities of guinea-pig left ventricular outflow tract. The electrophysiological effects of I/R injury on left ventricular outflow tract can be treated by antiarrhythmic drugs.
ischemia/reperfusion; left ventricular outflow tract; electrophysiological effect; drug treatment; guinea-pig
河北省卫生厅重点科技研究计划项目(20130038);河北北方学院创新人才培育项目(CXRC1324)
2015-08-03
2016-05-18
Q463;R331.3
A
1000-6834(2016)05-466-05
10.13459/j.cnki.cjap.2016.05.021
△【通讯作者】Tel: 0313-4029313; E-mail: zhaolp2009@126.com

