胰腺p-STAT3在急性胰腺炎危重演变中的表达变化*
史迎莉, 刘 芳, 张晓芹, 贾晓云, 李 涛, 许小凡, 张 红△
(1. 陕西中医药大学 医学科研实验中心, 咸阳 712046; 2. 敦化市医院病理科, 吉林 敦化 133700)
胰腺p-STAT3在急性胰腺炎危重演变中的表达变化*
史迎莉1, 刘 芳1, 张晓芹1, 贾晓云2, 李 涛1, 许小凡1, 张 红1△
(1. 陕西中医药大学 医学科研实验中心, 咸阳 712046; 2. 敦化市医院病理科, 吉林 敦化 133700)
目的:检测信号转导与转录激活因子3(STAT3)在不同程度胰腺炎模型小鼠胰腺组织中表达的变化,探讨其在急性胰腺炎危重演变中的作用。方法:48只健康雄性balb/c小鼠随机分为3组(n=16):对照组(Con)、轻症急性胰腺炎(MAP)组、重症急性胰腺炎(SAP)组。Con组腹腔注射0.9% NaCl;MAP组腹腔注射雨蛙素;SAP组腹腔注射雨蛙素联合脂多糖;分别于造模后2 h、6 h检测血清淀粉酶的活性;分离胰腺、称重,计算胰腺湿重比;检测肺组织髓过氧化物酶(MPO)活性,评估炎细胞浸润肺组织的程度;HE染色切片,光镜下观察胰腺、肺组织病理学改变; Western blot法检测磷酸化STAT3(p-STAT3)的变化。结果:与Con组比较, MAP组和SAP组在各时间点血清淀粉酶活性和胰腺组织湿重比均升高(P<0.05);肺组织MPO活性显著升高(P<0.05),且SAP组肺MPO含量明显高于MAP组(P<0.01)。MAP组和SAP组,在造模后2 h,胰腺和肺均可见不同程度的病理学改变; SAP组在造模后2 h胰腺p-STAT3的表达最高,6 h表达有所减弱;MAP组各时间点仅有微量表达;Con组在各时间点为阴性表达。结论:p-STAT3在轻症急性胰腺炎和重症急性胰腺炎模型小鼠胰腺中的表达差异明显,说明重症急性胰腺炎的重症化与STAT3的活化关系密切;抑制STAT3活化将成为阻止急性胰腺炎重症化的靶点之一。
急性胰腺炎;信号转导和转录激活因子3 ;病理组织学;髓过氧化物酶;小鼠
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床常见的危重疾病之一,起病急、病情凶险、并发症多,死亡率可达20%~30%。发病机制尚不明确。近来的研究显示:在SAP发生、发展的过程中,细胞因子和炎症介质发挥了重要作用[1],尤其是白介素-6(interleukin-6, IL-6)。在轻症急性胰腺炎(mild acute pancreatitis,MAP)和SAP患者血清中IL-6含量明显不同,血清中IL-6等细胞因子的水平与SAP及其全身并发症的严重程度关系密切[2,3]。近期研究提示:IL-6等炎性细胞因子可诱发其下游转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)活化,从而促进炎症的进一步发展[4]。急性胰腺炎(acute pancreatitis,AP)发生时,STAT3活化是否参与急性胰腺炎重症化演变过程及急性胰腺炎的炎症损伤值得深入研究。本实验通过复制小鼠MAP和SAP模型,观察其胰腺组织、肺组织的病理学变化及胰腺组织中STAT3活化程度的改变,探讨在AP危重演变过程中STAT3的作用,以期为早期诊断和治疗SAP提供理论依据。
1 材料与方法
1.1 试剂和仪器
雨蛙素(cerulein,批号:108k721)、脂多糖(lipopolysaccharide, LPS,L-2880)购自Sigma 公司; STAT3单克隆抗体(批号:sc-2186-R)购于美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的羊抗兔IgG(批号:BA1054)购自武汉博士德公司;兔抗小鼠β-actin 单克隆抗体(批号:019982)购自北京博奥森公司;血清淀粉酶及髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒均购自南京建成生物研究所;酶标仪(Bio-Tek,ELX808);研究级正置显微镜及图形采集系统(德国蔡司,A1);蛋白电泳及转膜系统、凝胶成像分析系统(美国Bio-rad)。
1.2 实验动物
健康雄性Balb/c小鼠48只:体重(20±2)g,6~8周龄,购于第四军医大学实验动物中心(动物合格证号:0001442),分笼室温(20℃~25℃)饲养,自由摄食、饮水。
1.3 方法
1.3.1 分组与造模 48只雄性小鼠,随机分为3组:对照组(Con)(0.9% NaCl);轻症急性胰腺炎(MAP)组(cerulein);重症急性胰腺炎(SAP)组(cerulein + LPS);各组又再按照时间点分为2 h、6 h组(n=8)。
小鼠造模前禁食12 h,MAP组,每小时腹腔注射Cerulein(50 μg/kg),分别注射2次和6次;SAP组[5]腹腔注射 Cerulein联合LPS (Cerulein,50 μg/kg;LPS在Cerulein 第1次注射后立即注射,10 mg/kg);对照组在相同的时间点腹腔注射等体积的0.9% NaCl。
1.3.2 检测血清淀粉酶活性 在造模后2 h、6 h,水合氯醛麻醉,下腔静脉采血,分离血清,按照试剂盒要求,检测血清淀粉酶活性的变化。
1.3.3 记算胰腺湿重比 摘取胰腺,去除血污等,称量胰腺湿重,计算胰腺湿重比。
1.3.4 镜下观察胰腺和肺的病理学改变 制备常规石蜡切片,HE染色,光镜下观察胰腺及肺组织病理学变化并采集图像。
1.3.5 肺髓过氧化物酶检测 将右肺组织匀浆,高速冷冻离心机离心10 min(4℃,10 000 r/min),吸取上清,按试剂盒要求检测MPO,评估肺组织中炎细胞浸润的程度。
1.3.6 Western blot法检测胰腺p-STAT3的表达 取50 mg胰腺组织匀浆,静置冰上30 min,高速冷冻离心机离心10 min(4℃,10 000 r/min),吸取上清,用BCA检测试剂盒检测蛋白浓度,稀释样品浓度至4 μg/μl;配浓度为10%的SDS-PAGE胶,上样进行蛋白电泳,待样品跑至胶底部后,电转移至PVDF膜。5%脱脂奶粉封闭膜,室温,摇床上轻摇1 h。封闭结束用TBST洗脱,置于摇床上轻摇,5 min×3次;之后孵育Ⅰ抗,按比例稀释β-actin (1∶2 000),p-STAT3(1∶500),分别滴加稀释后的一抗至PVDF膜,4℃层析柜,摇床轻摇孵育过夜。TBST漂洗5 min×3次,滴加辣根过氧化物酶(HRP)标记的羊抗兔IgG Ⅱ 抗(稀释浓度为1∶1 000),室温1 h。TBST漂洗,10 min×3次。将PVDF膜置于暗盒中,在膜上滴加ECL发光剂,在暗室中用X光片曝光,显影、定影后,用图像分析软件分析结果。
1.3.7 统计学分析
2 结果
2.1 各组血清淀粉酶活性变化
造模后, 与Con组相比较,MAP组和SAP组各时间点血清淀粉酶活性均明显升高,差异具有显著性(P<0.05);在造模后6 h,SAP组血清淀粉酶活性高于MAP组,但无统计学差异(表1),表明血清淀粉酶水平随着胰腺炎的进展而升高。
2.2 胰腺湿重比
造模后, 与Con组相比较, 在各时间点MAP和SAP组胰腺湿重均明显增加,差异有统计学意义 (P<0.05,P<0.01);MAP组和SAP组相比,无统计学意义(表1);表明急性胰腺炎炎症早期水肿明显,胰腺湿重比升高。
Tab. 1 Levels of serum amylase and pancreatic wet weight ratio in each group at different time point(±s,n=8)
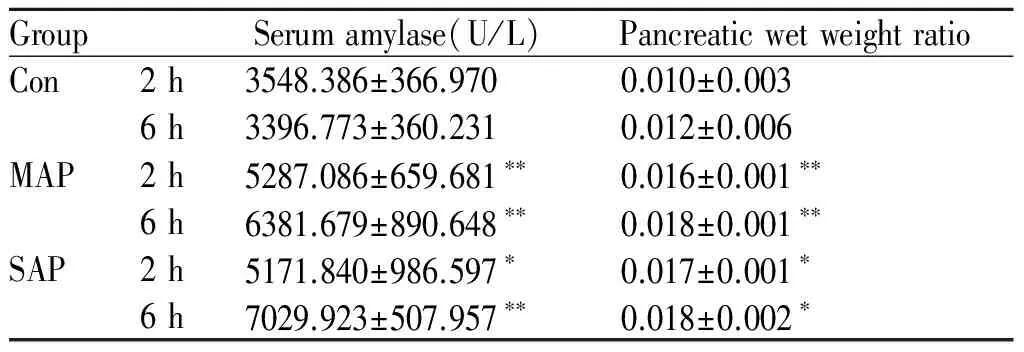
GroupSerumamylase(U/L)PancreaticwetweightratioCon2h3548.386±366.9700.010±0.0036h3396.773±360.2310.012±0.006MAP2h5287.086±659.681∗∗0.016±0.001∗∗6h6381.679±890.648∗∗0.018±0.001∗∗SAP2h5171.840±986.597∗0.017±0.001∗6h7029.923±507.957∗∗0.018±0.002∗
Con: Control; MAP: Mild acute pancreatitis; SAP: Severe acute pancreatitis
*P<0.05,**P<0.01vsCon group
2.3 各组肺组织MPO活性变化
Cerulein诱发AP后, 与Con组相比较,在各时间点MAP和SAP组肺MPO含量明显增加, 具有统计学意义(P<0.01); SAP组在各时间点MPO均明显升高,尤其是2 h,与同时间点MAP组相比较,差异显著 (P<0.01,表2)。表明急性胰腺炎发生时,同时伴有肺组织炎性细胞浸润,且SAP组重于MAP组。
Tab. 2 The expressions of p-STAT3 protein and MPO in each group at 2 h and 6 h(±s,n=8)

GroupProteinlevel(/β⁃actin)MPOCon2h0.106±0.0020.004±0.0036h0.105±0.0050.006±0.002MAP2h0.316±0.0030.159±0.049∗∗6h0.257±0.0010.236±0.098∗∗SAP2h1.034±0.0261.193±0.255∗∗##6h0.601±0.0050.664±0.086∗∗##
Con: Control; MAP: Mild acute pancreatitis; SAP: Severe acute pancreatitis; MPO: Myeloperoxidase
**P<0.01vsCon group;?##P<0.01vsMAP group
2.4 胰腺与肺的病理学改变
光镜下Con组小鼠胰腺无明显病理学改变;造模后2 h ,MAP组和SAP组模型小鼠,均可见胰腺组织小叶间肿胀, 有少量中性粒细胞浸润;造模后6 h,MAP组胰腺腺泡肿胀,间质小血管扩张、充血,有中性粒细胞浸润;而SAP组胰腺腺泡肿胀明显,间隙变小,有大量中性粒细胞浸润,出现点片状坏死灶(图1,见彩图页Ⅳ)。
Con组小鼠肺组织无明显病理改变;造模后2 h, MAP和SAP组肺组织均可见肺泡间隔轻度水肿、间隙增宽,有少量中性粒细胞浸润;造模后6 h,MAP组和SAP组均可见肺泡间隔增宽,炎细胞浸润,部分肺泡腔内有渗出(图2,见彩图页Ⅳ)。
2.5 各组小鼠胰腺组织p-STAT3蛋白表达的变化
Con组小鼠胰腺中未检测到p-STAT3蛋白的表达; MAP组在各时间点仅见p-STAT3蛋白有微弱表达,而SAP组在造模后2 h,可见p-STAT3表达明显增强,在6 h,p-STAT3表达有所降低,但与MAP组相应时间点比较,差异无显著性;提示胰腺STAT3活化可能参与了急性胰腺炎的重症化进程(图3,表2)。

Fig. 3 Expression of p-STAT3 at 2 h and 6 h
3 讨论
研究发现[7], Cerulein联合LPS腹腔注射,可以导致胰腺在水肿的基础上伴发坏死灶,表现为:胰腺间质水肿、炎细胞浸润及胰腺实质出血、坏死。而单纯使用Cerulein腹腔注射所致模型以胰腺间质水肿为主。我们采用这两种造模方法分别成功复制了MAP和SAP模型。SAP模型的血清淀粉酶、胰腺湿重以及肺组织MPO均显著高于MAP组。另外在造模后2 h、6 h分别取胰腺组织,检测p-STAT3蛋白的表达水平,发现p-STAT3在MAP小鼠胰腺中仅有微量表达,在SAP组表达明显增强,造模后2 h表达最高,至6 h有所降低,提示STAT3在SAP的早期就发生了活化,且与急性胰腺炎的危重演变密切相关。
STAT3属于信号转导与转录激活家族,具有信号转导和转录调控双重功能,是IL-6介导的炎症反应通路中的重要成员,在许多类型的细胞和组织中均表达,研究发现STAT3可以被 JAKs激酶激活成为p-STAT3,STAT3活化的重要指征就是p-STAT3的表达水平[8]。有研究发现[9],在结肠炎的信号通路中,过度生成的IL-6与IL-6受体结合,活化JAK激酶,进而引发下游的信号转录因子STAT3 发生磷酸化并形成二聚体进入细胞核,启动下游相关靶基因如炎性细胞因子的转录和表达。有实验[10]采用Cerulein联合LPS复制小鼠SAP模型,结果发现STAT3在SAP小鼠胰腺中高表达,使用IL-6中和抗体后,STAT3的活化程度可有效降低,胰腺损伤程度亦有所减轻。研究发现[11],SAP大鼠肺组织内p-STAT3 的表达升高同肺组织内IL-1β、IL-6升高水平一致,提示SAP发生时, STAT信号通路被激活,可以增加促炎细胞因子的释放,进一步引发肺损伤。Zhang等采用STAT3基因敲除小鼠复制急性胰腺炎模型[12],发现与野生型小鼠相比,STAT3基因敲除小鼠的胰腺及肺损伤明显减轻,而SOCS3基因敲除的动物由于缺乏对STAT3活化的抑制作用,使得胰腺STAT3过度活化,胰腺和肺的损伤也进一步加重。在大鼠SAP模型早期[13], JAK2、STAT3表达量明显升高,其表达量和炎症因子IL-1β、TNF-α的高表达及胰腺损伤程度呈正相关。本研究结果也证实了MAP组和SAP组小鼠胰腺p-STAT3的活性表达存在明显差异。以上多个实验结果提示胰腺组织中STAT3的活化可能与胰腺炎的病变程度密切相关,但是STAT3在急性胰腺炎危重演变中发挥的具体作用机制需在今后的研究中深入探讨。
[1] Mayer J, Rau B, Gansauge F,etal. Inflammatory mediators in human acute pancreatitis: clinical and pathophysiological implications[J].Gut, 2000, 47(4): 546-552.
[3] 张晓云, 汪东剑, 余维涛. 血清IL-6、IL-8和TNF-α在重症急性胰腺炎早期诊断中的临床意义[J]. 胰腺病学, 2004, 4(1): 26-28.
[4] Atreya R, Mudter J, Finot to S,etal. Blockade of interleukin 6 trans-signaling suppresses T-cell resistance against apoptosis in chronic intestinal inflammation: evidence in crohn disease and experimental colitis in vivo[J].NatMed, 2000, 6(5): 583-588.
[5] 刘君君, 陈 垦, 龙友明, 等. L-精氨酸诱导大鼠急性坏死性胰腺炎模型的建立[J]. 中国药理学通报, 2009, 25(10): 1392-1394.
[6] 林旭红, 李永渝. 急性胰腺炎发病机制及相关治疗的研究进展[J]. 中国病理生理杂志, 2010, 26(5): 1029-1032.
[7] 金 畅, 李继承. 雨蛙素联合脂多糖致小鼠重症急性胰腺炎模型[J]. 中国医学科学院学报, 2002, 24(4): 394-396.
[8] 钟敦王景, 郭 红, 郝 嘉, 等. STAT3对大鼠重症急性胰腺炎血清体外作用AT-II SP-C的影响[J]. 第三军医大学学报, 2008, 30(19): 1807-1809.
[9] Mitsuyama K, Sata M, Rose-John S,etal. Interleukin-6 trans-signaling in inflammatory bowel disease[J].CytokineGrowthFactorRev, 2006,17(6): 451-461.
[10]Chao KC, Chao KF, Chuang CC,etal. Blockade of interleukin 6 accelerate acinar cell apoptosis and attenuates experimental acute pancreatitis in vivo[J].BrJSurg, 2006, 93(3): 332-338.
[11]徐志红, 白永愉, 黄新策, 等. 垂盆草提取物经JAK2/STAT3信号通路途径改善大鼠重症急性胰腺炎肺损伤的研究[J]. 肝胆胰外科杂志, 2014, 26(5): 398-402.
[12]Zhang H, Neuhøfer P, Song L,etal. IL-6 trans-signaling promotes pancreatitis-associated lung injury and lethality[J].JClinInvest, 2013, 123(3): 1019-1031.
[13]李敏利, 许小兵, 王 彬, 等. 促炎因子在实验性重症急性胰腺炎早期对JAK2/STAT3信号通路的影响[J]. 安徽医科大学学报, 2014, 49(10): 1392-1395.
The roles and mechanisms of p-STAT3 signaling pathway in acute pancreatitis
SHI Ying-li1, LIU Fang1, ZHANG Xiao-qin1, JIA Xiao-yun2, LI Tao1, XU Xiao-fan1, ZHANG Hong1△
(1. Medical Research Center, Shanxi University of Chinese Medicine, Xianyang 712046; 2. Department of Pathology, Municipal Hospital of Dunhua City, Dunhua 133700, China)
Objective: To detect the expression of signal transducer and activator of transcription 3 (STAT3) in pancreatic tissue of the mouse model of pancreatitis, and to explore its role in the evolution of acute pancreatitis. Methods: Forty-eight healthy male balb/c mice were randomly divided into 3 groups (n=16): control group (Con) 0.09% NaCl, intraperitoneal injection; mild acute pancreatitis group (MAP) caerulein, intraperitoneal injection; severe acute pancreatitis group (SAP) caerulein plus lipopolysaccharide(LPS), intraperitoneal injection. The mice were sacrificed after 2 h and 6 h after intraperitoneall injection. Serum was isolated for amylase activity. Pancreatic was isolated and weighed to calculate the pancreatic wet weight ratio. Myeloperoxidase (MPO) activity was measured to assess the degree of inflammatory cell infiltration in lung tissue. Using HE staining, the pathological changes of pancreatic and lung were observed under the light microscope. The expression of phosphorylated STAT3 (p-STAT3) was detected by Western blot. Results: Compared with control group, serum amylase activity, pancreatic wet weight ratio and lung MPO activity were significantly increased (P<0.05) in MAP and SAP group at each time point, especially SAP group showed higher levels of MPO activity than that in MAP group (P<0.01). The pathological changes of pancreas and lung were observed after modeling in 2 h. Western blot showed the expression of p-STAT3 could be detected in SAP group, the level increased most significantly after modeling 2 h, and decreased slightly after 6 h. The level of p-STAT3 was low in MAP group and negative in Con group at each time point. Conclusion: The expression of p-STAT3 in MAP and SAP groups are significantly different from that in control group, which indicates that STAT3 is closely related in acute pancreatitis. Inhibition of STAT3 activity is a potential target to alleviate acute pancreatitis progression.
acute pancreatitis; STAT3; histopathology; myeloperoxidase; mouse
陕西省科技厅自然科学基础研究项目(2010JM4023);咸阳市科技局自然科学基金资助项目(2011K13-06(1))
2016-03-01
2016-05-20
R363
A
1000-6834(2016)05-450-04
10.13459/j.cnki.cjap.2016.05.017
△【通讯作者】Tel: 029-38183455; E-mail: zhangh1227@163.com

