中枢神经系统血管外皮细胞瘤的CT与MRI表现
CT and MR Imaging Features of Central Nervous System Hemangiopericytoma
祁佩红1QI Peihong李四保2LI Sibao郑红伟3ZHENG Hongwei吴 珂4WU Ke薛 鹏1XUE Peng陈 勇1CHEN Yong
中枢神经系统血管外皮细胞瘤的CT与MRI表现
CT and MR Imaging Features of Central Nervous System Hemangiopericytoma
祁佩红1QI Peihong
李四保2LI Sibao
郑红伟3ZHENG Hongwei
吴珂4WU Ke
薛鹏1XUE Peng
陈勇1CHEN Yong
【摘要】目的 中枢神经系统血管外皮细胞瘤(HPC)少见,容易误诊,本研究探讨中枢神经系统HPC的CT及MRI影像学特点。资料与方法 回顾性分析经手术病理确诊为HPC的14例患者的CT及MRI资料,分析其影像学特征与病理关系。结果14例患者中,病灶位于颅内12例,椎管内2例。肿块呈分叶状5例,不规则形4例,类圆形或椭圆形5例。CT检查,2例颅内病灶呈稍高密度影,增强扫描后病灶明显强化。MRI T1WI上,11例病灶与白质呈稍短信号;T2WI上,10例与灰质呈等信号;增强扫描后,所有病灶明显不均匀强化,囊变坏死6例,出现血管影9例,与硬脑膜以窄基底相连9例,脑膜尾征4例,邻近颅骨骨质破坏4例。5例行DWI扫描,其中4例呈等信号,1例呈稍高信号。2例颈椎管内病灶密度或信号均匀,增强扫描后较均匀强化,1例周围骨质膨胀性改变。结论 中枢神经系统HPC呈稍高密度,与白质呈等信号的稍短T1信号,与灰质呈等T2信号,病灶内血管影常见,DWI上多呈等信号,易破坏邻近颅骨,脑膜尾征少见。
【关键词】中枢神经系统肿瘤;血管外皮细胞瘤;体层摄影术,螺旋计算机;磁共振成像;病理学,外科
作者单位
1. 郑州人民医院医学影像科 河南郑州450012
2. 郑州大学第三附属医院儿科 河南郑州450052
3. 河南省胸科医院放射科 河南郑州450003
4. 解放军总医院放射科 北京 100853
Department of Medical Imaging, Zhengzhou People's Hospital, Zhengzhou 450012, China
Address Correspondence to: QI Peihong
E-mail:qipeihong01@126.com
R445.3;R445.2
修回日期:2015-10-28
中国医学影像学杂志
2016年 第24卷1期:27-31
中枢神经系统血管外皮细胞瘤(hemangiopericyroma,HPC)少见,约占原发性中枢神经系统肿瘤的0.4%,占脑膜肿瘤的2%~4%[1]。HPC在影像学上与其他脑膜间叶肿瘤不易鉴别,容易误诊,且具有显著的侵袭性并富含血管的特点[2],术中易出血,术后易复发及转移,其治疗方法与其他脑膜间叶肿瘤不同,因此术前正确诊断尤为重要。本研究分析HPC影像学表现与其病理表现的关系,旨在提高术前诊断率。
1 资料与方法
1.1研究对象 回顾性纳入2004年4月—2015年5月郑州人民医院经手术病理证实为HPC的14例患者,其中男9例,女5例;年龄15~65岁,中位年龄43岁;发病部位:颅内12例,颈部2例;临床表现:头痛、头晕、恶心9例,视物模糊2例,鼻出血1例,肢体无力、疼痛不适2例。
1.2仪器与方法 12例颅内HPC患者,其中行CT检查2例, MRI检查12例。2例颈部HPC患者,其中行CT检查1例,MRI检查1例。CT检查采用Philips Briliance 16层螺旋CT机。CT平扫管电压120 kV,管电流250 mA。CT增强扫描采用高压注射器经肘静脉注入碘佛醇(320 mgI/ml),注射剂量1.5 ml/kg,注射速度3.0 ml/s,采用动脉期扫描。MRI检查采用GE Signa 1.5T或3.0T超导MRI扫描仪,平扫行轴位T1WI、T2WI、FLAIR及矢状位T1WI。扫描参数:T1WI TR 500~600 ms,TE 15~17 ms;T2WI TR 3000 ms,TE 129 ms;层厚2.0 mm,层间距0.5 mm;矩阵512×512;视野180 mm×180 mm。MRI增强扫描行轴位、矢状位、冠状位T1WI扫描,经肘静脉注射对比剂钆喷酸葡胺(Gd-DTPA),剂量为0.1 mmol/kg,采用1期动脉期扫描。
1.3图像分析 由2名副主任医师采用盲法分析图像,意见不一致时商量统一。主要评价病灶部位、大小、形态、密度、信号、病灶内血管流空信号、边界、病变强化方式、程度、硬膜尾征、基底宽窄、病变有无坏死等。
1.4手术与病理学检查 8例行肿瘤全切术,4例行肿瘤次全切除术。术后标本采用常规HE染色。免疫组织化学行链霉素抗生素蛋白-过氧化物酶法进行CD34染色、波形蛋白、上皮膜抗原、S-100蛋白染色及网状纤维染色,光镜下观察。
1.5病理诊断标准 中枢神经系统HPC根据其生物学行为分为WHO II级及III级[1]:WHO II级为瘤细胞中等密度,有异型性,核分裂<5个/10 HPF,Ki-67增殖指数<5%,可有灶状坏死;WHO III级为瘤细胞密度较高,异型性明显,核分裂>5个/10 HPF,Ki-67增殖指数<5%~10%,可有大片坏死或伴有出血。
2 结果
2.1病灶部位、大小、形态 14例患者中,病灶位于颅内12例,其中幕上9例,包括额部3例,颞部、枕部、顶部、颞顶枕部、鞍旁、左侧脑室三角区各1例;幕下3例,其中桥小脑角区2例,后颅凹小脑幕旁1例。病灶位于颈部2例,颈椎管内2例,髓外硬膜下、硬膜外各1例。肿瘤长径约2.5~6.5 cm,平均直径为(4.2± 1.2)cm。肿块呈分叶状5例,不规则形4例,类圆形或椭圆形5例。见表1。
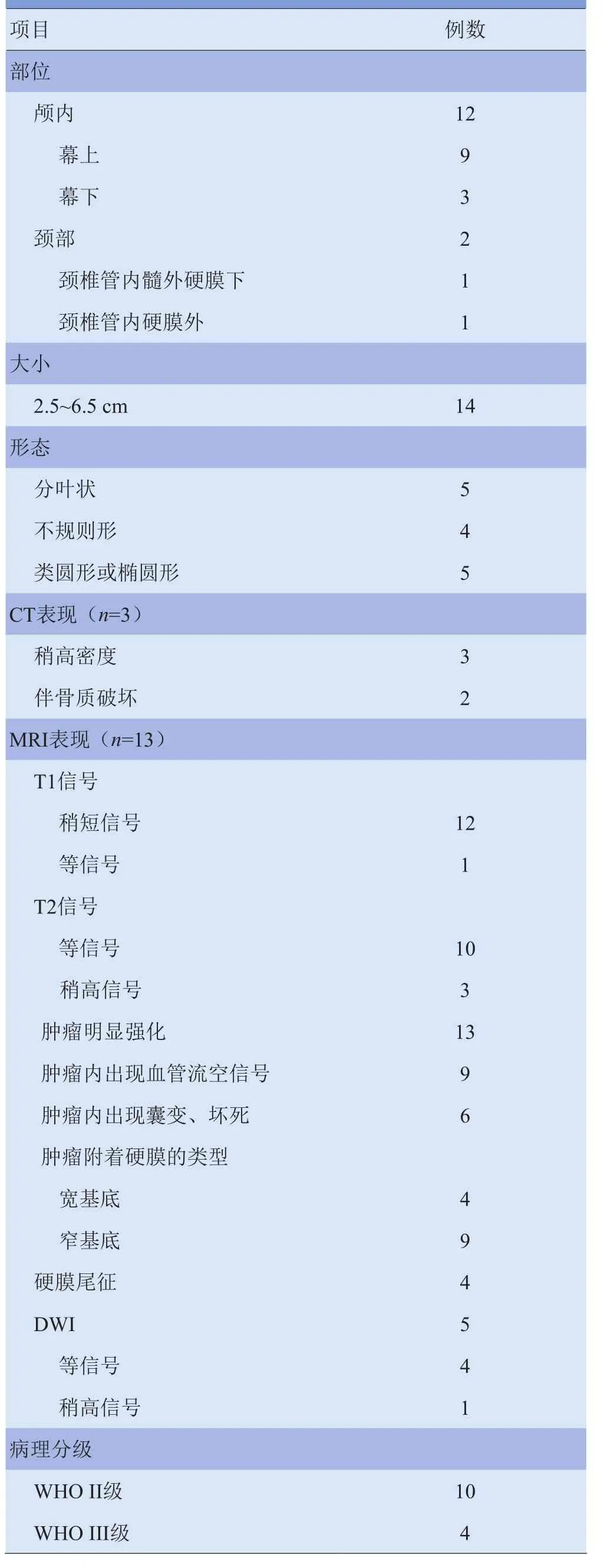
表1 14例HPC患者的CT、MRI与病理表现(例)
2.2CT表现 2例颅内HPC患者CT平扫病灶呈稍高密度(图1A),增强扫描后病灶均匀或不均匀明显强化(图1B)。1例颅内病灶周围见低密度坏死区,邻近颅骨骨质破坏(图1A、B),CTA检查见病灶由颈内外动脉分支供血(图1C)。1例颈部HPC患者CT表现为颈椎管内硬膜外稍高密度影,附件示膨胀性骨质破坏,边界清晰。3例HPC患者CT表现见表1。
2.3MRI表现 12例颅内HPC患者病灶邻近脑组织受压移位,见“脑白质塌陷征”(图1D、图2A),6例肿瘤边缘见假包膜形成。T1WI上,11例与白质呈稍短信号(图1E),1例与灰质呈等信号(图2A);T2WI上,10例与灰质呈等信号(图1D),2例与灰质相比呈稍高信号(图2B)。增强扫描后,所有病灶均明显不均匀强化。9例病灶内部、周边见血管影(图1D、图2B),6例见囊变、坏死区(图1D、E,图2C),1例合并出血。4例灶围无水肿,6例轻度水肿,2例中度水肿。9例与硬脑膜以窄基底相连,3例以宽基底相连,4例见脑膜尾征,4例邻近颅骨骨质破坏(图1A、B、G)。5例DWI扫描,其中4例呈等信号(图1F),1例呈稍高信号;颈部1例,位于颈椎管内髓外硬膜下,以宽基底与硬脊膜相连,呈稍短T1、稍长T2信号(图3A、B),增强扫描后病灶明显均匀强化,相应脊髓受压、前移,以上层面脊髓中央管扩张,邻近颈椎骨质未见破坏(图3C、D)。14例HPC患者MRI表现见表1。
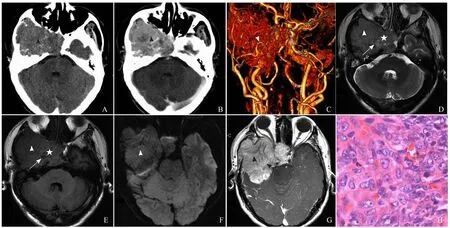
图1 男,49岁,HPC II级。CT平扫示右中颅窝稍高密度肿块,内见稍低密度影,邻近颞叶受压移位,颞骨破坏、海绵窦受侵(箭头,A);增强扫描后病灶实性部分明显强化(箭头,B);CTA示病灶由右侧颈内外动脉分支供血(箭头,C);MRI示病灶与灰质呈等T2信号(箭头,D),与白质呈等信号的稍短T1信号(箭头,E),病灶内见流空血管影(箭)及坏死区(星号,D、E);DWI示病灶呈等信号(箭头,F),增强扫描后不均匀强化(箭头,G),其内见强化血管影(箭,G);病理镜下可见瘤细胞胞质丰富,可见病理性核分裂,其间见裂隙状或鹿角形的薄壁血管影(HE,×400,H)
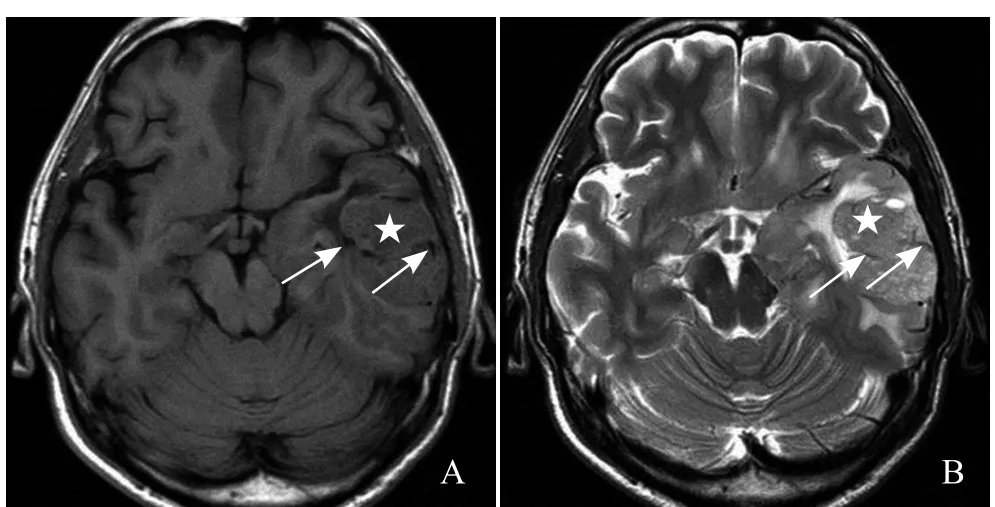
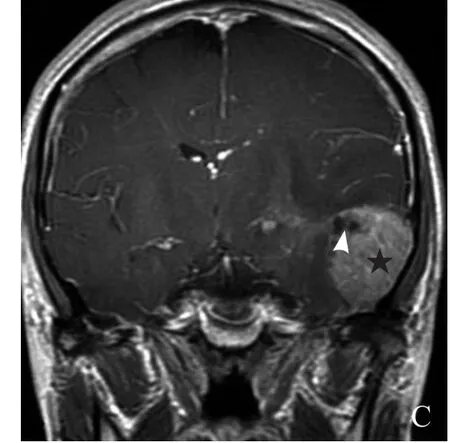
图2 男,39岁,左侧颞部HPC II~III级。病灶T1WI呈等信号(星号,A),T2WI呈稍高信号(星号,B),其内见血管流空信号(箭,A、B);增强扫描后病灶实性成分明显强化(星号),病灶内侧边缘见囊状无强化影(箭头),病灶以宽基底与硬脑膜相连(C)
2.4病理结果 大体病理:病变组织多为灰白色或灰褐色。病理镜下可见瘤细胞弥漫生长,多呈梭形,细胞核中无脑膜瘤特有的核内假包涵体,可见核异型性。瘤内血管丰富,呈鹿角状或裂隙状,内衬偏平内皮细胞,小血管被肿瘤细胞包绕挤压(图1H、图3E),部分区域见片状坏死。免疫组化:波形蛋白阳性14例,CD34阳性或部分阳性14例,S-100蛋白染色、上皮细胞膜抗原均为阴性。网状纤染色可见丰富的网状纤维包绕单个肿瘤细胞及血管。WHO III级4例,WHO II级10例,见表1。
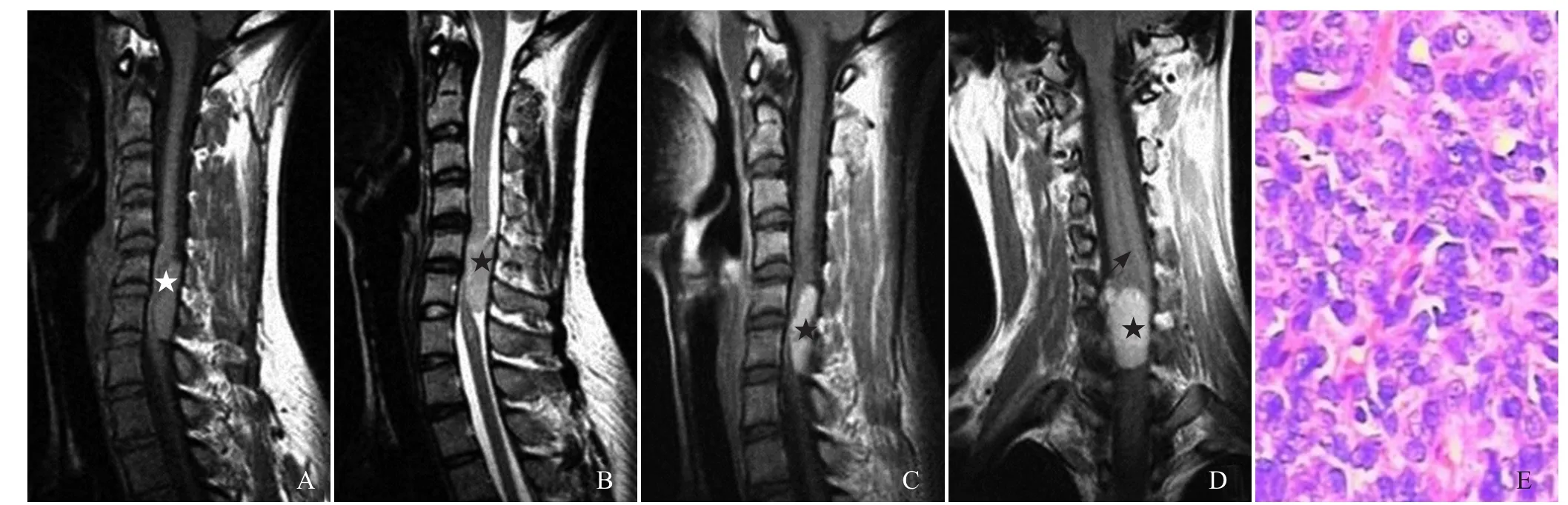
图3 女,29岁,颈椎管内HPC II级。肿瘤呈稍短T1信号(星号,A),稍长T2信号(星号,B),呈宽基底与硬脊膜相连,脊髓明显受压前移;增强扫描后病灶明显强化(星号,C),边界清晰,上层面脊髓中央管扩张(箭,D);病理镜下可见瘤细胞大小、形态较一致,病理性核分裂象多见,有席纹状排列趋势(HE,×200,E)
3 讨论
HPC可发生于全身任何部位,多见于四肢、盆腔及腹膜后,中枢HPC较少见[3]。中枢HPC起源于脑脊膜间质毛细血管周围Zimmerman细胞,是紧贴毛细血管网状纤维的变异平滑肌细胞,非脑膜上皮细胞,具有明显多向分化潜能[4]。2007年WHO将HPC分属于脑膜间质来源的肿瘤,分为WHO II级的HPC和WHO III级的间变型血管周细胞瘤[1]。间变型血管周细胞瘤具有更强的侵袭性,更易复发及转移[5]。
3.1临床及病理特点 颅内HPC发病年龄一般较脑膜瘤小,男性多于女性,平均发病年龄为40~50岁。患者临床缺乏特异性,主要与肿瘤的发生部位有关,头痛是最常见的临床症状。颈部椎管内HPC主要表现为相应节段脊髓受压症状。HPC典型的病理表现为:瘤细胞呈梭形,排列紧密,伴有大量致密的网状纤维和鹿角状血管,可见核分裂象和囊变坏死,无核内假包涵体及钙化。免疫组化显示波形蛋白、CD34阳性或部分阳性,S-100、上皮细胞抗原均为阴性[6],而脑膜瘤波形蛋白表达阴性、上皮细胞膜抗原表达阳性。本组病例临床与病理表现与既往研究[6]结果相似。
3.2影像表现及其病理基础 颅内HPC的影像特点:①发生部位:颅内HPC与脑膜瘤的发生部位类似,好发于颅底、矢状窦或大脑镰旁、小脑幕、髓外硬膜下,鞍旁、脑室为少见发病部位[7],这可能与肿瘤起源于脑脊膜间质有关。本组病例与既往研究[7]结果类似。②肿块形态:颅内HPC肿块多为分叶状、不规则形,与肿瘤血供丰富,生长较快,边缘各部分的肿瘤细胞生长速度不同有关,反映了肿瘤侵袭性生长的特点。③肿块密度及信号特点:肿块CT平扫呈稍高密度,病灶内见小片状坏死区,无钙化,可伴邻近颅骨侵蚀性破坏,无骨质增生,此点与脑膜瘤不同。颅内HPC 的MRI信号与灰质、白质对比观察,病灶多与白质呈等信号的稍短T1信号,与灰质呈等信号的等T2信号。本组11例与白质呈等信号的稍短T1信号,10例与灰质呈等信号的等T2信号,与脑膜瘤多与灰质呈等T1、等T2信号不同,既往文献鲜有报道,这是HPC的特征性表现。颅内HPC信号多混杂,瘤内见较多血管流空信号,强化明显。对照病理与病灶内坏死、出血及瘤内大量裂隙状及鹿角状血管有关,血管流空信号是HPC的特征性表现[8]。陈明等[9]行DSA检查时发现部分HPC由颈内外动脉及基底动脉供血,并且有粗大的引流静脉,肿瘤较小时由硬脑膜动脉供血,肿瘤较大时由邻近脑内动脉双重供血。本组1例颞部HPC患者CTA检查发现病灶由颈内外动脉双重供血,一定程度上反映了HPC血供丰富的特点。④DWI信号特点:Liu等[10]认为HPC在DWI上多呈等信号,其平均最小表观扩散系数与脑膜瘤的平均最小表观扩散系数存在统计学差异,有助于两者的鉴别,同时提出HPC的DWI信号特征可能与肿瘤细胞密度较低和血管丰富有关。本组4例(80%)DWI上呈等信号,与文献[10]报道相符。⑤瘤周水肿情况:本组病例瘤周多为轻中度水肿,而引起瘤周水肿的原因比较复杂,瘤周水肿程度可能与肿瘤生长过程中对静脉窦的压迫、浸润及肿瘤侵犯周围脑组织,血-脑屏障破坏程度有关[11-12];也可能与肿瘤P73蛋白表达程度有关,P73表达阳性率越高,水肿越明显[13]。本组颅内HPC患者仅有2例(14.3%)中度水肿,可能与高级别病例较少有关。⑥脑膜尾征及邻近颅骨情况:少见脑膜尾征、肿块以窄基底与硬脑膜相连是HPC较为特征性表现,可能是因为HPC生长较快,生长时间短,对硬膜的侵袭、刺激未达到形成硬膜尾征的程度[14-15]。8例(66.7%)与硬脑膜以窄基底相连,3例以宽基底相连,4例(30.0%)见脑膜尾征,比陈谦等[14]报道的HPC宽基底出现率(41%)及脑膜尾征出现率(22%)高,但均支持此观点。本组HPC为潜在恶性或恶性肿瘤,周围颅骨可见浸润破坏,无骨质增生硬化性改变,与脑膜瘤易引起邻近颅骨增厚、硬化不同,与既往研究结果一致。
颈部HPC影像特征:本组2例颈部HPC患者肿瘤信号或密度均较均匀,增强扫描后明显强化,瘤内无明确强化血管影或血管流空信号,1例颈椎显示膨胀性骨质破坏,提示颈部HPC与颅内HPC特点不同,信号或密度较均匀,血管影少见,侵润性骨质破坏不明显。既往研究对颈部HPC的影像表现特点描述较少,可能是因为颈部病例数较少,其特点有待大样本病例进一步研究。
3.3鉴别诊断 HPC除与脑膜瘤、脊膜瘤相鉴别外,还应与颅内孤立性纤维瘤相鉴别:HPC男性多见,颅内孤立性纤维瘤中老年女性多见,而颅内孤立性纤维瘤T2WI上以等低信号混杂为主,其内见斑片状、条索状低信号区,与病灶内富含胶原纤维基质有关,囊变坏死及出血少见,增强扫描早期,肿块明显不均匀强化,随时间推移,T1WI上低信号胶原纤维区渐进性明显强化较有特征性[16]。当HPC发生于桥小脑角区时,需与神经鞘瘤鉴别,后者常伴听力障碍,内听道扩大,肿瘤易发生囊变、坏死致病灶不均匀,增强扫描后实质部分强化较明显,但无HPC强化明显。其次还应与颅骨、硬膜来源的淋巴瘤相鉴别,淋巴瘤表现为颅骨两侧等T1等T2信号软组织影,而颅骨本身变化不明显,不伴囊变、坏死。HPC还应与颅骨转移瘤鉴别,原发癌的存在有助于其诊断。
总之,中枢神经系统HPC多为分叶状,内部及周边见明显血管影,多与白质呈等信号的稍短T1信号,与灰质呈等T2信号,DWI上多呈等信号,邻近骨质破坏,增强扫描后肿块不均匀明显强化,脑膜尾征较少见。当遇到与上述表现类似的病例时,应考虑HPC的可能,但确诊仍需依靠病理作为“金标准”。
参考文献
[1]Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classilfication of tumous of the central nervous system. Acta Neuropathol, 2007, 114(2): 97-109.
[2]徐丽艳, 王海宝, 宋文, 等. 颅内血管周细胞瘤MRI表现及病理分析. 中国医学影像技术, 2012, 28(2): 239-242.
[3]Chiechi MV, Smirniotopoulos JG, Mena H. Intracranial neuroradiol MR and CT features. Am J Neuroradiol, 1996, 17(7): 1365-1371.
[4]夏东, 陈燕萍, 唐姗姗. 中枢神经系统血管周细胞瘤的MRI诊断. 放射学实践, 2010, 25(12): 1327-1330.
[5]Veeravagu A, Jiang B, Patil CG, et al. CyberKnife stereotactic radiosurgery for recurrent, metastatic, and residual hemangiopericytomas. J Hematol Oncol, 2011, 4(1): 26.
[6]陈远钦, 吴玲玲, 张锦, 等. 脑膜血管周细胞瘤29例临床病理分析. 临床与实验病理学杂志, 2013, 29(10): 1096-1100.
[7]Shetty PM, Moiyadi AV, Sridhar E. Primary CNS hemangiopericytoma presenting as an intraparenchymal mass--case report and review of literature. Clin Neurol Neurosurg, 2010, 112(3): 261-264.
[8]刘刚. 中枢神经系统血管外皮细胞瘤的影像学特点. 中国医学影像学杂志, 2011, 19(5): 338-340.
[9]陈明, 李凤, 刘春英, 等. 颅内血管周细胞瘤的影像学特征与病理对照研究. 放射学实践, 2014, 29(1): 49-52.
[10]Liu G, Chen ZY, Ma L, et al. Intracranial hemangiopericytoma: MR imaging findings and diagnostic usefulness of minimum ADC values. J Magn Reson Imaging, 2013, 38(5): 1146-1151.
[11]Nassehi D. Intracranial meningiomas, the VEGF-a pathway, and peritumoral brain oedema. Dan Med J, 2013, 60(4): B4626.
[12]张婧, 周俊林, 董驰. 颅内间变型血管外皮细胞瘤的影像与病理对照. 中国医学影像学杂志, 2012, 20(10): 721-724.
[13]董驰, 周俊林. 颅内血管外皮细胞瘤瘤周水肿与P73表达的相关性. 中国医学影像技术, 2009, 25(11): 1980-1983.
[14]陈谦, 戴建平, 高培毅. 颅内血管外皮细胞瘤与脑膜瘤的MR影像对照研究. 中华放射学杂志, 2003, 37(6): 519-524.
[15]高茜, 成官迅, 朱熠, 等. 颅内间变型血管周细胞瘤的MRI诊断. 临床放射学杂志, 2013, 32(2): 172-175.
[16]余水莲, 满育平, 马隆佰, 等. 颅内孤立性纤维瘤的影像表现. 中华放射学杂志, 2012, 46(6): 489-493.
(本文编辑冯 婕)
Chinese Journal of Medical Imaging 2016 Volume 24(1): 27-31
【Abstract】Purpose Central nervous system (CNS) hemangiopericytoma (HPC) is rare in clinic and prone to misdiagnosis. This paper aims to improve the diagnostic accuracy of CNS HPC by analyzing the MRI and CT features.Materials and Methods CT and MRI appearances and pathologic features of 14 cases with surgery and pathology proved CNS HPC were analyzed retrospectively.Results There were intracranial and intraspinal lesions in 12 and 2 cases respectively. 5 cases were lobular, 4 cases irregular, and 5 cases were round or oval in shapes. On CT scan, 2 intracranial lesions showed slight hyperdensity and were avidly enhanced following contrast injection. On T1WI, 11 cases showed isointensity compared with brain white matter; on T2WI, 10 cases showed isointensity compared with brain gray matter. Marked heterogeneous enhancement was shown in 7 cases. Necrosis and cystic changes were seen in 6 cases. Flow-void sign was seen in 9 cases; 9 cases were attached to meninges through narrow base. Dural tail sign was observed in 4 cases. Bone erosion was seen in 4 cases. In 5 cases with DWI scan, isointensity was shown in 4 cases and slight hyperintensity in 1 case. The density and signals in 2 cervical spine lesions were uniform with homogenous enhancement; expansive bone swelling in 1 case.Conclusion CNS HPC shows hyperdensity on CT. They present equal signal compared with white matter on T1WI and equal signal compared with grey matter on T2WI, with some void signal of vessel, and isointense on diffusion weighted images. Tumor invades adjacent skull with rare dural tail sign.
【Key words】Central nervous system neoplasms; Hemangiopericytoma; Tomography, spiral computed; Magnetic resonance imaging; Pathology, surgical
收稿日期:2015-07-28
中图分类号
通讯作者祁佩红
Doi:10.3969/j.issn.1005-5185.2016.01.009

