实时荧光PCR方法快速检测KI多瘤病毒
修文琼,郑奎城,吴冰珊,陈炜,刘光华,康育兰
(1、福建省疾病预防控制中心,福建福州350001;2、福建省人兽共患病研究重点实验室,福建福州350001;3、福建医科大学教学医院福建省妇幼保健院,福建福州350001)
实时荧光PCR方法快速检测KI多瘤病毒
修文琼1,2,郑奎城1,2,吴冰珊1,2,陈炜1,2,刘光华3,康育兰3
(1、福建省疾病预防控制中心,福建福州350001;2、福建省人兽共患病研究重点实验室,福建福州350001;3、福建医科大学教学医院福建省妇幼保健院,福建福州350001)
摘要:目的采用实时荧光PCR方法快速检测KI多瘤病毒(KIPyV),并与巢式PCR扩增法进行比较。方法收集2007 年11月至2015年1月在福州市一家妇幼保健院因呼吸道感染住在儿科重症监护病房(PICU)的259例小儿鼻咽抽取物标本和另两家综合医院146例因严重急性呼吸道感染(SARI)住院的成年患者咽拭子标本,通过实时荧光PCR方法对KIPyV的调节区的基因片段进行检测。结果在小儿鼻咽抽取物标本中检测出3例KIPyV感染阳性病例,检测阳性率约为1.2%,而用巢式PCR扩增法只检测出1例,这例的Ct值较低,约为23,并且扩增曲线呈S型。其它两例的Ct值较高,分别约为33和35。在成年患者咽拭子标本中,用两种方法都未检测出KIPyV感染。在两例Ct值较高的小儿病例中,检测出混合有呼吸道合胞病毒(RSV)感染。结论确立的实时荧光PCR方法可以快速检测KIPyV,且特异性较高。
关键词:KI多瘤病毒;实时荧光PCR;呼吸道感染
多瘤病毒(Polyomaviridae)是含有约5000碱基对的小的无包膜双链DNA病毒,可感染多种鸟类和哺乳动物,易造成机体潜伏感染,具备致癌潜能[1]。2007年之前,人类只认识两种可感染人并引发疾病的多瘤病毒,分别是1971年发现的JCV[2]和BKV[3]。2007年,科学家在人呼吸道和粪便中又发现了两种新的人类多瘤病毒,分别是KI多瘤病毒(KIPyV,Karolinska Institutet Polyomavirus)[4]和WU多瘤病毒(WUPyV,Washington University Polyomavirus)[5]。2008年至今,陆续又发现了6种感染人的多瘤病毒。2008年在人类皮肤发现了Merkel细胞多瘤病毒(MCPyV)[6];2010年在人皮肤上发现了HPyV6、HPyV7[7]及生毛细胞发育异常刺状多瘤病毒(TSPyV)[8];2012年在人血清和皮肤中发现了HPyV9[9],在粪便和皮肤中发现了MWPyV[10,11]。血清学研究表明HPyVs亚临床感染9%~82%的常人[12],当人体免疫系统减弱时才产生疾病。这些新发现的HPyVs引发了人们探讨多瘤病毒与人类疾病和癌症关系的兴趣。原癌转化是由多瘤病毒早期基因编码的蛋白T(tumor,肿瘤)抗原介导的。目前,人们对有关这些多瘤病毒的感染途径、传播和细胞向性知之甚少,对它们在人类癌症中所扮演的角色也有争议。对于KIPyV病毒,我们[13]曾经用经典的巢式PCR方法对200多份重症呼吸道感染患儿的鼻咽抽取物标本进行检测,发现了一株该病毒并进行了全基因组序列测定,这是目前国内唯一一株获得全基因组序列的KIPyV毒株,命名为FZ52,其GenBank序列号为KM085447。由于我们用常规的巢式PCR方法的检出率比较低,只有0.4%,而已知在成年人呼吸道标本中KIPyV感染的检出率约为0.2%~2.7%[14],用实时PCR(realtime PCR,rtPCR)分析技术进行检测的检出率约为2.6%~3.0%[15-17],故需要探索更敏感、快速、特异的方法以便进一步调查KIPyV在人体里是否引起持续的感染,进而阐明其流行病学,致病性及原癌发生的潜力等。
rtPCR分析技术[17]具有提高的敏感性、特异性,不仅快速而且降低了污染风险,同时还可量化病原。在这项研究中,我们在国内率先确立了应用rtPCR技术检测KIPyV的感染。我们从2007年开始采集福州市一家妇幼保健院因呼吸道感染住在儿科重症监护病房(PICU)的259例小儿鼻咽抽取物(NPA,nasopharyngeal aspirates)标本以及146例因重症急性呼吸道感染(SARI)住在综合医院的成年人患者咽拭子标本,用rtPCR方法对KIPyV的调节区的基因片段进行检测,同时也用rtPCR方法检测6种流感病毒,用PCR方法检测其它呼吸道病毒,以了解KIPyV和其它几种常见呼吸道病毒和新病毒在本地区人群中的混合感染状况。
1 材料与方法
1.1标本来源采集2007年11月-2015年1月在福建省妇幼保健院PICU的259例因下呼吸道感染住院患儿(临床诊断为支气管炎、肺炎或毛细支气管炎)的NPA标本以及福建省两家综合医院146例成年SARI患者的咽拭子标本。
1.2仪器与试剂rtPCR反应由ABI 7500 Fast Real-Time PCR System(Applied Biosystems,USA)荧光定量仪完成,在FAM通道进行信号收集;PCR反应由ABI 2720 Thermal Cycler(Applied Biosystems,USA)热循环仪完成。荧光试剂采用德国QIAGEN公司的QuantiFast Probe PCR Kit试剂盒。引物和探针由TaKaRa(大连)有限公司合成。PCR试剂盒购自TaKaRa(大连)有限公司。
1.3检测方法
1.3.1标本处理将采集的NPA标本或咽拭子标本加入3ml左右DMEM采样液中,反复吹打在4℃条件下送达的标本,加入双抗,分装数管,置-70℃保存。
1.3.2病毒DNA的提取提取前将标本冻融两次后,10000g离心15min,吸取上清。采用德国Qiagen公司的QIAamp Viral DNA Mini Kit,按其手册所提供的方法提取病毒DNA。
1.3.3实时荧光PCR检测方法的建立所采用的检测引物是位于调节区域的保守片段,KIPyV的正向引物序列为5'-ACCTGATACCGGCGGAACT-3',反向引物序列为5'-CGCAGGAAGCTGGCTCAC-3';TaqMan探针序列是5'-[FAM]-CCACACAAT AGCTTTCACTCTTGGCGTGA-[TAMRA]-3'[17]。rt-PCR的25μl反应体系含有10pmol的每个引物,4pmol相应的探针,2μl的标本DNA。国外文献的扩增反应参数如下:95℃,15min,随后95℃,15s,60℃,1min,共进行55个循环;我们实验最快的扩增反应参数如下:95℃,3min,随后95℃,3s,60℃,30s,共进行40个循环。
1.3.4常规PCR检测比较常规检测KIPyV病毒的引物序列位于VP1基因片段,用巢式扩增法[4]。第一轮的PCR引物是POLVP1-39F和POLVP1-363R。第二轮的PCR引物是POLVP1-118F和POLVP1-324R,第二轮PCR后的扩增产物为VP1基因的一段,长207bp。
1.3.5混合感染检测对KIPyV检测阳性标本也用rtPCR法对甲、乙型流感病毒进行检测;用PCR法对其它几种呼吸道病毒和新病毒进行检测。
2 结果
2.1实时荧光PCR和常规PCR检测KIPyV病毒比较总共用rtPCR方法检测了PICU的259例NPA标本和因SARI住院的146例成人咽拭子标本。根据国外文献的扩增反应参数,在小儿NPA标本中检测出3例KIPyV感染阳性病例,检测阳性率约为1.2%,而用巢式PCR扩增法只检测出1例,这例用rtPCR法检测的Ct值较低,约为23,且扩增曲线呈S型(图1)。另外2例只能用rtPCR方法在较长和较多的循环条件下检测出,它们的Ct值较高,分别约为33和35(图1)。在成年患者咽拭子标本中,用两种方法都未检测出KIPyV感染阳性病例。根据国外文献的循环反应参数,所有循环反应需要90min多完成,而我们确立的实时荧光PCR方法可以更快速检测KIPyV,所有循环反应只要30min多一点就可以完成(表1),但未能检测到只能用较长循环参数检测到的Ct值较高的2例。而常规巢式PCR则要耗时6h以上。
2.2其它病毒感染情况对这3例用rtPCR检测出的阳性标本也进行了两种常见呼吸道病毒-流感病毒(包括H1、新H1、H3、H7和B型两种)和呼吸道合胞病毒(RSV)及其它几种呼吸道新病毒:如人博卡病毒(HBoV)、人偏肺病毒(hMPV)和WU多瘤病毒(WUPyV)的检测,发现两例Ct值较高的病
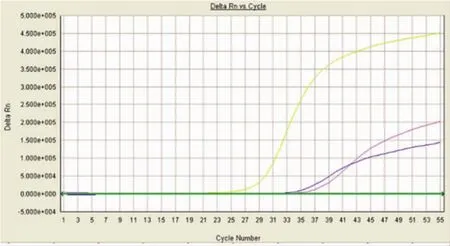
图1 3例KIPyV感染阳性病例的实时荧光PCR扩增曲线例混合感染RSV。
3 讨论
在世界各地的成人呼吸道标本中都有检出KIPyV病毒的感染,但各地报道的检出率不尽相同,这跟检测方法的不同也有一定的关系。在中国,北京[18]的检出率约为0.5%、兰州[19]的检出率约为2.7%、浙江温岭[20]的检出率约为0.04%、在福州用巢式PCR方法[13]的检出率约为0.4%,本文用实时荧光PCR方法的检出率约为1.2%,可见不同检测方法对检出率有较大影响。由于KIPyV的临床意义还不是很清楚,因此需要探索更敏感、特异的检测方法以进行进一步研究。这是国内首次报道用rtPCR方法检测KIPyV病毒。国外有研究表明[17],若用rtPCR方法检测KIPyV,Ct值为33或以上的,则原始标本中的DNA含量低到在常规PCR分析中检测不出来,这在我们的结果中得到了印证。rtPCR检测的下限是每个反应不低于10拷贝的病毒量,相应的NPA的浓度是2×103copies/mL[14]。而常规PCR检测的下限是原始标本中病毒含量不低于100拷贝。应用rtPCR检测,除检测的敏感性较高外,还可定量KIPyV病毒。中等的允许扩增的NPA的浓度是1.8×104copies/mL,最大的允许扩增的NPA的浓度是4.1×105copies/mL[14]。

表1 3种检测方法比较
根据文献,与常规PCR分析相比,rtPCR敏感性是100%,但特异性是94.6%[17],这是因为有假阳性的情况。用我们的只要半个多小时的循环反应条件,检测不出用国外文献多1h检测出的Ct值颇高的两例。是否我们的反应条件更加快速、灵敏而且特异性强,有待进一步分析、比较和研究。由于rtPCR检测出的这些增加的阳性结果有可能反映出了常规PCR的假阴性的结果。常规PCR假阴性的产生可能一是由于其敏感性较低,二是由于目标寡核苷酸序列的改变。结果表明实时荧光PCR提供了敏感快速的检测KIPyV的方法。用这个方法可以对这个病毒的流行性和致病性进行更加深入的研究。
根据文献,KIPyV与其它病毒经常以混合感染的形式存在。在澳大利亚[21]的混合感染率约是25%。在泰国混合感染率约是33.3%[22],因此KIPyV作为独立病原的临床意义还有待进一步研究,它的致病性及与肿瘤的相关性、在自然界的分布及感染途径等都有待进一步研究和阐明。
参考文献
[1]Zur Hausen H.Novel human polyomaviruses--re-emergence of a well known virus family as possible human carcinogens[J].Int J Cancer,2008,123(2):247-50.
[2]Gardner SD,Field AM,Coleman DV,et al.New human papovavirus (B.K.)isolated from urine after renal transplantation[J].Lancet,1971,1(7712):1253-1257.
[3]Padgett BL,Walker DL,ZuRhein GM,et al.Cultivation of papovalike virus from human brain with progressive multifocal leucoencephalopathy[J].Lancet,1971,1(7712):1257-1260.
[4]Allander T,Andreasson K,Gupta S,et al.Identification of a third human polyomavirus[J].JVirol,2007,81(8):4130-4136.
[5]Gaynor AM,Nissen MD,Whiley DM,et al.Identification of a novel polyomavirus from patients with acute respiratory tract infections [J].PLoSPathol,2007,5(3):e64.
[6]Feng H,Shuda M,Chang Y,et al.Clonal integration of a polyomavirus in human Merkel cell carcinoma[J].Science,2008,319(5866):1096-1100.
[7]Schowalter RM,Pastrana DV,Pumphrey KA,et al.Merkel cell polyomavirus and two previously unknown polyomaviruses are chronically shed from human skin[J].Cell Host Microbe,2010,7 (6):509-515.
[8]van der Meijden E,Janssens RW,Lauber C,et al.Discovery of a new human polyomavirus associated with trichodysplasia spinulosa in an immunocompromized patient[J].PLoS Pathog,2010,6(7):e1001024.
[9]Nicol JT,Touze′A,Robinot R,et al.Seroprevalence and cross-reactivity of human polyomavirus 9[J].Emerg Infect Dis,2012,18 (8):1329-1332.
[10]Foulongne V,Sauvage V,Hebert C,et al.Human skin microbiota:high diversity of DNA viruses identified on the human skin by high throughput sequencing[J].PLoSOne,2012,7(6):e38499.
[11]Siebrasse EA,Reyes A,Lim,ES,et al.Identification of MW polyomavirus,a novel polyomavirus in human stool[J].JVirol,2012,86 (19):10321-10326.
[12]Kean JM,Rao S,Wang M,et al.Seroepidemiology of Human Polyomaviruses[J].PLoSPathogens,2009,5(3):1-10.
[13]修文琼,郑奎城,刘光华,等.KI多瘤病毒全基因组序列测定和种系分析[J].中国病毒病杂志,2015,5(2):82-87.
[14]Shinobu T,Miki K,Yasuo T,et al.Detection of KI polyomavirus and WU polyomavirus DNA by real-time polymerase chain reaction in nasopharyngeal swabs and in normal lung and lung adenocarcinoma tissues[J].Microbiol Immunol,2011,55(7):525-530.
[15]Van Der Zalm MM,Rossen JW,Van Ewijk BE,et al.Prevalence and pathogenicity of WU and KI polyomaviruses in children,the Netherlands[J].Emerg Infect Dis,2008,14(11):1787-9.
[16]Hormozdi DJ,Arens MQ,Le BM,et al.KI polyomavirus detected in respiratory tract specimens from patients in St.Louis,Missouri [J].Pediatr Infect Dis J,2010,29(4):329-33.
[17]Bialasiewicz S,Whiley DM,Lambert SB,et al.Development and evaluation of real-time PCR assays for the detection of the newly identified KI and WU polyomaviruses[J].J Clin Virol,2007,40 (11):9-14.
[18]Ren L,Gonzalez R,Xie Z,et al.WU and KIpolyomavirus present in the respiratory tract of children,but not in immunocompetent adults[J].JClin Virol,2008,43(3):330-333.
[19]Yuan XH,Jin Y,Xie ZP,et al.Prevalence of KI and WU polyomavirus in children with acute respiratory tract infection in China [J].JClin Virol,2008,46(10):3522-25.
[20]林峰,郑美云,李桦,等.中国浙江地区儿童下呼吸道感染KI多瘤病毒的鉴定[J].病毒学报,2008,24(4):317-319.
[21]Bialasiewicz S,Whiley DM,Lambert SB,et al.A newly reported human polyomavirus,KIvirus,is present in the respiratory track of Australian children[J].JClin Virol,2007,40(1):15-8.
[22]Payungporn S,Chieochansin T,Thongmee C,et al.Prevalence and molecular characterization of WU/KI polyomaviruses isolated from pediatric patients with respiratory disease in Thailand[J].Virus Res,2008,135(2):230-236.
Rapid identification of KI polyomaviruses in clinical samples by real-time PCR
XIUWenqiong1,2,ZHENG Kuicheng1,2,WU Bingshan1,2,CHEN Wei1,2,LIU Guanghua3,KANG Yulan3.1.Fujian Center for Disease Control and Prevention,Fuzhou 350001,China;2.Fujian Key Laboratory of Zoonoses,Fuzhou 350001,China;3.Fujian Provincial Maternity and Children Health Hospital,Fujian Medical University,Fuzhou 350001,China.
Abstract:Objective To develop sensitive and specific assays for the detection of KIpolyomavirus(KIPyV).Methods In our study,real-time polymerase chain reaction(rtPCR)assayswere developed and compared with nested PCR for detecting KIPyV.Nasopharyngeal aspirates(NPA)were collected from children with respiratory tract disease from Nov.2007 to Jan.2015.Throat swabs were collected from SARI(serious acute respiratory infection)patients from 2013 to 2015.A total of 259 NPA samples and 146 throat swabs were tested for KIPyV using two PCR methods.Results KIPyV infection was detected in 3 NPA samples by rtPCR assay.The positive rate was 1.2%.The Ct value ofwhich was detected by nested PCR was about23 by rtPCR assay.The Ct values of the other 2 sampleswere about 33 and 35,and both of them were not detected by nested PCR.Conclusion RT-PCR is a sensitive and fast detection assay for KIPyV in clinical specimens and useful for further research of this virus.
Key words:KIPyV;rtPCR;Respiration tract infections
(收稿日期2015-07-28;修回日期2016-01-06)
作者简介:修文琼,女,1969年9月生,主任技师,硕士,从事分子病毒学研究。曾作为川医学奖学金制度研究员和特别研究员两度到日本进修各1年。E-mail:wqshiu@live.cn
基金项目:福建省医学创新课题(2011-CX-20)
DOI:10.3969/j.issn.1674-1129.2016.01.004
中图分类号:R446.62,R373.1
文献标识码:A
文章编号:1674-1129(2016)01-0011-04

