急性脑梗死患者血清MCP-1水平的变化
夏英凯, 杜怡峰,韩国哲,张丽,李运刚
(1莱钢医院,济南271100;2 山东省立医院)
急性脑梗死患者血清MCP-1水平的变化
夏英凯1, 杜怡峰2,韩国哲1,张丽1,李运刚1
(1莱钢医院,济南271100;2 山东省立医院)
摘要:目的探讨进展性脑梗死患者血清单核细胞趋化蛋白1(MCP-1)水平的变化趋势。方法 急性脑梗死患者116例,其中进展性脑梗死60例(进展组),非进展性脑梗死56例(非进展组), 另择健康对照者30例作为对照组。于患者入院第1、3、7、14天,采用ELISA法检测各组血清MCP-1水平。结果在第1、3、7、14天,进展组血清MCP-1水平高于其他两组(P均<0.01)。在第1、3、7天,非进展组血清MCP-1高于对照组(P均<0.01)。进展组血清MCP-1水平呈现动态变化趋势,即入院第1天开始升高,至第3天达到峰值,之后逐渐下降。结论 急性进展性脑梗死患者血清MCP-1水平明显升高,且呈现动态变化趋势。
关键词:急性脑梗死;单核细胞趋化蛋白1;进展
在脑血管疾病中,脑梗死约占80%。20%~40%的脑梗死患者在就诊及治疗过程中,会出现临床症状、体征的进展性加重、恶化,临床上称作进展性脑梗死(PCI)。目前已有众多研究表明,炎症反应在脑梗死发生、发展过程中起重要作用。单核细胞趋化蛋白1(MCP-1)是在这个过程中发挥重要作用的因子。本研究观察了进展性脑梗死患者血清中不同时间点的MCP-1水平变化,以评估其在进展性脑梗死诊断和治疗中的价值。
1资料与方法
1.1临床资料选择2010年3月~2013年3月在莱钢医院神经内科住院的首次发病的急性脑梗死患者116例,均符合全国第四届脑血管病学术会议修订的诊断标准,经颅脑CT /MRI 确诊。男66例、女50例,年龄45~72 ( 61.3±10.3)岁;病程均小于24 h。排除:心源性脑栓塞患者;有肿瘤、风湿及自身免疫疾病的患者;近期(四周内)有感染疾病的患者;有严重心脏、肝脏、肾脏疾病的患者;近2周内服用他汀类降脂药、免疫抑制剂或激素等药物的患者。根据临床表现将患者分为进展性脑梗死60例(进展组)、非进展性脑梗死56例(非进展组)。进展性脑梗死患者入选标准:入院48 h内病情仍有加重,美国国立卫生研究院卒中量表评分(NIHSS评分)增加2分或以上;颅脑CT结果证实梗死面积较前增大;排除脑梗死后出血性转化或出现其他新发梗死灶;排除并发症所致的病情加重。进展组男32例、女24例,年龄43~80(66.5±11.4)岁,入院时NIHSS评分为(11.8±6.8)分。非进展组男34例、女26例,年龄49~75(64.6±11.8)岁,NIHSS评分为(12.0±6.9)分。正常对照组:同期本院健康体检者30例,男17例、女13例,年龄45~74(60.4±9.3)岁。既往无脑血管病史,颅脑MRI检查未见异常。3组年龄、性别有可比性。
1.2血清MCP-1水平的检测急性脑梗死患者分别于入院第1、3、7、14天,对照组在查体第1天,禁食12 h后于清晨采空腹静脉血3 mL,用0.109 mol/L的枸橼酸钠作为抗凝剂(1∶10抗凝),把所抽取的血液微微摇匀,在室温下静放1 h后,在分离机里用3 000 r/min的转速离心10 min,取出上层血清置于1.5 mL的测试管里。1份放在-70 ℃的极低温度冰箱里存放待测MCP-1,避免反复冻融。采用ELISA法测定MCP-1水平。
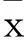
2结果
入院第1、3、7、14天,进展组患者血清中MCP-1水平明显高于其他两组(P均<0.01)。非进展组患者血清中MCP-1在入院第1、3、7天明显升高(P均<0.01)。进展组患者血清MCP-1水平呈现动态变化趋势,即入院第1天开始升高,至第3天达到峰值,之后逐渐下降。详见表1。
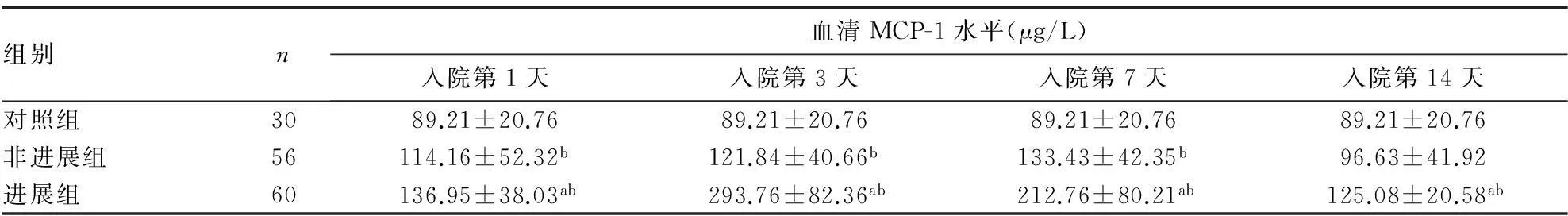
表1 各组患者入院不同时点血清MCP-1水平比较
注:与非进展组比较,aP<0.01;与对照组比较,bP<0.013讨论
进展性脑梗死指脑梗死的患者在发病后48 h内或更长的时间里其神经功能缺失症状逐渐进展或呈阶梯式的加重。大部分进展性脑梗死发生在发病后1 周内[1]。根据欧洲进展性卒中研究组的定义,发病最初 3 d内的为早期进展性卒中,发病第 4~7天的为晚期进展性卒中。
趋化因子是具有趋化作用的一类小分子蛋白质或多肽,是一类重要的生理与病理生理及免疫应答的调节因子,参与机体的多种机能活动。MCP-1是趋化因子CC 类亚家族中的一员,其主要与受体CCR2结合,也可以与CCR1、CCR9、CCR11等受体结合发挥其作用[2]。它的主要生物学作用包括:发生炎症反应时,对单核/巨噬细胞拥有较强的趋化作用,可以诱导其产生IL-1和IL-6,促进黏附分子表达;趋化单核细胞到血管内皮下转化为巨噬细胞,巨噬细胞吞噬脂质尤其是氧化低密度脂蛋白后,转变成泡沫细胞;趋化并启动嗜碱性粒细胞,使其分泌组胺到炎症部位参与免疫调节;参与细胞的生长、代谢及凋亡[3]。
MCP-1对单核/巨噬细胞有较强的趋化作用。在正常情况下脑组织内极少表达MCP-1,但是当脑组织发生缺血的时候,部分细胞如神经元、巨噬细胞、内皮细胞、活化的小胶质细胞及星形胶质细胞等均可能产生MCP-1。然后MCP-1趋化单核/巨噬细胞到达病变脑组织,同时刺激黏附分子表达上调,最终实现参与缺血性脑组织的损伤作用。Hughes等研究显示,当他们建立永久性大鼠大脑中动脉闭塞(MCAO)模型后的6 h,炎症因子在MCP-1基因敲除小鼠的脑组织中表达较少,脑损伤也较轻;在MCAO后24 h,MCP-1基因敲除小鼠的平均脑梗死体积比野生型小鼠小29%[4]。这项研究表明,减少MCP-1的表达有望成为控制卒中后脑梗死体积的一种新型治疗手段。Minami等[5]在小鼠MACO前1 h和再灌注后1 h,他们分别通过侧脑室向其内注入不同剂量的广谱趋化因子拮抗剂vMIP-Ⅱ,结果发现脑梗死体积缩小,而且存在剂量依赖关系。Arakelyan等以40例缺血性脑卒中患者作为研究组,把40例健康受试者作为对照组,以及Reynolds等把223例脑卒中患者(其中82例是急性缺血性脑卒中患者)作为研究组,把214例健康受试者作为对照组,这两项研究结果均发现研究组血清MCP-1的水平高于健康对照组[6,7]。
本研究发现,无论进展性脑梗死还是非进展性脑梗死患者第1天的血清MCP-1水平与未发生血管事件的对照组对比均明显升高,与国内外研究一致。发病第3、7天随着脑梗死病情的进展,进展组患者的症状、体征均较入院第1天加重,NIHSS评分也超过2分,血清中MCP-1水平较非进展组及对照组均有显著升高。第14天时,MCP-1水平降低,但仍高于非进展组与对照组:提示进展性脑梗死患者血清MCP-1水平明显升高,且呈现动态变化趋势。
参考文献:
[1] Hughes PM, Allegrini PR, Rudin M, et al. Monocyte chemoattractant protein-1 deficiency is protective in a murine stroke model[J]. J Cereb Blood Flow Metab, 2002,22(3):308-317.
[2] Murphy PM, Baggiolini M, Charo IF, et al. International union of pharmacology. XXII. Nomenclature for chemokine receptors[J]. Pharmacol Rev, 2000,52(1):145-76.
[3] Hayashidani S, Tsutsui H, Shiomi T, et al. Anti-monocyte chemoattractant protein-1 gene therapy attenuates left ventricular remodeling and failure after experimental myocardial infarction[J]. Circulation, 2003,108(17):2134-2140.
[4] 张苏明,徐广润,韩宗超.血栓形成性脑梗死//王维治.神经病学[M].北京:人民卫生出版社,2006:740.
[5] Minami M, Satoh M. Chemokines and their receptors in the brain: pathophysiological roles in ischemic brain injury[J]. Life Sci, 2003,74(2-3):321-327.
[6] Arakelyan A, Petrkova J, Hermanova Z, et al. Serum Levels of the MCP-1 Chemokine in Patients With Ischemic Stroke and Myocardial Infarction[J]. Mediators of Inflammation, 2005,2005(3):175-179.
[7] Reynolds MA, Kirchick HJ, Dahlen JR, et al. Early biomarkers of stroke[J]. Clin Chem, 2003,49(10):1733-1739.
(收稿日期:2015-06-20)
中图分类号:R743.3
文献标志码:B
文章编号:1002-266X(2016)01-0079-02
doi:10.3969/j.issn.1002-266X.2016.01.030

