手性促进剂芳樟醇对萘普生经皮渗透的促透效果
郭 霞,荣 毅,张 亮,叶金翠
浙江省医学科学院药物研究所制剂室,杭州 310013
·论著·
手性促进剂芳樟醇对萘普生经皮渗透的促透效果
郭霞,荣毅,张亮,叶金翠
浙江省医学科学院药物研究所制剂室,杭州 310013
摘要:目的研究dl-芳樟醇、d-芳樟醇、l-芳樟醇对模型药物经离体大鼠皮肤渗透促透效果的差异及芳樟醇对角质层类脂神经酰胺的作用。方法采用Valia-Chien双室渗透池进行离体皮肤渗透实验,手性固定相HPLC法测定皮肤渗透液中药物含量,红外光谱法考察芳樟醇对角质层类脂特征吸收峰峰位的影响。结果加入1%dl-芳樟醇、1%d-芳樟醇、1%l-芳樟醇时的稳态渗透速率分别为(2.47±0.63)、 (1.53±0.54)、 (1.73±0.48)μg·cm-2·h-1,分别是对照组[(0.99±0.42)μg·cm-2·h-1]的2.49、1.55、1.75倍,与对照组相比差异均有统计学意义(P均<0.05)。dl-芳樟醇对萘普生的促透作用显著大于d-芳樟醇和l-芳樟醇(P均<0.05)。与未经芳樟醇处理的角质层相比,经dl-芳樟醇处理过的角质层在亚甲基不对称振动吸收峰位上向高波数移动2.09 cm-1,而经d-芳樟醇和l-芳樟醇处理的角质层在波数上无变化。结论不同构型的芳樟醇对同一药物促透效果的差异与其对角质层脂质神经酰胺的扰乱程度有关。
关键词:芳樟醇;萘普生;手性促进剂;经皮给药
ActaAcadMedSin,2016,38(1):55-61
经皮给药系统(transdermal drug delivery system,TDDS)系指药物以一定速率透过完整皮肤,到达皮下组织或经毛细血管吸收进入体循环而发挥局部或全身疗效的缓控释给药系统,已成为重要的给药途径,但由于角质层的屏障作用,只有极少数活性强、理化性质适中的药物可能开发成经皮给药制剂。化学促进剂法是目前主要采用的药物经皮促透法,化学促进剂的开发、应用及其机制研究对TDDS的发展具有重要意义。
萜烯类经皮渗透促进剂主要从天然植物中提取,具有促透效果强、毒性低、对皮肤刺激性小[1]等优点,一般具有手性中心,其主要促透机制为扰乱脂质的结构,促进脂质流动,产生新的渗透通道[2- 3]。芳樟醇是一种典型的萜烯类手性促进剂,能促进拉莫三嗪[4]、叠氮胸苷[5]、缬沙坦[6]等药物的经皮渗透。因芳樟醇结构中存在一个手性中心,故分为d-和l-两个对映异构体。不同构型的芳樟醇物理性质基本相同,只是由于结晶结构的差异,手性化合物单对映体可能拥有不同于消旋体的熔点。药物经皮渗透的主要屏障是角质层,其主要由手性物质角蛋白和神经酰胺组成(角质层细胞间类脂中神经酰胺所占比例>50%),制剂处方中的手性辅料(如手性促进剂)可能与皮肤中的手性物质产生对映体选择性相互作用[7],进而引起手性促透剂的对映体选择性促透作用。因此,皮肤的手性环境可能会引起不同构型芳樟醇对相同药物促透效果的差异。所以,有必要研究手性促透剂的构型对药物的促透效果差异及其产生机制,以期为更好地开发利用手性促透剂提供理论指导。
萘普生(naproxen,NP)属于2-芳基丙酸类非甾体抗炎药,主要用于治疗风湿性和类风湿性关节炎、痛风等引起的疼痛等症状。NP对关节炎及其他各种炎症所致疼痛的治疗是通过抑制炎症局部前列腺素合成和释放来缓解炎症反应,因此通过皮肤给药能提高其在患处局部的疗效,并减少全身不良反应。据文献报道,月桂氮卓酮、二乙醇乙基醚和磷脂等能促进NP的经皮吸收[8- 9]。本研究以NP的消旋体(RS-NP)作为模型药物,评估了不同构型手性促进剂芳樟醇对其经离体大鼠皮肤渗透促透效果的差异,以及对于同为手性药物的模型药物NP是否具有对映体选择性促透作用,并通过衰减全反射-傅里叶变换红外光谱法(attenuated total reflection-Fourier transform infrared spectroscopy,ATR-FTIR)检测经dl-芳樟醇、d-芳樟醇和l-芳樟醇分别处理的皮肤角质层亚甲基伸缩振动吸收峰峰位的变化,来探究对映体选择促透与角质层手性类脂神经酰胺的相关性。ATR-FTIR能测定角质层中分子的振动,已有研究对每个振动峰的来源进行了归属[10]。因此,可以通过ATR-FTIR的检测来观察角质层结构微小的变化,研究芳樟醇的对映体选择性促透差异与其对角质层类脂神经酰胺作用的相关性,从而探讨手性促透剂的对映体选择性促透作用机制。
材料和方法
材料Agilent 1260 Infinity高效液相色谱仪(美国Agilent公司,含G1311B四元泵,G1316A柱温箱,G1329B自动进样器,G1314F VWD紫外检测器),Valia-Chien透皮扩散仪(S=0.65 cm2,V=4 ml,浙江大学玻璃仪器厂),Mettler Toledo XS205DU型电子分析天平(梅特勒托利多,瑞士),Bruker Vector 22 FT-IR光谱仪(德国Bruker公司),电动剃须刀(科德士宠物用电推剪 CP- 8000,飞科电动剃须刀 FS620);dl-芳樟醇、l-芳樟醇(美国Sigma-Aldrich公司),S-NP(江苏八巨药业有限公司),d-芳樟醇(福建三明列香料厂),PEG- 400(上海浦东高南化工厂),甲醇(德国Merck公司,色谱纯),氯仿(汕头市西陇化工厂有限公司),冰乙酸(成都市科龙化工试剂厂),0.25%胰蛋白酶(杭州吉诺生物技术有限公司);水为纯化水,其余所使用分析试剂均为分析纯。
标准液的配制精密称取25 mg RS-NP至25 ml容量瓶中,甲醇定容至刻度,配制成1.0 mg·ml-1的贮备液,储存于冰箱中(4℃)备用,使用前恢复至室温。
供给液的配制由于RS-NP在水中的溶解度较小,因此改用无水乙醇-水(2∶8,v/v)作为供给液溶剂,精密称取一定量的RS-NP配制成浓度为0.1 mg·ml-1的供给液供皮肤渗透实验。
实验大鼠及其皮肤处理健康雌性SD大鼠(浙江省实验动物中心),体重(280±10)g,动物合格证编号为SYXK(浙) 2011- 0166。大鼠颈部脱臼法处死后立即用电动剃刀剃去背部皮肤毛发,背部皮肤去除皮下脂肪组织后用生理盐水洗净,滤纸吸干,剪成2.0 cm × 2.0 cm大小,用铝箔包封,于-20℃冰箱冻存备用,操作过程避免损伤角质层。
供FTIR检测角质层的制备将离体大鼠背部皮肤放入0.25%胰蛋白酶溶液中,37℃消化24 h[11],用棉签分离出角质层,超纯水洗净滤纸吸干后,分别浸泡于含1%手性促透剂(dl-、d-、l-芳樟醇)的无水乙醇-水(2∶8,v/v)皮肤渗透供给液中和不含芳樟醇的无水乙醇-水(2∶8,v/v)供给液中,以匀速500 r·min-1(r=4 mm),在32℃水浴中搅拌6 h后,用超纯水洗净,滤纸吸干,置于真空干燥器中供检测。
离体皮肤渗透实验将离体大鼠皮肤从-20℃冰箱冷冻处取出,恢复室温后,在生理盐水中浸泡30 min,滤纸吸干,置Valia-Chien双室渗透池两个池口之间,角质层面向供给室,两个池口对准并用夹子固定,每个池内加入搅拌子,在供给室中分别加入4 ml RS-NP供给液(n=5),接收室加入4 ml接收液(含40% PEG- 400的生理盐水),循环水浴恒温(32℃),磁力搅拌转速为500 r·min-1(r=4 mm)。在规定时间(4、6、8、10、12 h)从接收池取样0.5 ml,及时加入等量同温度的空白接收液。样品置于4℃冰箱冷藏保存,采用HPLC测定接收液药物含量。
不同构型芳樟醇对NP离体皮肤促透实验向以无水乙醇-水(2∶8,v/v)为溶剂的RS-NP溶液中(药物浓度为0.1 mg·ml-1)分别加入1%dl-芳樟醇、d-芳樟醇或l-芳樟醇作为供给液,其余步骤同离体皮肤渗透实验操作。
ATR-FTIR测定IR光谱检测采用配备有ATR附件的Bruker Vector 22 FT-IR光谱仪,在4000 cm-1~600 cm-1的波数下采集,分辨率为4 cm-1。将完整角质层、经不同构型芳樟醇处理的角质层样品分别进行ATR-FTIR检测,每个样品平行做3份。
皮肤渗透液中的药物浓度检测模型药物为手性药物NP的消旋体,以手性固定相高效液相色谱法检测皮肤渗透液中的药物对映体,考察芳樟醇是否引起手性药物的对映体选择性经皮渗透。色谱柱:Chiralpak AD-RH(150 × 4.6 mm,5 μm);保护柱:Chiralpak AD-RH(10 × 4.0 mm,5 μm);流动相:0.05%三氟乙酸水溶液-乙腈(60∶40,v/v);流速:0.6 ml·min-1;进样量:20 μl;柱温:30℃;检测波长:232 nm。
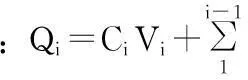
结果
分析方法学验证
专属性:将大鼠皮肤置于空白接收液即40% PEG-生理盐水中浸泡24 h,接收液采用0.22 μm滤膜过滤,按照皮肤渗透液中的药物浓度检测项下的色谱条件进样,结果表明,经皮渗透空白接收液对NP对映体的检测无干扰(图1)。
线性关系:以皮肤渗透空白接收液作为溶剂,将1 mg·ml-1RS-NP的标准储备液稀释成200、100、50、25、10、5、3和1 μg·ml-1的系列溶液,构建标准曲线。以对映体峰面积(A)对其浓度(C)进行线性回归,回归方程分别为R-NP:A=530.3C+430.6(r=0.9996),S-NP:A=540.9C+354.0(r=0.9997)(图2)。
检测限与定量限:采用信噪比法,检测限(limit of detection,LOD)和定量限(limit of quantification,LOQ)分别根据基线噪音的3倍和10倍进行测定。LOD为0.005 μg·ml-1(S/N=3),LOQ为0.02 μg·ml-1(S/N=10),LOQ检测相对标准偏差为5.67%(n=5)。
精密度:通过配制高、中、低3个不同浓度的RS-NP溶液进行研究,每个浓度平行配制3份,按皮肤渗透液中的药物浓度检测项下的色谱条件,每份测定3次。1、50、200 μg·ml-1浓度下R-NP峰面积的RSD分别为1.79%、0.54%、0.19%,S-NP峰面积的RSD分别为1.43%、0.57%、0.35%。
回收率:通过在空白接收液中加入已知量的RS-NP,配制成3种不同浓度的溶液,每个浓度平行配制3份,按皮肤渗透液中的药物浓度检测项下的色谱条件每份测定3次,计算药物质量,以测得质量除以加入的已知质量,再乘以100%得加样回收率,结果显示3个浓度的NP对映体回收率在98.7%~100.9%间(表1)。

NP:萘普生
NP:naproxen
A. 大鼠皮肤浸泡空白接收液;B. RS-NP对照品溶液;C. RS-NP经皮渗透样品溶液
A.blank receptor solution soaking mouse skin;B. reference substance solution of RS-NP;C. sample solution of RS-NP in transdermal permeation studies
图1NP对映体分离的HPLC色谱图
Fig1HPLC of NP enantiomers

A.R-NP;B.S-NP
图2NP线性关系图
Fig2The linear relationship of NP
m:质量;RSD:相对标准偏差
m:mass;RSD:relative standard deviation
不同构型的芳樟醇对NP促透效果的差异当供给溶剂中加入1%dl-芳樟醇、1%d-芳樟醇、1%l-芳樟醇时NP的渗透速率分别为(2.47±0.63)、(1.53±0.54)、(1.73±0.48)μg·cm-2·h-1,分别是对照组[(0.99±0.42)μg·cm-2·h-1]的2.49、1.55、1.75倍,与对照组相比差异均有统计学意义(P均<0.05)。dl-芳樟醇对RS-NP的促透作用显著大于d-芳樟醇和l-芳樟醇(P均<0.05)(图3),d-芳樟醇和l-芳樟醇间差异无统计学意义(P>0.05)。对皮肤渗透液即接收液中的药物RS-NP进行手性拆分,结果表明R-NP与S-NP的渗透速率差异无统计学意义(P>0.05)。
ATR-FTIR检测结果在 32℃条件下,对照组,经1%dl-芳樟醇、1%d-芳樟醇、1%l-芳樟醇处理后的角质层皮肤的亚甲基对称和不对称振动吸收峰位移分别为(2850.2721±0.0000)和(2918.4147±0.0000)cm-1、(2850.2721±0.0000)和(2920.5074± 0.0000)cm-1、(2850.2721±0.0000)和(2918.4147±0.0000)cm-1、(2850.2721±0.0000)和(2918.4147±0.0000)cm-1。与未经芳樟醇处理的角质层相比,经dl-芳樟醇处理过的角质层在亚甲基不对称振动吸收峰位上向高波数移动2.09 cm-1,而经d-芳樟醇和l-芳樟醇处理的角质层在波数上无变化(图5)。
讨论
皮肤的角质层主要由手性物质角蛋白和神经酰胺组成,潜在为药物皮肤渗透提供了一个手性环境[11]。据文献报道,皮肤角质层的红外光谱图中亚甲基伸缩振动吸收峰峰位的变化与细胞间脂质的无序排列程度有关,在促进剂作用下,细胞间脂质排列被打乱,亚甲基伸缩振动吸收峰向高波数移动,药物透过量提高[12- 13],并且峰位移动越大,促进剂扰乱角质层脂质有序排列的作用越强。因此,本研究评估了不同构型的芳樟醇对角质层脂质特征吸收峰位移变化的影响,以期为不同构型芳樟醇对相同药物的促透效果差异提供理论支持。ATR-FTIR检测结果显示,经dl-芳樟醇处理过的角质层在亚甲基不对称振动吸收峰位上与对照组相比向高波数移动2.09 cm-1,而经d-芳樟醇和l-芳樟醇处理的角质层则无变化,与本课题组以往研究结果相一致[3],即不同构型芳樟醇对角质层脂质的扰乱程度不同,体现为对相同药物的促透作用差异,与本研究离体皮肤渗透结果一致,即dl-芳樟醇对RS-NP的促透作用显著大于d-芳樟醇和l-芳樟醇。此外,本研究对皮肤渗透液即接收液中的药物RS-NP进行手性拆分,结果显示,R-NP与S-NP的渗透速率没有显著性差异,表明芳樟醇对同为手性的模型药物RS-NP没有对映体选择性促透作用。

图3RS-NP离体皮肤渗透实验累积渗透量-时间曲线
Fig3Permeation profiles of RS-NP across excised rat skin from donor vehicles
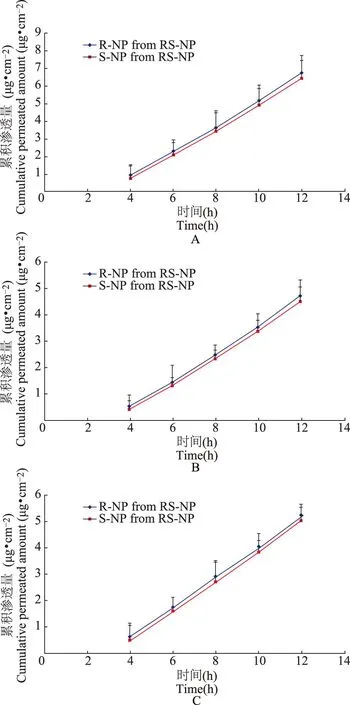
图4RS-NP中R-NP和S-NP在含1%dl-芳樟醇(A)、1%d-芳樟醇(B)和1%l-芳樟醇(C)供给液中经离体大鼠皮肤累积渗透量-时间曲线
Fig4Permeation profiles of R-NP and S-NP across excised rat skin from donor solutions containing RS-NP with 1%dl-linalool(A),1%d-linalool(B),or 1%l-linalool(C)
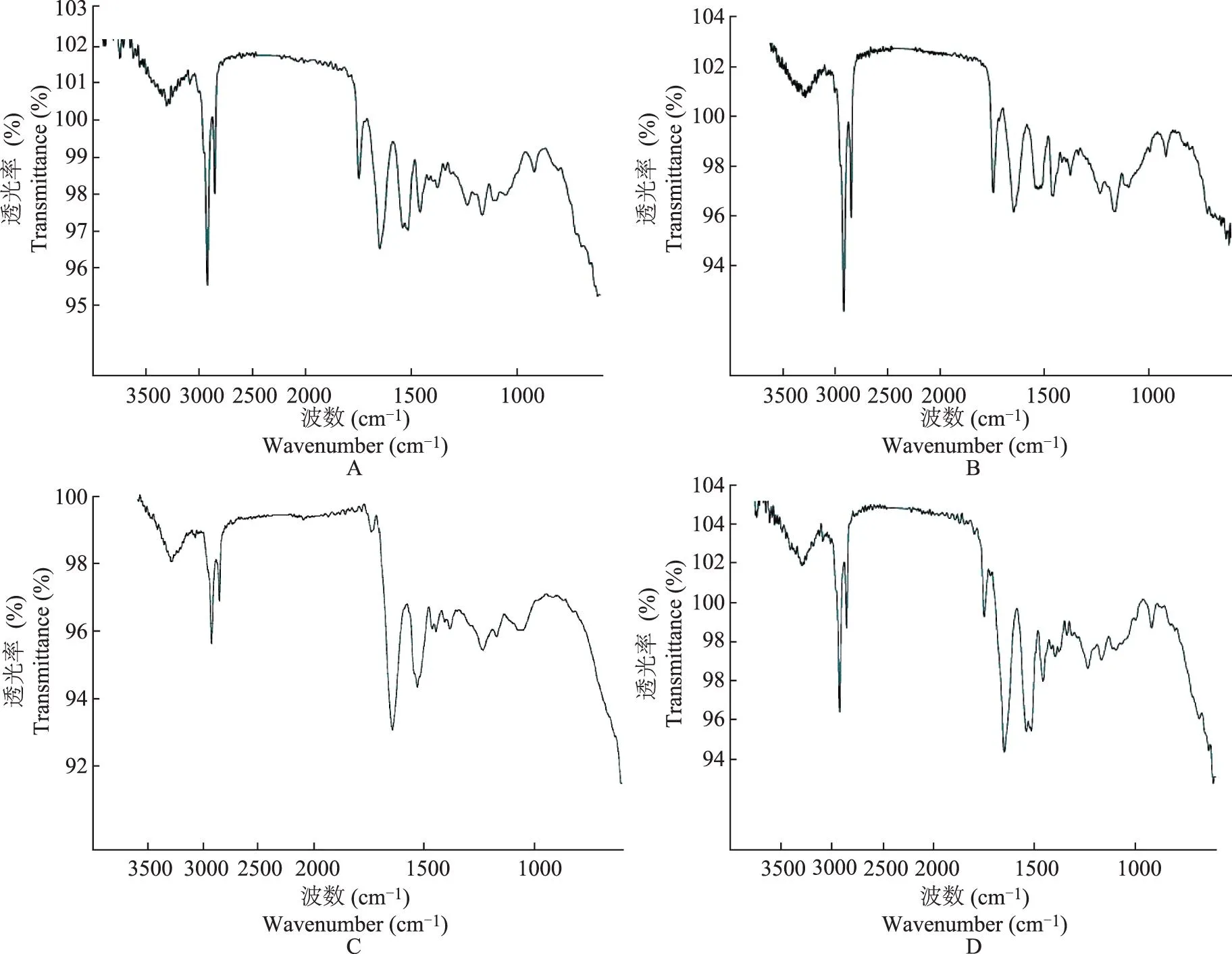
A.对照组;B.经dl-芳樟醇处理的角质层;C.经d-芳樟醇处理的角质层;D.经l-芳樟醇处理的角质层
A.control group;B.stratum corneum treated withdl-linalool;C.stratum corneum treated withd-linalool;D.stratum corneum treated withl-linalool
图5角质层经不同构型芳樟醇处理后红外光谱图
Fig5The infrared spectrum of the rat stratum corneum
药物经皮渗透的主要屏障角质层主要由手性物质神经酰胺和角蛋白组成,而角质层细胞间类脂中神经酰胺所占比例大于50%[14],对维持角质层屏障结构起着重要作用。芳樟醇的促透机制是提取和打乱角质层类脂[15],本课题组以往研究也证实了这一点[3]。在神经酰胺极性头部分有多个手性中心,是潜在的对映体选择性作用位点,可与外来手性物质产生对映体选择性相互作用。例如,Heard等[16]已证实了神经酰胺与麻黄素存在对映体选择性结合,本课题组也报道了dl-芳樟醇对消旋十八甲基炔诺的对映体选择性促透作用,以及这种作用与角质层类脂(神经酰胺)的相关性。本研究并未观察到芳樟醇对模型药物RS-NP的对映体选择性促透作用,而dl-芳樟醇对角质层脂质的扰乱程度不同于d-芳樟醇和l-芳樟醇,对RS-NP的促透作用更显著,这种作用产生的机制并不清楚。后续需要开展更深入的研究探讨手性药物与手性促进剂、皮肤手性物质间的对映体选择性相互作用及其影响因素。
参考文献
[1]Ahad A,Aqil M,Ali A. Investigation of antihypertensive activity of carbopol valsartan transdermal gel containing 1,8-cineole[J]. Int J Biol Macromol,2014,64(3):144- 149.
[2]Sapra B,Jain S,Tiwary A. Percutaneous permeation enhancement by terpenes:mechanistic view[J]. AAPS J,2008,10(1):120- 132.
[3]荣毅,俞文英,郭霞,等. 芳樟醇对十八烷基炔诺酮经皮渗透对映体选择性的影响[J].药学学报,2014,49(8):1175- 1180.
[4]Lakshmi P,Mounika K,Saroja C.Transdermal permeation enhancement of lamotrigine using terpenes[J]. J Pharma Care Health Sys,2014,1(103):2- 7.
[5]Kararli TT,Kirchhoff CF,Penzotti Jr SC. Enhancement of transdermal transport of azidothymidine(AZT) with novel terpene and terpene-like enhancers:invivo-invitrocorrelations[J]. J Control Release,1995,34(1):43- 51.
[6]Rizwan M,Aqil M,Ahad A,et al. Transdermal delivery of valsartan:I. Effect of various terpenes[J]. Drug Dev Ind Pharm,2008,34(6):618- 626.
[7]Vávrová K,Hrabálek A,Doležal P. Enhancement effects of(R) and(S) enantiomers and the racemate of a model enhancer on permeation of theophylline through human skin[J]. Arch Dermatol Res,2002,294(8):383- 385.
[8]Escobar-Chávez JJ,Quintanar-Guerrero D,Ganem-Quintanar A.Invivoskin permeation of sodium naproxen formulated in pluronic F- 127 gels:effect of Azone®and Transcutol®[J]. Drug Dev Ind Pharm,2005,31(4- 5):447- 454.
[9]Valjakka-Koskela R,Kirjavainen M,Mönkkönen J,et al. Enhancement of percutaneous absorption of naproxen by phospholipids[J]. Intern J Pharmaceutics,1998,175(2):225- 230.
[10]Boncheva M,Damien F,Normand V. Molecular organization of the lipid matrix in intact Stratum corneum using ATR-FTIR spectroscopy[J]. BBA-Biomembranes,2008,1778(5):1344- 1355.
[11]Reddy I,Kommuru TR,Zaghloul A-AA,et al. Chirality and its implications in transdermal drug development[J]. Crit Rev Ther Drug,2000,17(4):285- 325.
[12]Takahashi K,Sakano H,Yoshida M,et al. Characterization of the influence of polyol fatty acid esters on the permeation of diclofenac through rat skin[J]. J Control Release,2001,73(2):351- 358.
[13]Bhatia KS,Singh J. Mechanism of transport enhancement of LHRH through porcine epidermis by terpenes and iontophoresis:permeability and lipid extraction studies[J]. Pharm Res,1998,15(12):1857- 1862.
[14]Kessner D,Ruettinger A,Kiselev MA,et al. Properties of ceramides and their impact on the stratum corneum structure[J]. Skin Pharmacol Physiol,2008,21(2):58- 74.
[15]Vaddi HK,Ho PC,Chan YW,et al. Terpenes in ethanol:haloperidol permeation and partition through human skin and stratum corneum changes[J]. J Control Release,2002,81(1):121- 133.
[16]Heard CM,Brain KR. Does solute stereochemistry influence percutaneous penetration[J]. Chirality,1995,7(4):305- 309.
Enhancing Effect of Chiral Enhancer Linalool on Skin Permeation of Naproxen
GUO Xia,RONG Yi,ZHANG Liang,YE Jin-cui
Department of Pharmaceutics,Institute of Materia Medica,Zhejiang Academy of Medical Sciences,Hangzhou 310013,China Corresponding author:YE Jin-cuiTel:0571- 88215573,E-mail:yejincui@163.com
ABSTRACT:ObjectiveTo investigate the permeation-enhancing effect of dl-linalool,d-linalool,and l-linalool on model drugs across excised rat skin and the effect of linalool on the ceramides in stratum corneum lipids. MethodsIn vitro skin permeation studies were performed with Valia-Chien diffusion cells,and the permeation samples were analyzed by high performance liquid chromatography with chiral stationary phase. Infrared spectroscopy was used to investigate the effect of linalool on stratum corneum lipids. ResultsWhen the donor vehicles added with 1% dl-linalool,1% d-linalool,or 1% l-linalool,the steady-state skin permeation rate of naproxen was(2.47±0.63),(1.53±0.54),(1.73±0.48) μg·cm-2·h-1,respectively,which is 2.49,1.55,and 1.75 times(all P<0.05) compared with control group [(0.99±0.42)μg·cm-2·h-1],and the differences were statistically significant(all P<0.05). The permeation-enhancing effect of dl-linalool on naproxen was found significantly greater than that of d-linalool and l-linalool(both P<0.05). Compared with the control group,the stratum corneum treated with dl-linalool shifted to higher wave number on 2.09 cm-1of asymmetric CH2stretching vibrations in attenuated total reflection-fourier transform infrared spectroscopy analysis. However,stratum corneum treated with d-linalool and l-linalool did not display this phenomenon. ConclusionThe disturbing degree of dl-linalool on stratum corneum lipids(ceramides) is different from that of linalool enantiomers,suggesting their different enhancing effect on the same drug.
Key words:linalool;naproxen;chiral enhancer;transdermal drug delivery
(收稿日期:2015- 03- 23)
DOI:10.3881/j.issn.1000- 503X.2016.01.010
中图分类号:R94
文献标志码:A
文章编号:1000- 503X(2016)01- 0055- 07
通信作者:叶金翠电话:0571- 88215573,电子邮件:yejincui@163.com
基金项目:国家自然科学基金(30901871)、浙江省科技厅项目(2014F10034)、省部共建项目(201231507)和浙江省卫生高层次创新人才培养工程项目Supported by the National Natural Sciences Foundation of China(30901871),Zhejiang Provincial Science and Technology Fund of China(2014F10034),Zhejiang Provincial Joint Construction Project(201231507),and Zhejiang Provincial Program for the Cultivation of High-level Innovative Health Talents

