基于过氧化物同工酶分析月季种质资源的亲缘关系及杂种真实性
刘承源,王 辉,邱文昌,何亨辉,方炎明
( 1.南京林业大学南方现代林业协同创新中心生物学与环境学院,南京210037; 2.深圳市公园管理中心园艺推广部,广东深圳518040 )
基于过氧化物同工酶分析月季种质资源的亲缘关系及杂种真实性
刘承源1,2,王辉2,邱文昌2,何亨辉2,方炎明1*
( 1.南京林业大学南方现代林业协同创新中心生物学与环境学院,南京210037; 2.深圳市公园管理中心园艺推广部,广东深圳518040 )
摘要:为了提高种质资源利用率,加速月季育种进程,对27份月季种质及3个杂交组合的8个杂交后代,采用过氧化物酶( POD)同工酶方法分析其亲缘关系并进行杂种真实性鉴定。结果表明:月季种质采用POD同工酶分析具有一定的可行性。酶谱分析中,在相对迁移率为0.264~0.858的位点处共获得7条酶带,其中共有酶带3条,特征酶带4条,表明不同月季种质间遗传多样性丰富,但又存在一定同源性。基于酶带特征进行聚类分析,在相似系数为0.57处,可将27份供试材料分为3个大组。合柱组与月季组材料聚在一个大组中,两个组在形态上的相似性再次得到确认。金樱子与硕苞蔷薇分别聚在两个不同的组中,表明二者之间的亲缘关系较远。供试的古老月季品种被聚在两个不同的大组中,与野生种聚成的一组呈平行关系,表明古老月季在起源上的差异较大,可利用其作为杂交亲本进行广泛杂交以选育具有丰富遗传多样性的杂交后代。根据有无父本特征酶带对杂种后代真实性进行鉴定,初步确定2个杂交组合的6个杂交后代中5个为真实杂种,1个为自交种。该研究结果为进一步开展月季遗传育种奠定了基础。
关键词:月季,过氧化物酶,亲缘关系,杂种鉴定,聚类分析
刘承源,王辉,邱文昌,等.基于过氧化物同工酶分析月季种质资源的亲缘关系及杂种真实性[J].广西植物,2016,36( 1) : 114-120
LIU CY,WANG H,QIU WC,et al.Genetic relationships and hybrids reality in rose germplasm based on POD isozyme[J].Guihaia,2016,36( 1) : 114-120
月季隶属蔷薇科蔷薇属( Rosa L.),该属约有近200种野生资源( Rehder,1940; Ku&Robertson,2003)和30 000余个园艺品种( Cairns,2007),但参与现代月季演化的野生资源仅为7个( Wylie,1954),分别为月季花( R.chinensis),巨花蔷薇( R.gigantea),多花蔷薇( R.multiflora),异味蔷薇( R.foetida),法国蔷薇( R.gallica),麝香蔷薇( R.moschata),光叶蔷薇( R.wichuraiana)。另外,在现代月季的育成中起了重要作用的中国古老月季( Chinese old garden roses)也未能得到充分应用( Wang,2007;张佐双和朱秀珍,2006)。因此,与野生资源和古老月季丰富的遗传多样性相比,现代月季的遗传背景较窄( Matsumoto et al,1998)。现在世界各地的月季育种工作者普遍认识到,要使现代月季育种有新的突破,必须进一步导入野生资源和古老月季的优良性状(张佐双和朱秀珍,2006; Debener &Mattiesch,1999)。
由于月季资源种类繁多,来源多样,加之广泛的种内变异、多倍化及种间杂交,使其种质资源复杂多样,分类和鉴定工作难度较大( Wissemann,2003)。同工酶是基因表达的产物,是基因在蛋白质水平上的表现型,既有相对的稳定性,又有种属的特异性,因此,同工酶能够反映物种基因水平的差异(胡能书和万贤国,1985)。过氧化物同工酶( POD)是细胞内抗脂质过氧化作用保护系统的主要成分之一,在植物次生代谢系统中起着重要的作用,同时,又是一种重要的遗传标记酶。POD被广泛应用于研究植物种类间的亲缘关系(李学强等,2010),种质资源的遗传多样性(李强栋等,2012;王玉荣等,2013;陈立强等,2014),逆境条件下植物的生长发育(陆晓民等,2011;张清等,2004)及杂种后代真实性鉴定(郭海林等,2006)。而且与RAPD、SSR、SRAP、AFLP、SNP等分子标记技术相比,同工酶标记技术具有成本较低、易于操作等特点。在品种分类研究方面,贾元义等( 2005)曾利用过氧化物同工酶对18个现代月季园艺品种进行测定,共检测出8条酶带,并基于酶带聚类分析将供试材料分成了5大类。然而,利用该酶对月季种质资源亲缘关系及杂种真实性鉴定的研究还未见报道。本研究通过对41份月季种质资源的过氧化物酶( POD)分析,探讨了野生种间及野生种和古老月季间的亲缘关系,并对2个杂交组合的杂交后代进行早期鉴定,为蔷薇属的系统关系、种质鉴定和资源的有效利用提供了理论依据。
1 材料与方法
1.1材料
实验选用的41份材料包括12个野生种、15个古老月季及14个现代月季栽培品种均取自深圳市公园管理中心月季种质资源保存圃(表1)。根据形态特征和文献资料确定材料的准确性( Ku&Robertson,2003; Cairns,2007;张佐双和朱秀珍,2006)。
1.2酶液制备、凝胶板制作、电泳及染色
取待试材料的新鲜幼嫩叶片,洗净,沥干,称取0.5 g于研钵中,加入少许石英砂,混合0.05 mol· L-1,pH7.8的磷酸缓冲液1.5 mL冰浴研磨成匀浆。10 000 r·min-14℃离心20 min,取上清液,分装在1 mL的Eppendorf管中,于-20℃冰箱中冷冻保存(胡能书和万贤国,1985)。
采用聚丙烯酰胺凝胶电泳法,电泳装置采用DYY-6C型电泳仪,DYCZ-24EN型电泳槽(北京市六一仪器厂)。电极缓冲液为pH8.3的Tris-甘氨酸,酶加样量为20 μL,分离胶浓度为7.2%,浓缩胶浓度为3.1%。稳压电泳,浓缩胶100 V,分离胶200 V,电泳4.5 h左右(胡能书和万贤国,1985;何忠孝和张树政,1999)。

表1 实验材料Table 1 Materials used in this study
采用抗坏血酸-联苯胺法染色(胡能书和万贤国,1985),室温染色至出现清晰的条带后,用7%冰醋酸脱色,选取谱带最清晰、整齐的胶板拍照做进一步分析。
1.3数据处理
染色后凝胶谱带颜色的深浅反映同工酶活性的强弱。根据颜色深浅程度将酶活性划分为强、中、弱3个等级。利用BandScan 5.0软件按谱带分布计算电泳迁移率( Rf=酶带迁移距离/前沿指示剂距离),参考酶活性等级绘制酶谱模式图。
将稳定出现条带的有或无量化为1和0进行统计,形成0,1矩阵。采用NTSYSpc 2.1分析软件计算样品之间的Nei氏相似性系数( genetic similarity coefficient,GS),利用非加权平均法( unweighted pairgroup method with arithmetic means,UPGMA)进行聚类分析并构建系统树(李强栋等,2012;王玉荣等,2013)。
2 结果与分析
2.1野生种与古老月季的过氧化物酶酶谱特征
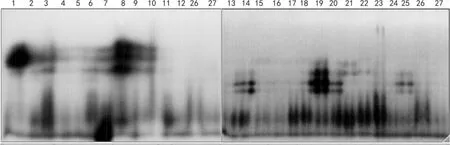
图1 27份月季种质的POD酶谱 试验材料编号见表1,下同。Fig.1 POD photograph of 27 rose germplasm Material names are listed in table 1,the same below.

图2 27份月季种质的酶谱模式图Fig.2 Ideogram of 27 rose germplasm
12个蔷薇原种及15个古老月季的POD同工酶酶谱及模式图见图1~2。不同材料之间在酶带数、迁移率及酶活性方面差异明显。27份月季种质的POD同工酶共显示了7条酶带,这与贾元义等( 2005)对该属材料进行POD同工酶研究所获得的酶带数基本一致。对获得的酶带分别标记为a、b……g,酶带最少的是金樱子( No.12)。这个材料中未检测到POD酶带;最多的是无刺蔷薇( No.6)和‘湖中月’( No.19),为5条;其余材料的酶带数在1~4之间。
根据酶带的相对迁移率及其分布特点把酶谱分为2个酶带区(表2),分别为A区( Rf = 0.264~0.650),B区( Rf = 0.858),A区包括a~f六条带,B区只有g一条带。其中a、b为野生种所特有,e、f为古老月季特有,c、d、g为所有材料的共有酶带,d除了无刺蔷薇具有外,其他野生种都无此带。在A区的a带,除硕苞蔷薇、樟味蔷薇、玫瑰、金樱子( No.1,2,11,12),b带除樟味蔷薇、玫瑰、金樱子( No.2,11,12),其余野生种均有检测出。所有古老月季都具有g带,‘软香红’等( No.13~15,18~20,24,25) 8个品种具e、f带。
2.2现代月季杂交亲本与后代的酶谱特征
杂交亲本与后代的过氧化物同工酶酶谱特征见图3。在3个杂交组合中,‘五月天’( C2)与藤‘墨红’( C1)比较无特征酶带,二者杂交后代‘香粉蝶’( C12-1)的酶谱与双亲差异明显,酶带在各处的酶活性都很强,以至于连成一条粗线;‘粉风铃’( C12-2)中未检测到与双亲不同的酶带。‘光彩’( C4)与‘白雪山’( C3)比较具有一条特征酶带,其杂交后代C34-1、C34-2、C34-3也都具有父本的特征带。‘红霞’( C6)与‘戴高乐’( C5)相比具有两条特有酶带,杂交后代中C56-1具有一条父本的特有带,C56-2具有一条父本特有带的同时却未检测到父母本的两条共有带,C56-3不具有父本的特征带,且酶带与母本完全一致。

表2 月季种质的酶谱迁移率Table 2 Rf value of the studied materials
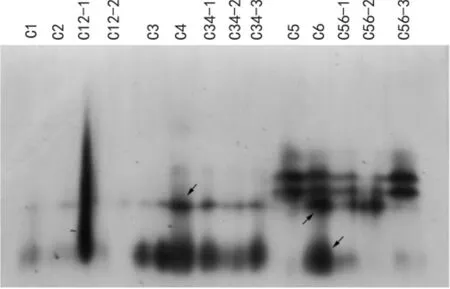
图3 杂交组合及后代的POD酶谱 箭头示与母本相比,父本的特征酶带。Fig.3 POD photograph of hybrid combinations and theirprogenies Arrows refer to specific enzyme bands of male parents.
2.3聚类分析
将27份月季种质材料的POD同工酶酶谱特征转化成二元属性数据,通过NTSYSpc 2.1软件计算得到遗传相似性系数( GS),为0~1(表3)。表3表明其遗传多样性丰富,亲缘关系远近各异。其中,香水月季与巨花蔷薇、悬钩子蔷薇,粉红香水月季与光叶蔷薇、竹叶蔷薇,樟味蔷薇与玫瑰、‘映日荷花’‘月月红’‘月月粉’之间的GS最大,亲缘关系近。光叶蔷薇、竹叶蔷薇分别与古老月季中的‘玉玲珑’‘大富贵’及‘一品朱衣’间的GS最小,亲缘关系较远。其他材料的GS在0.143~0.857之间。
采用UPGMA法对27份材料进行聚类分析,得到聚类树状图(图4)。以相似系数0.57为阈值,供试的27份种质被分为3个大组。第一组包括除樟味蔷薇、玫瑰及金樱子外的所有野生种,组内以相似系数为0.86为阈值,香水月季、粉红香水月季、巨花蔷薇、悬钩子蔷薇,光叶蔷薇及竹叶蔷薇分别聚在一起,上述材料与无刺蔷薇在0.81处聚为一个分支。第二组包括7个古老月季与樟味蔷薇、玫瑰与金樱子,在相似系数为0.83处,金樱子与其他材料分离开来。其余古老月季材料聚为第三组,其中,‘软香红’‘四面镜’和‘春水绿波’‘玉玲珑’‘大富贵’和‘一品朱衣’分别在相似系数为1处聚在一起。
3 讨论与结论
对酯酶( EST)和过氧化氢酶( CAT)进行了研究,但这两种酶活性较弱,不易被观察。而过氧化物酶相对来说更加稳定和清晰,且重复性好。类似情况在果树和蓖麻中也有报道(王玉荣等,2013;晁无疾和牛淑珍,1981),但在结缕草中却有相反观点(郭海林等,2006)。所以要根据所用材料来选择合适的酶进行分析,本研究表明蔷薇属植物采用过氧化物同工酶进行分析研究具有一定的可行性。
野生种及古老月季的酶谱结果显示不同材料在酶带数、迁移率及酶活性差异明显,表明供试材料具有丰富的遗传多样性,这与前人从形态( Rehder,1940; Ku&Robertson,2003;张佐双和朱秀珍,2006)、倍性(蹇洪英等,2010;张婷等,2010)及SSR(唐开学等,2008)等分子水平上研究得出的结论一致。聚类分析中巨花蔷薇、香水月季及悬钩子蔷薇优先聚类后再与粉红香水月季、光叶蔷薇及竹叶蔷薇聚为一支,再之后又与无刺蔷薇聚在一起。这一结果再次确认了蔷薇属内月季组与合柱组近缘( Matsumoto et al,1998; Jan et al,1999)。形态上,两个组内的材料都是托叶贴生,宿存,花柱外伸( Rehder,1940; Ku&Robertson,2003),区别仅在于月季组材料为离生花柱。这7个材料中有4个参与了现代月季的演化( Wylie,1954),表明现代月季遗传背景较窄( Matsumoto et al,1998)。值得注意的是,合柱组的另外一个材料粉团蔷薇和硕苞组的硕苞蔷薇聚在了一起,此处的粉团蔷薇在之前研究得知由于种内多倍化为三倍体材料(刘承源等,2008),硕苞蔷薇与其他月季种质杂交高度不亲和( Lewis&Basye,1961),此时两个材料聚在一起,为杂交可行性提供了依据。虽然硕苞蔷薇与金樱子在形态上因都具有离生且脱落的托叶而被划入一个大支中( Rehder,1940),但本文中基于过氧化物同工酶分析却被划入两个不同的大组中。实际上,硕苞蔷薇的宽锯齿状托叶,花托及小枝被短柔毛( pubescent or woolly)等性状都很容易区别于金樱子。RAPD分析( Jan et al,1999)也认为二者之间亲缘关系较远。所以,托叶离生、脱落这一性状似乎是意味着二者之间的趋同进化( convergence),而不是共有衍征( synapomorphy) ( Wissemann&Ritz,2005)。桂味组的玫瑰、樟味蔷薇与古老月季聚为一组,表明他们在野生种向古老月季,以至现代月季品种的演化过程中起到了一定作用,这个结果也与唐开学等( 2008)的观点基本一致。金樱子和古老月季聚在一组同样表明其作为杂交亲本的可行性,这一观点也在较早就被证实:大花白木香( R.×fortuniana)就是由金樱子和木香杂交而来( Crépin,1889; Matsumoto et al,2001)。我们在田间试验中应用其作为父本与‘映日荷花’‘秋霞’‘歌林娇红’等古老月季和现代月季杂交都有结实,遗憾的是种子不能萌发,这可在以后的工作中结合幼胚拯救做进一步研究。此外,供试古老月季聚为两组,与野生种聚成的一组成并列关系,说明古老月季品种间的起源差异较大,和供试野生种,尤其是参与现代月季演化的月季组与合柱组材料之间的亲缘关系也较远,可以作为远缘杂交育种的亲本材料。古老月季倍性丰富(蹇洪英等,2010;张婷等,2010),可利用不同倍性材料与栽培品种杂交,从中获得具有丰富染色体倍性和遗传多样性的杂交后代。

表3 27份月季种质资源的POD同工酶遗传相似性系数Table 3 POD genetic similarity coefficient of 27 rose germplasms resources
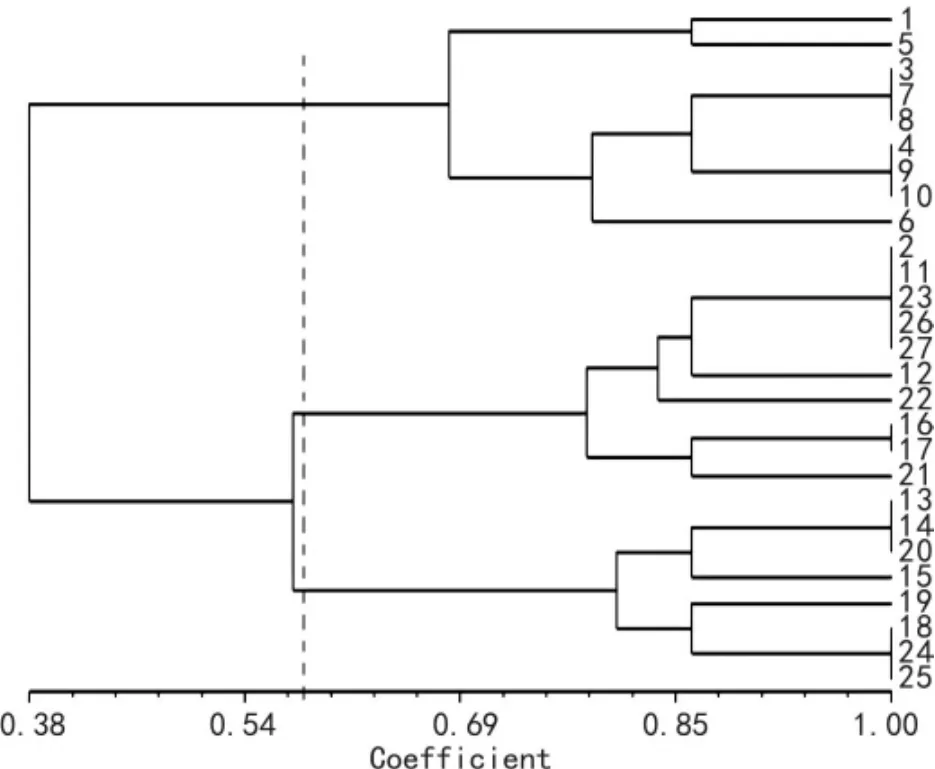
图4 27份月季种质的聚类分析图Fig.4 Dendrogram of genetic relationship between the materials obtained with the UPGMA method
对杂种F1代的真伪鉴定参照前人(郭海林等,2006;谷丽佳等,2012)的研究方法对酶谱进行分析: ( 1)父本与母本比较有特征带,且后代也具有该特征带; ( 2)父本与母本比较具有特征带,但后代不具有该特征带; ( 3)父本与母本比较没有特征带。第一种情况可鉴定后代为真是杂种,第二三种情况不能做出明确判断,要具体分析。本试验的第1个杂交组合中两个亲本(‘墨红’,‘五月天’)的酶带特点属于上述的第三种情况,其杂交后代‘香粉蝶’和‘粉风铃’是两个获得品种权的材料,如果是对这两个材料按上述标准进行初次鉴定,其杂种真实性都不能确定。其余两个杂交组合的杂交后代根据上述鉴定标准可推断C34-1、C34-2、C34-3,C56-1、C56-2为真实杂种,C56-3应为自交种。
由于受同工酶分子标记的特点所决定,同工酶多有低估种间实际差异的倾向(张俊卫和包满珠,1998)。本试验表明过氧化物同工酶在分析种质亲缘关系时由于多态性位点的局限而略显不足,但在杂种早期鉴定方面效果较好。因此,为使实验结果更加精确,在研究植物材料物种之间的关系时,通过同工酶、核型分析及分子标记等实验技术互为补充,结合外部形态来进行综合分析,不失为一种交叉印证的可行方法。
参考文献:
CAIRNS T,2007.Modern roses XII[M].New York: Academic Press.
CHAO WJ,NIU SZ,1981.Preliminary report of isozyme studies of wild Vitis germplasm[J].Chin Fruits,4: 41-44.[(晁无疾,牛淑珍,1981.我国葡萄野生种质资源的同工酶研究初报[J].中国果树,4: 41-44.]
CHEN LQ,SHI SL,MA CH,2014.Genetic diversity analysis of wild and cultivated alfalfa germplasm resources by isozyme markers[J].Pratac Sci,31( 6) : 1 070-1 079.[陈立强,师尚礼,马春晖,2014.野生及栽培苜蓿种质资源遗传多样性的同工酶分析[J].草业科学,31( 6) : 1 070-1 079.]
CRÉPIN F,1889.Sketch of a new classification of roses[J].J Royal Hort Soc,11: 337-352.
DEBENER T,MATTIESCH L,1999.Construction of a genetic linkage map for roses using RAPD and AFLP markers[J].Theor Appl Genet,99( 5) : 891-899.
GU LJ,WANG WH,WANG SD,et al,2012.Identification F1hybrid of lily by isozyme analysis[J].Chin Agric Sci Bull,28( 01) : 148-152.[谷丽佳,王文和,王树栋,等,2012.同工酶分析法鉴定百合杂种F1代[J].中国农学通报,28( 1) : 148-152.]
GUO HL,LIU JX,ZHU XH,et al,2006.Cross breeding and hybrid identification of Zoysia-Analysis of isozyme variation[J].Acta Pratac Sin,15( 6) : 101-108.[郭海林,刘建秀,朱雪花,等,2006.结缕草属植物杂交育种及其杂种鉴定-同工酶的变异分析[J].草业学报,15( 6) : 101-108.]
HE ZX,ZHANG SZ,1999.Cataphoresis[M].Beijing: Science Press: 280-287.[何忠效,张树政,1999.电泳[M].北京:科学出版社: 280-287.]
HU NS,WAN XG,1985.Isoenzyme technology and its application [M].Changsha: Hunan Science&Technology Press.[胡能书,万贤国,1985.同工酶技术及其应用[M].长沙:湖南科学技术出版社.]
JAN CH,BYRNE DH,MANHART J,et al,1999.Rose germplasm analysis with RAPD markers[J].Hortic Sci,34( 2) : 341-345.
JIA YY,ZHAO LY,WANG WL,et al,2005.Study of classification by the peroxidase isozyme technology in Rosa Chinensis Jacq.cultivars[J].J Shandong Agric Univ: Nat Sci Ed,36( 2) : 172-174.[贾元义,赵兰勇,王文丽,等,2005.月季品种过氧化物同工酶分类研究[J].山东农业大学学报·自然科学版,36( 2) : 172-174.]
JIAN HY,ZHANG H,WANG QG,et al,2010.Karylogical study of Chinese old garden roses[J].Acta Hort Sin,37( 1) : 83-88.[蹇洪英,张灏,王其刚,等,2010.中国古老月季品种的核型研究[J].园艺学报,37( 1) : 83-88.]
KU TC,ROBERTSON KR,2003.Rosa ( Rosaceae)[M]/ /Wu ZY,Raven PH ( eds).Flora of China.Vol 9.Beijing: Science Press; St Louis: Missouri Botanical Garden Press: 339-381.
LEWIS WH,BASYE RE,1961.Analysis of nine crosses between diploid Rosa species[J].Proc Amer Soc Hort Sci,78: 572-579.LI QD,MENG L,MAO PC,et al,2012.Isozyme analysis of different Chinese Iris population[J].Acta Ager Sin,20( 1) : 116 -124.[李强栋,孟林,毛培春,等,2012.不同居群马蔺种质材料同工酶酶谱特征分析[J].草地学报,20( 1) : 116-124.]
LI XQ,LI XZ,WANG X,2010.Study of five Prunus plants based on POD,CAT and EST[J].Bull Biol,45( 2) : 46-49.[李学强,李秀珍,王祥,2010.5种樱桃属植物的POD、CAT和SOD同工酶分析[J].生物学通报,45( 2) : 46-49.]
LIU CY,WANG GL,XIE QL,et al,2008.A study on the chromosome karyomorphology of 6 species in Rosa[J].J Jiangsu For Sci Technol,35( 6) : 5-8.[刘承源,王国良,谢秋兰,等,2008.6种蔷薇的核形态学研究[J].江苏林业科技,35( 6) : 5-8.]
LU XM,SUN J,GUO SR,et al,2011.Effects of 24-epibrassinolide on root growth and anaerobic respiration isozyme expression of cucumber seedlings under hypoxia stress[J].Chin J Ecol,30 ( 11) : 2 497-2 502.[陆晓民,孙锦,郭世荣,等,2011.低氧胁迫下24鄄表油菜素内酯对黄瓜幼苗根系生长及其无氧呼吸同工酶表达的影响[J].生态学杂志,30( 11) : 2 497-2 502.]
MATSUMOTO S,KOUCHI M,YABUKI J,et al,1998.Phylogenetic analyses of the genus Rosa using the matK sequence: molecular evidence for the narrow genetic background of modern roses [J].Sci Hortic,77( 1-2) : 73-82.
MATSUMOTO S,NISHIO H,UEDA Y,et al,2001.Phylogenetic analyses of genus Rosa: Polyphyly of section Pimpinellifoliae and origin of Rosa×fortuniana Lindl[J].Acta Hortic ( ISHS),547: 357-363.
REHDER A,1940.Manual of cultivated trees and shrubs,2nded [M].New York: MacMillan: 996-998.
TANG KX,QIU XQ,ZHANG H,et al,2008.Study on genetic diversity of some Rosa germplasm in Yunnan based on SSR markers[J].Acta Hortic Sin,35( 8) : 1 227-1 232.[唐开学,
(下转第100页Continue on page 100 )
Genetic relationships and hybrids reality in rose germplasm based on POD isozyme
LIU Cheng-Yuan1,2,WANG Hui2,QIU Wen-Chang2,HE Heng-Hui2,FANG Yan-Ming1*
( 1.Co-Innovation Center for Sustainable Forestry in Southern China,College of Biology and the Environment,Nanjing Forestry University,Nanjing 210037,China; 2.Department of Horticulture,Shenzhen Park Service,Shenzhen 518040,China )
Abstract:In order to improve the utilization of germplasm resources,and to accelerate the process of rose breeding,peroxidase ( POD) isozyme patterns of 27 rose germplasm resources and 8 progenies of 3 hybrid combinations were studied with vertical polyacrylamide plate electrophoresis.The results showed that it had certain feasibility to do these researches with POD isozyme in Rosa.Three general enzyme bands and four specific enzyme bands at seven isozyme loci ( Rf from 0.264 to 0.858) were obtained according to zymogram analysis,which indicated the genetic diversity were abundant,but there were some homology among these materials.The 27 materials could be divided into three groups based on the UPGMA cluster a-book=115,ebook=120nalysis at the similar coefficient 0.57.According to the clustering results,materials from sections Synstylae and Indicae were clustered within one same group,the morphological similarity between these two sections was confirmed again based on our POD isozyme analyses.Whereas Rosa laevigata,and R.bracteata were separated in two different groups,which indicated that these two accessions were distantly related to each other.The samples of old garden roses used in this study were divided into two different groups,and in parallel with the group made of wild species,it indicated that large differences existed on the origin of these samples,which could be used for wide crosses in order to get hybrid offsprings with abundant genetic diversities.Furthermore,according to whether there were specific enzyme bands of male parent in the progenies,five of six hybrids among two hybrid combinations were initially identified as true ones,and the rest one was self-cross variety.These findings could offer basic data for further studies on genetic breeding of rose.
Key words:rose,POD,genetic relationship,hybrid identification,cluster analysis
作者简介:刘承源( 1982-),男,山东青岛人,在读博士研究生,工程师,研究方向为月季种质资源创新及遗传育种,( E-mail) cyliu_1982@ 126.com。*通讯作者:方炎明,教授,博士生导师,研究方向为植物学,( E-mail) jwu4@ njfu.edu.cn。
基金项目:国家自然科学基金( 31370666) ;江苏高校优势学科建设工程项目( PAPD) ;深圳市城管局项目( 201008)[Supported by the National Science Foundation of China( 31370666) ; Priority Academic Program Development of Jiangsu High Education Institutions( PAPD) ; Project of Shenzhen Urban Management Bureau( 201008)]。
收稿日期:2014-11-27修回日期: 2015-03-18
DOI:10.11931/guihaia.gxzw201411039
中图分类号:S685.12
文献标识码:A
文章编号:1000-3142( 2016) 01-0114-07

