植物生长调节剂对甘薯产量和激素含量的影响
解备涛,王庆美,张海燕,李爱贤,侯夫云,
汪宝卿1,董顺旭1,张立明2
(1.山东省农业科学院 作物研究所,山东 济南 250100;2.山东省农业科学院,山东 济南 250100)
植物生长调节剂对甘薯产量和激素含量的影响
解备涛1,王庆美1,张海燕1,李爱贤1,侯夫云1,
汪宝卿1,董顺旭1,张立明2
(1.山东省农业科学院 作物研究所,山东 济南250100;2.山东省农业科学院,山东 济南250100)
摘要:为了探讨植物生长调节剂对甘薯产量和激素含量的影响,以济薯18、徐薯18和商薯0110为试验材料,在开始进入块根膨大期时(移栽后第35天),叶面喷施矮壮素·DA-6合剂和烯效唑,观察植物生长调节剂对不同生长类型甘薯的产量、光合作用和叶片、块根中的激素含量的影响。结果表明,植物生长调节剂处理促进同化物向根部的转运,提高了块根的产量。其中每hm2喷施1 500 mL矮壮素·DA-6合剂处理显著提高了3个品种的产量,225 g烯效唑处理显著提高了济薯18和徐薯18的产量。调节剂处理对不同类型甘薯光合作用的影响不同,矮壮素·DA-6合剂处理显著提高了徐薯18的光合速率,而对济薯18和商薯0110的光合速率的提高没有达到显著水平,烯效唑处理对甘薯叶片的光合作用没有显著影响。烯效唑处理降低了3个甘薯品种的叶片IAA含量,显著降低了济薯18膨大中期的GA3和叶片ZR含量,降低了徐薯18膨大后期的块根ZR和ABA含量;增加了济薯18和徐薯18膨大中、后期的叶片ABA含量、膨大前、中期块根IAA含量以及整个商薯0110膨大期的块根IAA含量。矮壮素oDA-6合剂处理显著降低了济薯18膨大中期的叶片IAA、膨大后期的块根和叶片ZR含量,降低了徐薯18膨大前期叶片IAA、ZR、ABA、块根ZR含量以及降低了商薯0110膨大前期的叶片GA3和后期的ZR含量;增加了济薯18膨大前期的块根ABA、GA3、叶片ZR、中期的叶片ABA和整个膨大期的块根IAA含量,增加徐薯18膨大前期的叶片ZR、中期的块根GA3和ZR含量、叶片IAA、ABA、后期的块根IAA含量,增加了商薯0110膨大期的块根ZR、ABA、中期的叶片ZR、后期的叶片GA含量。植物生长调节剂处理部分改变了甘薯内源激素的变化动态,促进了地上部同化物向块根的转运,提高了甘薯的块根产量,植物生长调节剂对甘薯光合作用的影响因品种类型而异,并不是影响甘薯块根产量的主要因素。
关键词:甘薯;植物生长调节剂;产量;光合作用;植物激素
中国是世界最大的甘薯生产国,2010年种植面积约460万hm2,约占世界甘薯种植面积的50%,年生产量1.08亿t,约占世界甘薯总产量的75.3%,为重要的粮食、饲料和工业加工原料[1]。甘薯块根产量的形成受许多因素影响,其中内源植物激素是主要的影响因素之一,植物内源激素能调控物质和能量的变化,从而影响同化物的形成和转运[2];施用外源植物生长调节物质,能影响到作物内源激素系统的变化,进而影响作物产量[3]。近年来,植物生长调节剂在甘薯生产上起到举足轻重的作用,部分植物生长调节剂对甘薯的发根和膨大有明显的促进作用[4-5]。如矮壮素、多效唑等能有效地抑制甘薯地上部的徒长,提高产量[6];多效唑(PP333)浸根促进甘薯分枝增多、有利于建立合理的群体,提高群体光合速率,达到增产目的[7]。封垄期叶面喷洒缩节胺(Pix)75 g/hm2,增加单株结薯数,鲜薯产量提高5.39%~11.82%,薯干产量增加10.08%~20.75%[8]。
烯效唑(S3307)是一类高效、低毒、低残留、污染小的植物生长延缓剂,具有调控内源激素平衡,促进植物生根、抑制根系伸长,控制植株高度,增强植株抵抗逆境能力等作用[9-11];2-N,N-己酸二乙氨基乙醇酯(DA-6)是一种安全高效的作物高产优质抗逆基因诱导剂,可扩大植物叶面积,提高叶绿素含量和光合速率,延长叶片功能期,促进植物碳水化合物的合成与积累,提高作物产量[12-15]。但这些研究均着眼于单个植物生长调节物质的作用,复配的植物生长调节剂对甘薯膨大期地上部和地下部的互作以及相关生理变化的研究还未见报道,本研究就是研究烯效唑和2-N,N-己酸二乙氨基乙醇酯的合剂对甘薯产量和激素含量的影响,以便为甘薯高产栽培提供理论依据。
1材料和方法
1.1试验材料
供试甘薯有3个品种:紫色品种济薯18,由山东省农业科学院作物研究所甘薯研究室育成,该品种地上部生长旺盛,易旺长;商薯0110,由商丘农科院甘薯研究所育成,该品种地上部生长相对较弱;徐薯18,北方薯区代表品种,由徐州甘薯研究中心育成,其地上部与地下部生长比较协调。试验所需的植物生长调节剂均由中国农业大学化控中心提供,烯效唑为5%的可湿性粉剂,矮壮素·DA-6合剂为水剂,其中矮壮素有效成分为50%,DA-6有效成分为0.4%。
1.2试验方法
1.2.1试验处理试验于2012,2013年在山东省农科院作物研究所试验田进行,试验地为轻壤土,地力中等,土壤有机质18.3 g/kg,水解氮112.5 mg/kg,速效磷56.7 mg/kg,速效钾98.0mg/kg。试验于2012年6月14日栽植,10月20日收获;2013年6月11日栽植,10月24日收获。每个处理均为4次重复(重复1为挖根调查区),小区面积27 m2,垄长6 m、垄宽0.75 m,6行区,随机排列,栽植密度为51 000 株/hm2,田间管理同大田。
在2011年以济薯18为试验材料,进行2种植物生长调节剂的筛选试验,筛选出最佳的浓度。在甘薯移栽后第35天开始进入膨大期后,实施调节剂喷施处理,处理1为每小区喷施50 mg/L的烯效唑(S3307)溶液850 mL(标记为“S”),处理2为每小区喷施2.5 g/L的矮壮素(Chlormequat chloride,CCC)和10 mg/L己酸二乙氨基乙醇酯(DA-6)的混合溶液850 mL(标记为“M”),以喷施清水为对照(标记为“C”)。在处理10 d后对主蔓第4片展开叶和根系进行取样。
1.2.2测定项目与方法形态调查和产量测定:在膨大中期(移栽后75 d)每处理选取10株,对地上部和地下部进行烘干称重(薯块切片后先用105 ℃高温烘干30 min,再用80 ℃烘干至恒重),计算出S/R比率。在收获时统计每个小区的块根鲜质量,3个小区平均计算出每hm2的产量(表1)。
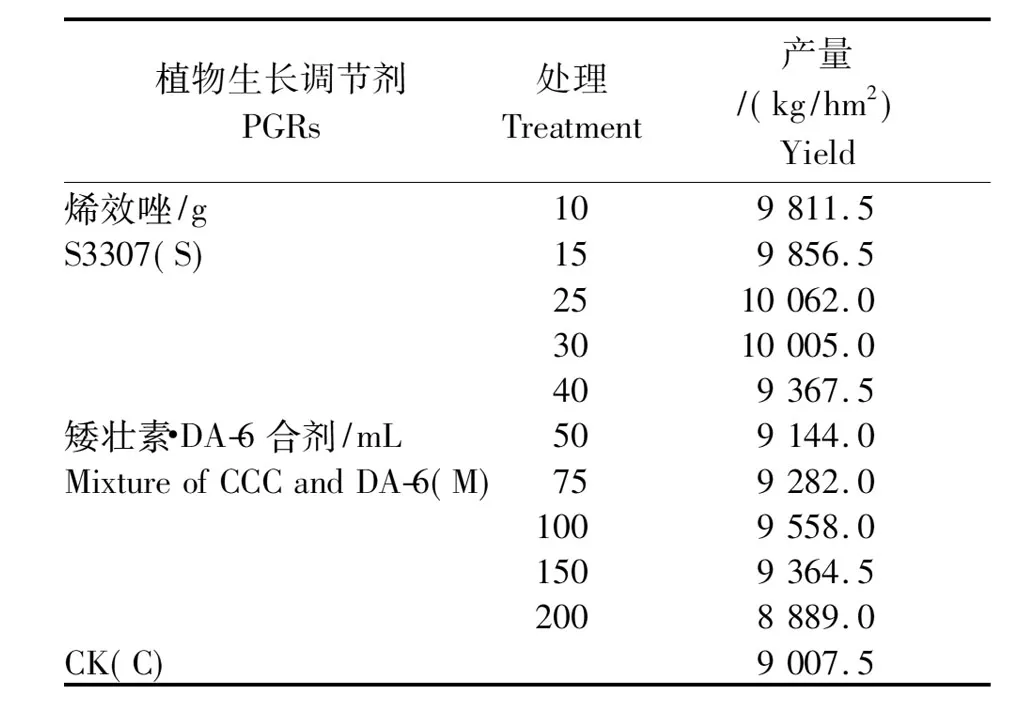
表1 植物生长调节剂浓度筛选试验
光合速率测定:在调节剂处理10 d后,选择温度为20~30 ℃,空气相对湿度为30%~40%的晴朗天气,上午9:00-11:00,采用LI-6400 光合测试系统(LI-COR,USA)测定甘薯主茎顶端第4片完全展开叶的光合作用,采用红蓝光源,光通量密度为1 000 μmol/(m2·s),每个处理测8株。
激素含量测定:在调节剂处理10 d后的膨大前期,取甘薯主茎顶端第4片完全展开叶和根系,叶片取样后,在液氮中快速冷冻,然后立即放进-70 ℃的超低温冰箱中冷藏,用于测定叶片和根的内源激素含量。根用清水清洗干净,全部切碎,放在样品袋里用液氮冷冻后,再在-70 ℃的超低温冰箱里冷藏;在膨大中(移栽后85 d)、后期(移栽后125 d),块根取出后选取中等薯块,清水洗净,将薯块从中间纵切和横切各一次,切碎其中的一块,取20 g左右放进取样袋,进行液氮冷冻和-70 ℃的超低温冰箱冷藏。测激素含量时,从样品袋里取出0.5 g左右薯块进行激素含量测定,每个样品袋进行3次重复。利用ELISA方法测定叶片和根的激素含量,方法参见何钟佩[16]主编的《农作物化学控制实验指导》。
1.3数据处理与分析
数据、图表处理在Excel 2003下进行,统计分析和差异显著性检验在SAS 6.12数据处理系统下进行。
2结果与分析
2.1植物生长调节剂处理对甘薯产量的影响
从表2中数据可以看出,植物生长调节剂处理抑制了济薯18的地上部旺长,冠根比下降显著;调节剂处理均显著提高了济薯18的产量。对于地上部和地下部生长比较协调的品种徐薯18,矮壮素·DA-6合剂处理增产效果最为明显,从中期调查的冠根比可以看出烯效唑处理在前期对徐薯18没有明显的调控效果,在膨大后期促进了块根的快速膨大(表2)。烯效唑和矮壮素·DA-6合剂处理均显著提高徐薯18的产量。对于地上部生长比较弱的品种商薯0110,有抑制生长成分的调节剂处理降低了甘薯的产量,而具有控促结合的矮壮素·DA-6合剂显著提高了商薯0110的块根产量(表2)。

表2 植物生长调节剂处理对不同甘薯品种产量和相关农艺性状的影响
注:表中数据为2012,2013年数据;在同一品种和同一栏中标以不同字母的值表示在0.05水平差异显著,表3~5同。表中农艺性状数据均为移栽后85 d数据。
Note:The values in table were the average of 2012 and 2013;Values followed by different letters within a same variety and column are significantly different at the 0.05 probability levels,the same as Tab.3-5.The values of agronomic trait in table were obtained on 85 days after transplanting.
2.2植物生长调节剂对甘薯叶片光合作用的影响
表3中数据表明,调节剂处理对不同类型甘薯光合作用的影响不同。对于地上部生长旺盛的济薯18,与对照相比较,调节剂处理的光合速率没有显著变化,但是2个调节剂处理之间,矮壮素·DA-6合剂的光合性能显著高于烯效唑处理,其光合速率、气孔导度和蒸腾速率分别比烯效唑处理提高9.4%,20.0%,17.4%,胞间二氧化碳浓度没有显著变化。矮壮素·DA-6合剂处理显著提高了徐薯18的光合作用,光合速率、气孔导度和蒸腾速率分别比对照提高24.4%,50.0%,33.5%,胞间二氧化碳浓度下降70%;除胞间二氧化碳浓度显著下降外,烯效唑处理对徐薯18的蒸腾速率和气孔导度没有显著影响。矮壮素·DA-6合剂处理显著提高了商薯0110的蒸腾速率,降低了胞间二氧化碳浓度,提高了其光合速率和气孔导度,但是没有达到显著水平;烯效唑处理对商薯0110的光合作用没有显著影响。
2.3植物生长调节剂对甘薯激素含量的影响
2.3.1植物生长调节剂对甘薯叶片内源激素含量的影响从表4中数据可以看出,在膨大过程中甘薯叶片中的IAA含量逐渐下降,植物生长调节剂处理没有改变叶片中IAA含量的变化趋势。济薯18叶片IAA含量膨大前期显著高于徐薯18和商薯0110,也反映济薯18比徐薯18和商薯0110地上部生长旺盛。烯效唑处理降低了甘薯叶片中的IAA含量,DA-6·矮壮素喷施处理对商薯0110叶片IAA含量没有显著影响,但是降低了济薯18和徐薯18前期的IAA含量,提高了徐薯18膨大中、后期的叶片IAA含量。
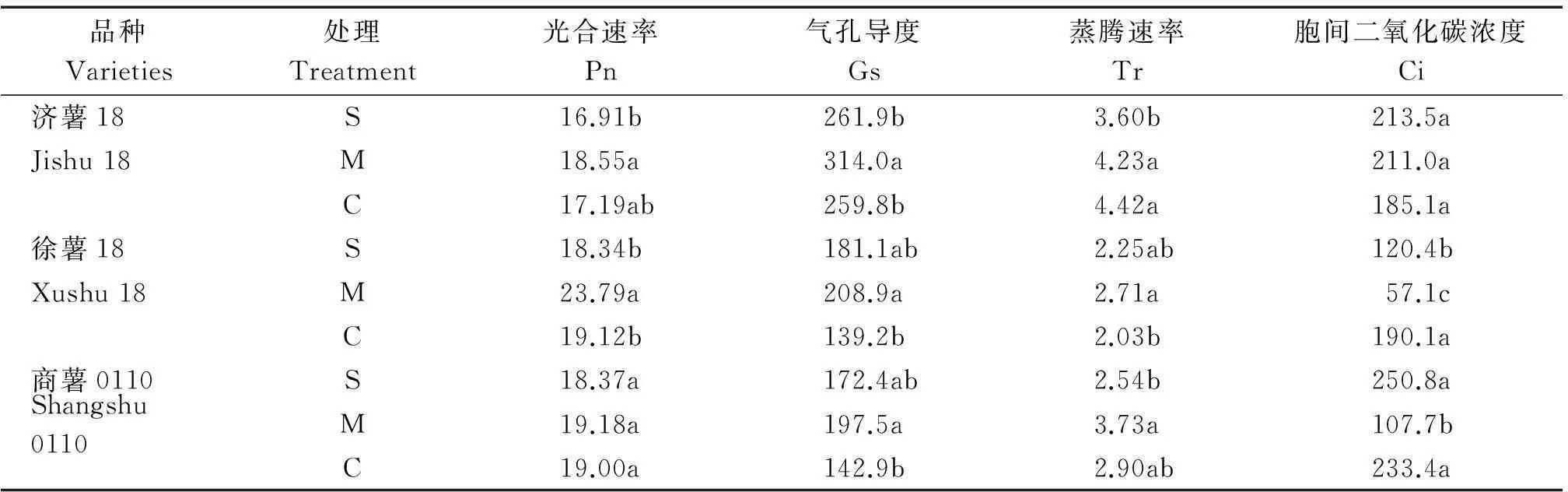
表3 植物调节剂处理对甘薯光合作用的影响
在膨大过程中,济薯18叶片GA3含量呈单峰曲线变化,徐薯18叶片的GA3含量在整个膨大过程中缓慢升高,而商薯0110则相反。烯效唑喷施处理提高了济薯18膨大前期而降低了中期叶片的GA3含量,提高了徐薯18前、中期,而降低了后期叶片的GA3含量,与徐薯18相反,烯效唑处理降低了商薯0110前、中期叶片的GA3含量,提高了后期叶片的GA3含量。DA-6·矮壮素喷施处理对济薯18和徐薯18叶片的GA3含量没有显著影响,但是降低了商薯0110叶片前期的GA3含量,提高了后期的含量,使商薯0110的叶片GA3含量在膨大过程中呈先下降后上升趋势。
济薯18和徐薯18叶片的ZR含量在膨大过程中均呈单峰曲线变化,商薯0110叶片的ZR含量在膨大中期最低,呈“V”字分布。烯效唑喷施处理降低了济薯18膨大中期叶片ZR含量,对徐薯18和商薯0110叶片的ZR含量没有显著影响。DA-6·矮壮素喷施处理提高了济薯18膨大前期和商薯0110膨大中期叶片的ZR含量,降低了济薯18、商薯0110膨大后期和徐薯18膨大前期叶片的ZR含量。
在膨大过程中,济薯18叶片的ABA含量呈前期缓慢下降,后期缓慢升高的趋势,徐薯18和商薯0110的叶片ABA含量在膨大期缓慢升高;烯效唑处理提高了济薯18中期和徐薯18中、后期叶片的ABA含量,对商薯0110没有明显影响;DA-6·矮壮素喷施处理降低了徐薯18膨大前期和商薯0110膨大后期叶片的ABA含量。
2.3.2植物生长调节剂对甘薯块根内源激素含量的影响从表5中数据可以看出,在块根膨大过程中,3个类型的甘薯品种块根中的IAA含量一直比较稳定,没有显著变化。烯效唑喷施处理后,济薯18和商薯0110块根中的IAA含量显著升高,但是整个膨大期逐渐下降,烯效唑处理提高了徐薯18和商薯0110膨大前、中期块根中IAA的含量降低了徐薯18膨大后期的块根IAA含量。DA-6·矮壮素喷施处理提高了济薯18整个膨大期和徐薯18膨大后期块根中的IAA含量,对商薯0110块根的IAA含量影响不显著。
济薯18块根中GA3含量在膨大期呈单峰曲线变化,徐薯18块根GA3含量逐渐升高,而商薯0110块根GA3含量逐渐下降。除济薯18膨大中期块根GA3含量显著下降外,烯效唑处理对济薯18和徐薯18块根中GA3含量影响不明显,但是提高了商薯0110膨大中、后期块根GA3含量。DA-6·矮壮素处理显著提高了济薯18膨大前期和徐薯18中期块根的GA3含量,对商薯0110则没有显著影响。

表4 植物生长调节剂对甘薯不同时期叶片的激素含量的影响 (2013)
在甘薯块根膨大过程中,济薯18和徐薯18块根的ZR含量均呈“V”形变化,而商薯0110块根的ZR含量逐渐升高。烯效唑处理显著降低了徐薯18膨大前、后期块根中的ZR含量,对济薯18和商薯0110块根ZR含量没有显著影响。DA-6·矮壮素处理降低了济薯18膨大后期和徐薯18膨大前期块根中的ZR含量,提高了徐薯18中期和商薯0110整个膨大期块根中的ZR含量。
在块根膨大过程中,济薯18、徐薯18和商薯0110块根中ABA含量均逐渐升高。烯效唑处理显著提高了商薯0110整个膨大期的块根ABA含量,也提高了济薯18前、后期和徐薯18、商薯膨大前期的块根ABA含量,但不显著;烯效唑处理显著降低了徐薯18膨大中、后期块根的ABA含量。DA-6·矮壮素处理降低了徐薯18块根的ABA含量,提高了商薯0110的含量,除膨大前期显著升高之外,DA-6·矮壮素处理对济薯18块根ABA含量影响不明显。
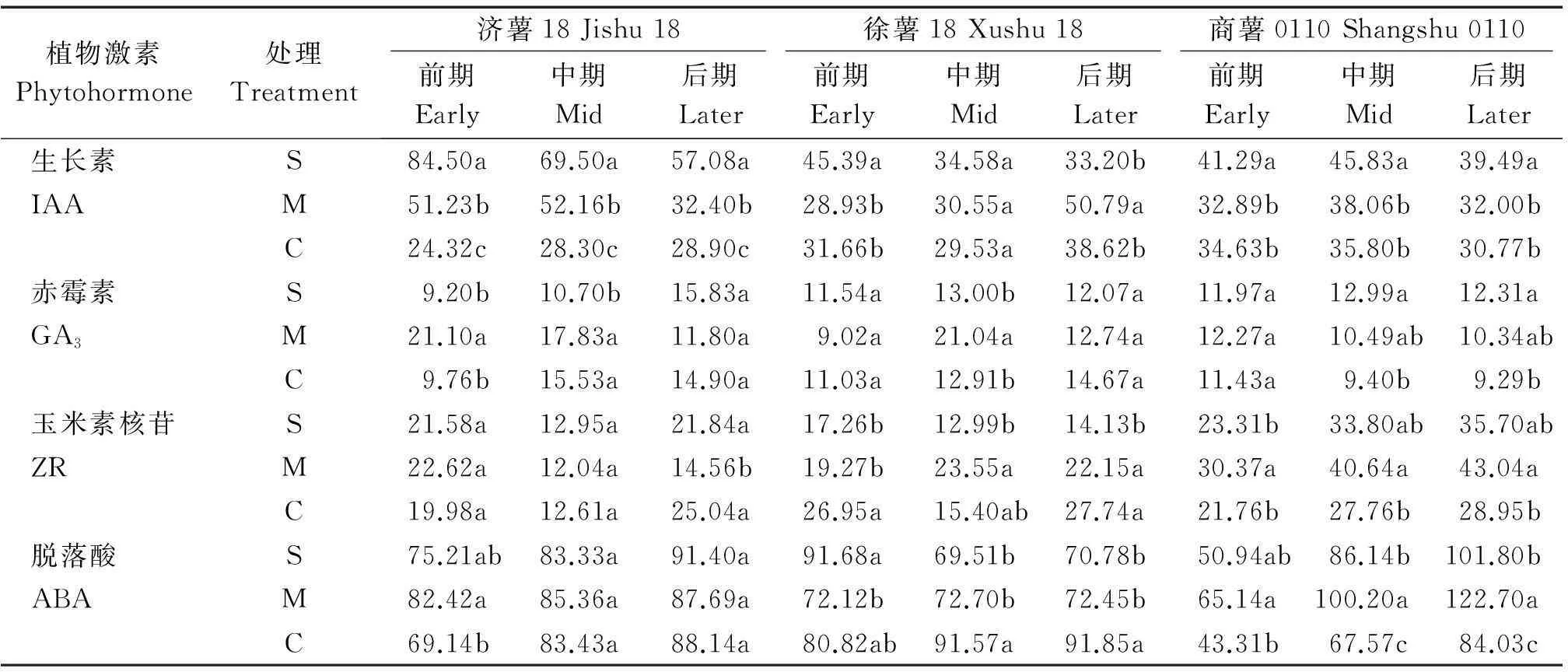
表5 植物生长调节剂对甘薯不同时期块根激素含量的影响(2013年)
3讨论与结论
相当多的研究文献表明,植物生长调节剂能促进甘薯叶片的光合作用[7,17-18],这可能是植物生长调节剂处理改善了光合作用的因子[14-15,19-21],在本试验中,烯效唑处理甘薯叶片的光合速率与对照均没有显著差异,DA-6·矮壮素处理显著提高了徐薯18叶片的光合作用,但是2个处理的产量均显著高于对照,对于商薯0110,DA-6·矮壮素处理产量显著高于烯效唑产量,这说明了植物生长调节剂对甘薯产量的提高主要有增加同化物合成和促进光合同化物到块根转移2种途径。
在本试验中,甘薯叶片和块根的激素含量变化分为两类,一类是在前期升高,后期下降,整个膨大期呈倒“V”字形,如济薯18中GA3、ZR和ABA含量,一类就是在整个块根膨大过程中一直缓慢上升,如徐薯18和商薯0110叶片的GA3、ZR和ABA。这可能是因为甘薯基因型不同,块根膨大过程中内源激素含量变化也不同。从表2,4中的数据可以看出,甘薯叶片的IAA含量与主蔓长度和地上部生物量呈一定的正相关关系,而块根IAA含量与地下部生长也有一定的正相关的关系,IAA虽然不是决定块根形成和膨大的关键因素,但仍然对块根的膨大有积极作用[22-23]。济薯18在膨大中期叶片和块根的GA3含量偏高,地上部生长旺盛,地下部生物量较小;徐薯18在膨大期叶片和块根的GA3含量同步升高,生长比较协调;商薯0110在膨大中期叶片和块根中GA3含量同步下降,其长势比较弱;这表明GA3能促进甘薯的地上部生长以及在一定程度上抑制向块根的转移,这与张明生等[24]的研究结果相呼应。济薯18叶片的ZR含量在膨大中期处于最高峰,而块根的ZR含量最低;与之相反,商薯0110在中期叶片ZR含量最低,块根ZR含量却最高;徐薯18在这个时期叶片的ZR含量变化较小,而块根ZR含量在膨大中期处于低谷。3个生长类型品种叶片中的ABA含量在整个膨大期均缓慢上升,块根的ABA含量在前期上升,中后期保持稳定,ZR和ABA含量的高低,在块根膨大的速率方面起着关键的作用,与块根产量间存在显著正相关关系[6,25-27]。
在本试验中,植物生长调节剂不但改变了甘薯块根和叶片的激素含量,还改变了内源激素在块根膨大期的变化趋势,这可能与改变了甘薯块根的膨大情况相对应。从表2,4,5中的数据可以看出,烯效唑处理主要降低了甘薯叶片的IAA、ZR、GA3含量,增加了甘薯叶片的ABA含量,在作用上主要表现在抑制甘薯地上部的旺长,促进地上部同化物向块根的转移,对于济薯18这样地上部生长旺盛的品种增产效果最显著,对徐薯18增产效果次之,而对商薯0110这样地上部相对较弱的品种甚至有降低产量的影响。矮壮素·DA-6合剂处理对3个生长类型甘薯品叶片的激素含量影响不一致,对于济薯18,降低了叶片ZR含量,提高了叶片和块根的ABA含量,表现为矮壮素·DA-6合剂处理抑制了济薯18地上部的旺长,促进同化物向块根的转移;对于徐薯18,叶片中膨大后期的GA3含量、膨大中期的ZR含量和整个膨大期块根中ABA均升高,表现为矮壮素·DA-6合剂处理对徐薯18地上部的抑制作用不明显,但是促进了同化物向块根的转移;对于商薯0110,叶片中GA3、ZR含量和块根中ABA均升高,表现为矮壮素·DA-6合剂处理既一定程度上促进了商薯0110地上部的生长,也促进了地上部同化物向块根的转移,在叶片光合作用上也验证了这个作用。
从表2可以看到不同的植物生长调节剂处理对甘薯产量的影响不同,同一种植物生长调节剂对不同基因型的甘薯品种产量也不尽相同。对于地上部生长旺盛的品种如济薯18,必须用具有延缓功能的生长调节剂才能控制地上部的生长,对于地上部生长偏弱的品种如商薯0110,利用控促结合的复合型植物生长调节剂可能更好地提高甘薯的产量;在水分充足的南方薯区,以延缓生长为主的调节剂比较适宜,在水分相对较少的北方薯区,利用促控结合的复合性调节剂能提高甘薯的产量,这也是文献经常出现在南方薯区利用多效唑或其他延缓剂提高产量的原因[28-29]。
植物生长调节剂处理部分改变了甘薯内源激素的变化动态,促进了地上部同化物向块根的转运,促进同化物的合成、提高了甘薯的块根产量,2种植物生长调节剂都提高了甘薯块根ABA的含量,对IAA含量影响不明显;对不同类型品种块根其他激素含量的影响不一致,调节剂处理对不同类型甘薯光合作用的影响不同,矮壮素·DA-6合剂处理显著提高了徐薯18的光合作用,对济薯18和商薯0110的光合作用没有显著影响,烯效唑处理对甘薯叶片的光合作用没有显著影响。植物生长调节剂对甘薯产量的提高主要通过提高同化物合成和促进同化物向块根的转运2种途径。
参考文献:
[1]马代夫,李强,曹清河,等.中国甘薯产业及产业技术的发展与展望[J].江苏农业学报,2012,28(5):969-973.
[2]Dulin A F.Peculiarities of energy exchange in detached barley leaves enriched by phytohormones[J].Biologicheskie Nauki,1976,10:94-98.
[3]Ford Y Y,Ratcllffe R G,Robins R J.Phytohormone-induced GABA production in transformed root cultures ofDaturastramonium:aninvivo15N NMR study[J].Journal of Experimental Botany,1996,47(6):811-818.
[4]魏猛,李洪民,唐忠厚,等.植物生长调节剂对食用型甘薯产量、品质性状及淀粉RVA特性的影响[J].西南农业学报,2013,26(6):2261-2264.
[5]曾志明,张启堂,陈其恒,等.几种块根膨大剂对甘薯主要经济特性的影响[J].安徽农业科学,2015(29):118-120.
[6]张立明,王庆美,何钟佩.脱毒和生长调节剂对甘薯内源激素含量及块根产量的影响[J].中国农业科学,2007,40(1):70-77.
[7]宋冠华,冉梦莲,陈铁洪.PP333对紫甘薯产量及品质的影响[J].广东第二师范学院学报,2014(5):86-89.
[8]李强,马代夫,李洪民,等.缩节胺(pix)对甘薯生理特性和产量影响的研究[J].耕作与栽培,2001(2):31-36.
[9]Yan Y H,Gong W Z,Yang W Y,et al.Seed treatment with uniconazole powder improves soybean seedling growth under shading by corn in relay strip intercropping system[J].Plant Production Science,2010,13(13):367-374.
[10]李宁毅,韩晓芳,宋妍.高温胁迫下不同浓度烯效唑对百日草幼苗光合作用和叶绿素荧光参数的影响[J].吉林农业大学学报,2012,34(1):5-10.
[11]Jiang Y,Peng Y,Zhi hui L I,et al.Effects of paclobutrazol,uniconazole and chlorcholinchlorid on dwarfing ofZamioculcaszamiifolia[J].Acta Horticulturae Sinica,2010,37(5):823-828.
[12]胡兆平,李伟,陈建秋,等.复硝酚钠、DA-6和α-萘乙酸钠对茄子产量和品质的影响[J].中国农学通报,2013,29(25):168-172.
[13]吴燕,耿书德,史长江,等.DA-6对滁菊幼苗生长及叶片氮代谢的影响[J].核农学报,2014,28(12):2283-2289.
[14]梁艳萍,牟红梅,王晶晶,等.不同光强下DA-6对草莓光合作用及抗氧化酶活性的影响[J].中国农业大学学报,2011,16(5):71-76.
[15]牟红梅,艾沙江·买买提,刘国杰,等.DA-6对温室油桃光合作用及果实品质的影响[J].中国农业大学学报,2012,17(2):85-89.
[16]何钟佩.农作物化学控制实验指导[M].北京:中国农业大学出版社,1993:60-68.
[17]周月英,郑华,刘利华,等.不同激素对鲜食甘薯经济性状及产量效益的影响[J].中国农学通报,2000,16(3):52-53.
[18]廖平安,靳文奎,郭春强.脱毒甘薯的增产潜力分析[J].作物杂志,2002(6):16-17.
[19]单守明,刘国杰,李绍华.DA-6对温室桃树光合作用和叶绿体活性的影响[J].植物营养与肥料学报,2008,14(6):1237-1241.
[20]李宁,王美月,孙锦,等.外源24-表油菜素内酯对弱光胁迫下番茄幼苗生长及光合作用的影响[J].西北植物学报,2013,33(7):1395-1402.
[21]钟瑞春,唐秀梅,蒋菁,等.烯效唑对花生生长、光合作用及产量性状的影响[J].广东农业科学,2015,42(11):65-70.
[22]张启堂.甘薯和Ipomoeatrifida根内玉米素含量的高效液相色谱分析[J].中国甘薯,1996,8:141-144.
[23]Nakatani M,Komeichi M.Changes in the endogenous levels of zeatin riboside,abscisic acid and indole acetic acid during formation and thickening of tuberous roots in sweet potato[J].Japanese Journal of Crop Science,1991,60(1):91-100.
[24]张明生,谢波,谈锋.水分胁迫下甘薯内源激素的变化与品种抗旱性的关系[J].中国农业科学,2002,35(5):498-501.
[25]王鹏飞,李鑫宇,李明杰,等.地黄块根膨大发生和驱动的组织观察及激素相关基因的调控分析[J].中国中药杂志,2014(17):3245-3253.
[26]王庆美,张立明,王振林.甘薯内源激素变化与块根形成膨大的关系[J].中国农业科学,2005,38(12):2414-2420.
[27]李俊慧.人参榕块根膨大过程细胞分裂素与相关基因表达研究[D].福州:福建农林大学,2012.
[28]何林,王金信,邓新平.8%甲哌鎓可溶性粉剂对甘薯生长发育、产量及品质的影响[J].农药学学报,2001(3):89-92.
[29]曾志明,张启堂,陈其恒,等.几种块根膨大剂对甘薯主要经济特性的影响[J].安徽农业科学,2015(29):118-120.
The Effect of Plant Growth Regulators on the Yield and Phytohormone Concentration in Sweet Potato
XIE Beitao1,WANG Qingmei1,ZHANG Haiyan1,LI Aixian1,HOU Fuyun1,WANG Baoqing1,DONG Shunxu1,ZHANG Liming2
(1.Crop Science Research Institute,Shandong Academy of Agricultural Sciences,Jinan250100,China;2.Shandong Academy of Agricultural Sciences,Jinan250100,China)
Abstract:To investigate the effect of plant growth regulators (PGRs)on the yield and phytohormone in sweet potato,the experiments were conducted with the spraying of PGRs at the beginning of enlargement stage in Jinan experimental base of SAAS.The effects of PGRs on the yield,dry matter distribution,photosynthesis and the phytohormone in root and leaf were investigated in three types (exuberant,general and feeblish of over ground part) sweet potato under field conditions.The results showed that the PGRs increased the root yield of sweet potato,enhanced the transfer of assimilation to the root.The mixture of CCC and DA-6 increased the photosynthetic rate of Xushu 18 and the effect of S3307 on the photosynthesis of 3 varieties was not significant compared with the contrast,and there was no significant relationship between the effect of PGRs on the photosynthesis and root yield.The treatment of S3307 decreased the concentration of leaf IAA in 3 sweet potato varieties,and decreased leaf ZR and GA3content in middle expansion period of Jishu 18,and decreased the leaf ZR and ABA content in later expansion period of Xushu 18,and the treatment of S3307 increased the leaf ABA content in middle and later expansion period and the root IAA content in front and middle expansion period of Jishu 18 and Xushu 18,and the IAA content in root of Shangshu 0110 was improved by S3307 during the expansion period.The mixture of CCC and DA-6 decreased the leaf IAA content in middle and root and leaf ZR content in later expansion period of Jishu 18,and decreased the leaf IAA,ZR,ABA and root ZR content in fronter expansion period of Xushu 18,and decreased the leaf GA3in froner stage and the ZR content in later expansion stage.The mixture of CCC and DA-6 in increased the root ABA,GA3and leaf ZR content in fronter stage and leaf ABA content in middle stage and root IAA content during the expansion stage of Jishu 18,and increased the leaf ZR content in froner stage and root GA3and ZR,leaf IAA and ABA content in middle stage and root IAA content in later expansion period of Xushu 18,and increased the root ZR and ABA in the whole period and leaf ZR content in middle stage and leaf GA3content in later expansion stage of Shangshu 0110.The treatment of PGRs changed the trend of phytohormone content of sweet potato on a certain extent,and promoted the transfer of assimilation from leaf and stem to the root,increasing the yield of tuberous root.The effect of PGRs on the photosynthesis varied with variety type,which was not the main effect of tuberous root yield.
Key words:Sweet potato;PGRs;Yield;Photosynthesis;Phytohormone
doi:10.7668/hbnxb.2016.01.025
中图分类号:S531.01
文献标识码:A
文章编号:1000-7091(2016)01-0155-07
作者简介:解备涛(1976-),男,山东东明人,助理研究员,博士,主要从事甘薯栽培研究。
基金项目:国家甘薯产业体系项目(cars-11-b-11;cars-11-b-06);山东省科技重大专项(2015ZDJS03001-3);甘薯标准化种植技术研发项目(2014CXZ05-3)
收稿日期:2015-11-02

