普通小麦春化基因VRN1 RNA干扰载体构建及转基因小麦获得
张宝娜,朱灿灿,张鹏钰,卫 丽,王 翔,姜玉梅,王同朝
(1.河南农业大学 农学院,河南 郑州 450002;2.河南农业大学 国家小麦工程技术研究中心,河南 郑州 450002)
普通小麦春化基因VRN1 RNA干扰载体构建及转基因小麦获得
张宝娜1,朱灿灿2,张鹏钰1,卫丽2,王翔2,姜玉梅2,王同朝1
(1.河南农业大学 农学院,河南 郑州450002;2.河南农业大学 国家小麦工程技术研究中心,河南 郑州450002)
摘要:为进一步探究春化基因VRN1在小麦发育进程中的功能,利用荧光定量PCR分析了VRN1基因在不同发育特性小麦品种新春2号、京841中的表达情况。结果表明,随着生育进程的推进,VRN1基因在新春2号叶片和茎尖中表达量均呈上升趋势,VRN1基因在京841叶片中呈波动上升趋势,在茎尖中表达量趋于0;以pFGC5941载体为基础构建含有VRN1反向重复序列的 RNA干扰载体,利用农杆菌介导的茎尖转化法转化新春2号获得了再生植株,并通过PCR法检测获得了转基因阳性植株,为从分子水平上实现小麦发育特性遗传改良和创育小麦新种质奠定了基础。
关键词:小麦;春化基因VRN1;表达;转化
小麦春化作用是一个高度复杂的生理生化过程,也是小麦(TriticumaestivumL.)生长发育进程中的一个重要阶段,受多基因调控。小麦春化作用主要受VRN1、VRN2、VRN3、VRN4等基因调控[1-3]。普通小麦VRN1基因有3个同源基因,VRN-A1、VRN-B1和VRN-D1[4-7]。3个同源基因中任何一个基因的调控区发生插入、缺失,就能使VRN1基因变为显性,导致小麦发育特性表现为春性即不需要经过春化作用就能抽穗开花[8-9]。前人研究表明,VRN1是小麦春化作用所必需的关键基因[1,10-11]。VRN1基因编码一种MADS-box转录因子,其可与靶基因启动子区中的CArG-box特异结合,该转录因子是拟南芥分生组织鉴定基因AP1/FRUITFUL的同源基因;MADS-box转录因子是重要的温度响应基因,调控小麦由营养生长向生殖生长转变的发育进程[12-13]。小麦中VRN1基因受低温诱导表达,随着春化时间的延长,VRN1的表达量逐渐增加,直到达到开花所需的量后,才能使植株由营养生长转向生殖生长[14]。可见VRN1对春化作用的响应是具有一定阈值的。袁秀云等[15]对国内不同春化发育特性小麦品种VRN1的基因组成进行分析发现,小麦品种的VRN1基因显隐性组成与该品种的春化发育特性基本符合,说明VRN1的显隐性组成是决定小麦发育特性的主要内在因素。不同生态种植区小麦VRN1的3个等位基因分布比率及组合也不同,这一差异体现了植物适应性的多样性[16-18]。为进一步探究春化基因VRN1在小麦发育进程中的功能,本试验以不同发育特性小麦品种新春2号和京841为材料,分析了VRN1的表达水平,并构建了VRN1 RNA干扰载体,利用农杆菌介导的小麦茎尖转化法进行遗传转化,以期深入探讨VRN1基因在小麦春化阶段的功能,为从分子水平上实现小麦春化特性遗传改良提供理论依据。
1材料和方法
1.1试验材料
春性小麦品种为新春2号,冬性小麦品种为京841。大肠杆菌菌株(Escherichiacoli)为DH5α,克隆载体为pMD19-T,均购自TaKaRa生物公司。农杆菌菌株为EHA105,植物表达载体为pFGC5941载体,均由国家小麦工程技术研究中心保存扩繁。TRIzol等其他试剂均购自宝生物工程(大连)有限公司。
1.2小麦培养及取样
分别选取新春2号和京841成熟饱满大小均一的种子,置于培养皿中,放置于温度为24 ℃的培养箱中。萌动后种植到直径为30 cm的花盆中(花盆中的营养土∶草炭∶蛭石为3∶2∶1),放置在人工气候室中(温度为(22±2)℃,光周期为16 h光照/8 h黑暗)。当2个小麦品种大部分幼苗都处于3叶期(在人工气候室生长3周)时开始取样,并观察幼穗分化进程。每周取一次样,取倒数第二叶,春性品种取样直到小麦穗发育完成(羽毛形成期),冬性品种取样到试验结束为止。每次取样时间均为光照开始后1~2 h,以尽可能避免基因节律表达对表达分析结果的影响。所有样品用液氮速冻后,置于-80 ℃超低温冰箱保存用于RNA提取。
1.3试验方法
1.3.1RNA的提取采用TRIzol试剂提取材料的总RNA。
1.3.2荧光定量PCR(qRT-PCR)分析以各时期所取新春2号和京841的RNA反转录所得cDNA为模板,采用引物VRN1-F、VRN1-R及WAC-F、WAC-R(表1)对VRN1和β-Actin(内参基因)基因进行qRT-PCR扩增。PCR反应系为20 μL,反应程序为:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,40个循环;95 ℃ 15 s。反应在Bio-red CFX96 荧光定量PCR仪上运行,采用2-ΔΔCt方法进行定量分析,每个样品设置3个重复。
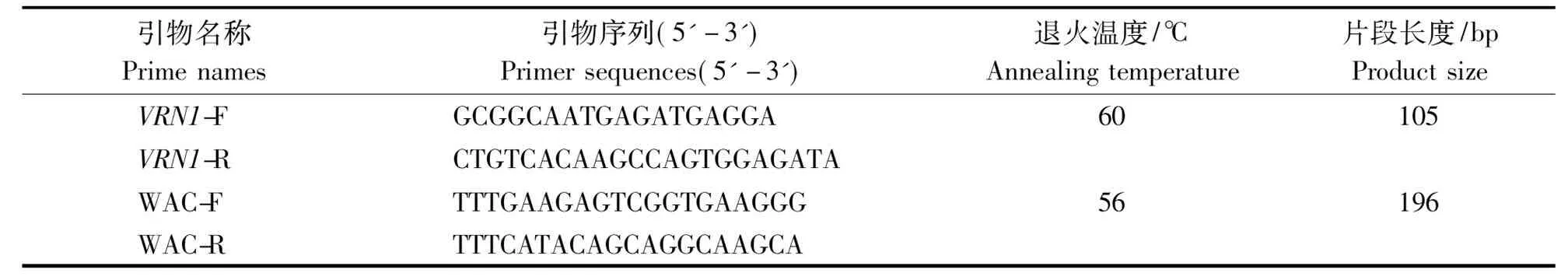
表1 qRT-PCR分析引物
1.3.3VRN1 RNA干扰表达载体的构建用引物对RiV1-F1/RiV1-R1和RiV1-F2/RiV1-R2(表2)扩增出VRN1的cDNA部分正、反向片段,连入pMD19-T载体后转化大肠杆菌DH5α,然后挑选白色菌斑于37 ℃摇菌,提取质粒。先用NcoⅠ/SwaⅠ酶切带有正向片段的pMD19-T载体和pFGC5941载体,然后将酶切得到的正向目的片段与酶切后pFGC5941载体的大片段连接,再转化至大肠杆菌DH5α,挑取白色菌斑于37 ℃摇菌,提取质粒酶切检测,选取正确的阳性克隆进一步进行测序验证。然后用BamHⅠ/SmaⅠ酶切带有反向片段的pMD19-T载体以及已插入正向目的片段的重组pFGC5941载体,并将切下的反向目的片段与已插入正向目的片段的重组pFGC5941载体酶切后的大片段连接,转化至大肠杆菌DH5α,挑取白色菌斑于37 ℃摇菌,提取质粒酶切检测,选取正确的阳性克隆进一步测序验证。

表2 VRN1 RNA干扰表达载体构建及转基因后代检测引物
注:下划线处为酶切位点。
Note:The underline part is the enzyme site.
1.3.4农杆菌介导的茎尖转化及转基因植株的获得选取饱满的新春2号种子进行灭菌,用70%的乙醇浸泡2 min,再用0.1% HgCl2浸泡5 min,无菌水冲洗3~5次。灭菌种子摆放在培养皿中,加适量无菌水在黑暗条件下萌发。同时将构建好的VRN1 RNA干扰表达载体转化农杆菌,挑取单克隆,将经PCR检测及重组质粒酶切验证为阳性的单克隆扩摇,当菌液OD600为1.0时即可用于侵染小麦幼苗茎尖。待小麦幼苗长至2~4 cm时,用灭菌后的手术刀片沿胚根向胚芽鞘伸长方向向下切断维管束,然后水平方向切去胚芽及胚的上半部分,暴露或损伤生长点部位,将幼苗置于含有VRN1 RNA干扰表达载体的农杆菌菌液中浸泡几分钟。用无菌滤纸吸干种子表面的菌液转入新的培养皿中,黑暗条件下共培养2 d后转入光照培养箱中,直至重新长出新叶,在人工气候室培养至成熟。
1.3.5转基因后代的分子检测根据BAR基因设计一对特异引物BAR-F/BAR-R(表2)对转基因后代进行分子检测。经过BAR基因检测为阳性的植株,为鉴定其是否含有插入目的基因,以T1植株DNA为模板,设计跨目的基因和载体序列的特异性引物VRN1-F3/VRN1-R3(表2),对T1转基因小麦植株进行PCR检测。
2结果与分析
2.1不同发育特性小麦品种中VRN1基因的表达水平
从图1可以看出,从三叶期取样开始到取样第5周,新春2号叶片和茎尖中VRN1基因表达量均呈上升趋势;从取样开始到取样第3周,VRN1在茎尖中的表达量低于其在叶片中的表达量,但从取样第4周开始VRN1在茎尖中的表达量超过了叶片,在取样第5周达到最大值,此时新春2号穗发育完成(羽毛形成期)。对于冬性小麦品种京841,叶片中VRN1的表达量总体呈波动上升趋势;在茎尖中的表达量很低,接近0,虽然取样第8,10周叶片中VRN1基因表达量升高,但依然达不到小麦开花所要求的阀值,其幼穗分化一直处于单棱期,说明在未春化条件下,京841不能正常进行穗分化。

图1 VRN1在新春2号和京841中的表达分析
2.2VRN1 RNA干扰载体的构建

用2对引物RiV1-F1/RiV1-R1和RiV1-F2/RiV1-R2分别扩增得到了VRN1 cDNA的部分正(V1-1)、反(V1-2)向片段,大小均为349 bp(图2-A)。连入pMD19-T载体后转化大肠杆菌,挑选阳性克隆,提取质粒。用NcoⅠ/SwaⅠ酶切带有V1-1的pMD19-T载体和pFGC5941载体(图2-B)。然后将酶切得到的V1-1与酶切后pFGC5941载体的大片段连接。用BamHⅠ/SmaⅠ酶切带有V1-2片段的pMD19-T载体以及已插入V1-1片段的重组pFGC5941载体(图2-C),并将切下的V1-2片段与重组pFGC5941载体酶切后的大片段连接。然后转化大肠杆菌,挑选阳性克隆提取质粒,并对获得的重组质粒进行酶切验证(图2-D),进一步经测序比较发现序列完全正确。A.VRN1干扰片段的PCR扩增:M.DL2000 DNA Marker;1~2.扩增的V1-1片段;3~4.扩增的V1-2片段;B.含有V1-1片段的T载体和pFGC5941载体的NcoⅠ和SwaⅠ双酶切:M.DL2000 DNA Marker;1~3.含有V1-1片段的pMD19-T载体和pFGC5941载体经NcoⅠ和SwaⅠ酶切后的片段;2.DL10000 DNA Marker;C.含有V1-2片段的T载体和含有V1-1片段的pFGC5941载体的BamHⅠ和SmaⅠ双酶切:M.DL10000 DNA Marker;1.V1-1和pFGC5941的重组质粒经BamHⅠ和SmaⅠ酶切后的片段;2.pFGC5941和V1-1的重组质粒;3.含有V1-2片段的T载体经BamHⅠ和SmaⅠ酶切的片段;D.VRN1 RNA干扰载体的酶切验证:1.V1-1、V1-2和pFGC5941的重组质粒经NcoⅠ和SwaⅠ酶切的片段;2.V1-1、V1-2和pFGC5941的重组质粒经BamHⅠ和SmaⅠ酶切的片段。
A.VRN1 RNAi gene fragment cloning:M.DL2000 DNA Marker;1-2.V1-1 gene fragment cloning;3-4.V1-2 gene fragment cloning;B.Enzyme digestion of recombined vector pMD19-T and V1-1,pFGC5941 byNcoⅠ andSwaⅠ:M.DL2000 DNA Marker;1,3.Enzyme digestion of recombined vector pMD19-T and V1-1,pFGC5941 byNcoⅠ andSwaⅠ;2.DL10000 DNA Marker;C.Enzyme digestion of recombined vector pMD19-T and V1-2,pFGC5941 and V1-1 byBamH Ⅰ andSmaⅠ:M.DL10000 DNA Marker;1.Enzyme digestion of recombined vector V1-1 and pFGC5941 byBamH Ⅰ andSmaⅠ;2.Recombined vector pFGC5941 and V1-1;3.Enzyme digestion of recombined vector pMD19-T and V1-2 byBamH Ⅰ andSmaⅠ;D.Double digestion of recombined vector:1.Enzyme digestion of recombined vector V1-1,V1-2 and pFGC5941 byNcoⅠ andSwaⅠ;2.Enzyme digestion of recombined vector V1-1,V1-2 and pFGC5941 byBamH Ⅰ andSmaⅠ.
图2VRN1 RNA干扰载体的构建
Fig.2The construction ofVRN1 RNAi vector
2.3转基因后代的分子检测
转基因小麦T0成熟时,单株收获种子。将T1种子栽于人工气候室,待T1长至两叶一心时,喷草铵膦进行筛选。经除草剂筛选后的绿色植株,在生长至五叶期提取叶片DNA。根据BAR基因序列引物,以非转基因新春2号DNA为阴性对照,构建的RNA干扰表达载体质粒为阳性对照,对T1小麦DNA进行PCR检测。由图3可知,转基因阳性植株和阳性对照均扩增出428 bp的目的条带,而未转化成功的植株和阴性对照均未扩增出该目的条带。

M.DL2000 DNA Marker;1.阳性对照;2.阴性对照;3~12.T1转基因植株。
根据跨目的基因和载体序列的特异引物VRN1-F3/VRN1-R3,以构建好的RNA干扰表达载体质粒为阳性对照,pFGC5941质粒为阴性对照,进行PCR扩增。由图4可知,经BAR基因PCR鉴定为阳性的T1植株,多数都能检测到与阳性对照大小一致的条带即401 bp的目的条带,而阴性对照未扩增出目标片段,说明部分转基因T0植株在后代遗传过程中出现导入基因丢失的情况。由图4可知,T1转基因植株中有5株为转基因阳性植株,说明外源基因已转移整合至小麦染色体基因中。
3结论与讨论
春化是小麦发育进程中一个至关重要的阶段。Preston等[19]提出,VRN1在开花调控中分饰不同的角色,春化过程中VRN1在叶片中上调表达能够促进植株开花。据此可知,叶片中VRN1能够感受低温处理,使植株开花,并且当植株移到温暖的环境中时,VRN1在茎尖分生组织中表达量升高,诱导花序发生,同时VRN1在叶片中的表达量下降至春化前的水平。但叶片中VRN1会快速回升并在叶片中保持一定的表达量,以此来阻止VRN2在温暖长日照条件下表达对开花的抑制[19]。本试验分析了VRN1在叶片和茎尖中的表达,发现VRN1在春性小麦品种新春2号叶片和茎尖中的表达量随着生长发育的推进均呈上升趋势,而且在观察阶段后期在茎尖中的表达量超过了在叶片中的表达量。而在冬性小麦品种京841叶片中的表达量总体呈波动上升的趋势,但在茎尖中的表达量很低,说明VRN1在叶片和茎尖中的表达不同步。京841即使在取样第8周和第10周叶片中VRN1稍高的表达量条件下花序并未形成,说明不经过低温春化处理的冬性小麦茎尖中VRN1持续低表达,不能诱导小麦穗发育。

M.DL2000 DNA Marker;1~21.转化小麦T1 DNA;22.阳性对照;23~24.阴性对照。
通过传统杂交来改良小麦冬春性,不可避免地会遇到父母本之间花期不遇等问题。而通过构建植物表达载体,通过遗传转化获得转基因植株,不仅能有效地从分子水平对小麦春化特性进行特异性遗传改良,还为进一步研究基因功能和选育品种提供基础材料[20]。本试验采用小麦幼苗的茎尖分生组织作为转化受体,茎尖分生组织在农杆菌侵染后很容易再生出植株,不需要经过组织培养和植株再生,有效地克服了组织培养过程中基因型障碍造成的难以获得再生植株的缺点,扩大了小麦转化的基因型范围,可根据试验需要选用不同冬春性的品种进行遗传转化[21-23]。与以幼胚及其胚性愈伤组织为受体进行遗传转化相比,此方法还具有试验周期短、取材不受季节限制等优点。但再生植株是嵌合体,在后代遗传过程中导入的基因可能会丢失,因此,在后续试验中的工作重点是要筛选出遗传稳定的转基因纯合株系,观察转基因材料的发育特性以及农艺性状,期待筛选出适合黄淮海麦区种植的优异小麦新种质。
参考文献:
[1]Yan L,Loukoianov A,Tranquilli G,et al.Positional cloning of the wheat vernalization geneVRN1[J].Proceedings of the National Academy of Sciences,2003,100(10):6263-6268.
[2]Yoshida T,Nishida H,Zhu J,et al.Vrn-D4 is a vernalization gene located on the centromeric region of chromosome 5D in hexaploid wheat[J].Theoretical and Applied Genetics,2010,120(3):543-552.
[3]金芬芬,朱灿灿,王翔,等.调控小麦春化发育特性的相关基因研究进展[J].河南农业科学,2012,41(12):1-6.
[4]Fu D,Szücs P,Yan L,et al.Large deletions within the first intron inVRN-1 are associated with spring growth habit in barley and wheat[J].Molecular Genetics and Genomics,2005,273(1):54-65.
[5]Shcherban A B,Efremova T T,Salina E A.Identification of a newVrn-B1 allele using two near-isogenic wheat lines with difference in heading time[J].Molecular Breeding,2012,29(3):675-685.
[6]孙果忠,游光霞,武淑祯,等.小麦春化基因的遗传效应研究[J].华北农学报,2011,26(6):1-5.
[7]郭宪瑞.春化基因Vrn-D1b在中国小麦品种中的分布及其低温处理效应[D].北京:中国农业科学院,2015.
[8]Stelmakh A F.Growth habit in common wheat (TriticumaestivumL.EM.Thell.)[J].Euphytica,1987,36(2):513-519.
[9]杨芳萍,夏先春,张勇,等.春化,光周期和矮秆基因在不同国家小麦品种中的分布及其效应[J].作物学报,2012,38(7):1155-1166.
[10]Pugsley A T.A genetic analysis of the spring-winter habit of growth in wheat[J].Crop and Pasture Science,1971,22(1):21-31.
[11]田芳慧.小麦发育稳定性及重要农艺性状与春化光周期基因的相关性分析[D].杨凌:西北农林科技大学,2013.
[13]Trevaskis B,Bagnall D J,Ellis M H,et al.MADS box genes control vernalization-induced flowering in cereals[J].Proceedings of the National Academy of Sciences,2003,100(22):13099-13104.
[14]Danyluk J,Ndjido A K,Ghislain B,et a1.TaVRT-1,a putative transcription factor associated with vegetative to reproductive transition in cereals[J].Plant Physio-logy,2003,132:1849-1860.
[15]袁秀云,李永春,孟凡荣,等.九个春化作用特性不同的小麦品种中VRN1 基因的组成和特性分析[J].植物生理学通讯,2008,44(4):699-704.
[16]Sun Q M,Zhou R H,Gao L F,et al.The characterization and geographical distribution of the genes responsible for vernalization requirement in Chinese bread wheat[J].Journal of Integrative Plant Biology,2009,51(4):423-432.
[17]姜莹,黄林周,胡银岗.中国小麦地方品种春化基因的分布及其与冬春性的关系[J].中国农业科学,2010,43(13):2619-2632.
[18]曹新有,刘建军,程敦公,等.小麦品种冬春性,抗寒性与广适性的关系[J].麦类作物学报,2012,6:36.
[19]Preston J C,Kellogg E A.Discrete developmental roles for temperate cereal grass VERNALIZATION1/FRUITFULL-like genes in flowering competency and the transition to flowering[J].Plant Physiology,2008,146(1):265-276.
[20]梁欣欣,刘录祥,赵林姝,等.农杆菌介导法向小麦茎尖导入DREB1A基因的研究初报[J].麦类作物学报,2007,27(1):16-19.
[21]黄益洪,叶兴国.农杆菌介导法获得小麦转基因植株的研究[J].作物学报,2002,28(4):510-515.
[22]王维,郎明林,杨学举.小麦转基因技术及转化功能基因研究进展[J].中国农学通报,2012,28(18):1-6.
[23]陈新,孟晓丹,王亚英,等.转反义trxs基因小麦分子鉴定及抗穗发芽株系的筛选[J].河南农业科学,2013,42(4):19-23.
RNA Interference Vector Construction ofVRN1 Gene and Obtaining Transgenic Wheat
ZHANG Baona1,ZHU Cancan2,ZHANG Pengyu1,WEI Li2,WANG Xiang2,JIANG Yumei2,WANG Tongchao1
(1.Agronomy College of Henan Agricultural University,Zhengzhou450002,China;2.National Engineering Research Centre for Wheat,Henan Agricultural University,Zhengzhou450002,China)
Abstract:In order to study the biological function of VRN1 in wheat developmental process,VRN1 expression patterns were analyzed using fluorescence quantitative RT-PCR in two vernalization characteristic varieties Xinchun No.2 and Jing 841.The results showed that the VRN1 transcription levels increased gradually in Xinchun No.2 leaves and shoot meristems.While the VRN1 transcription levels in Jing 841 leaves showed a wavelike rises,but the expression level in shoot meristems was very low and nearly zero.The VRN1 RNA interference sequence was successfully introduced into vector pFGC5941,and the recombined vector was transferred into the shoot apical meristem of Xinchun No.2 by Agrobacterium-mediated transformation.Transgenic plants were detected by PCR amplification,which could lay a foundation for genetic improvement of wheat developmental characteristics on molecular level and created new wheat germplasm for wheat breeding.
Key words:Wheat;Vernaliazation gene VRN1;Expression;Transformation
doi:10.7668/hbnxb.2016.01.010
中图分类号:S512.03;Q78
文献标识码:A
文章编号:1000-7091(2016)01-0057-06
作者简介:张宝娜(1988-),女,河南杞县人,在读硕士,主要从事小麦发育研究。通讯作者:王同朝(1964-),男,河南社旗人,教授,博士,主要从事作物生理生态研究。
基金项目:国家“十二五”科技支撑计划项目(2012BAD14B08;2012BAD04B07);国家自然科学基金项目(31471452)
收稿日期:2015-11-19

