长链烷烃脱氢制单烯烃动力学模型
江洪波,张 晴,周立群,王 玉,曹 晶
(1.华东理工大学 石油加工研究所,上海200237;2.中国石化金陵石化有限责任公司烷基苯厂,江苏 南京210046)
长链烷烃脱氢制单烯烃动力学模型
江洪波1,张晴1,周立群2,王玉2,曹晶2
(1.华东理工大学 石油加工研究所,上海200237;2.中国石化金陵石化有限责任公司烷基苯厂,江苏 南京210046)
摘要:根据长链烷烃催化脱氢反应机理,采用某新型国产长链烷烃脱氢催化剂,建立了工业反应条件下的直链烷烃脱氢制单烯烃表观反应动力学模型和催化剂失活模型。以在轴向连续流动固定床微型反应器中 C10~C13直链烷烃脱氢反应的实验数据为基础,采用多元函数包维尔(Powell)法优化计算了反应速率常数、失活速率常数、失活级数与活化能,实验值与计算值拟合效果良好。动力学模型参数分析表明了所建模型动力学与热力学的合理性。 应包含正文的要点,一般来说,应该包含研究目的、研究方法、得到的结果和最后的结论4部分。写英文摘要时,不能因为某些内容不好翻译就弃掉要点;摘要应尽量简洁,尽可能删掉课题研究的背景信息;摘要中出现的数据应该是最重要、最关键的数据;不需要自己标榜自己的研究结果;二次文献信息将脱离原文而独立存在,因此摘要中不能出现图表数据;摘要中的内容应在正文中出现,摘要不能对原文进行补充和修改;摘要中的缩写名称在第1次出现时要有全称;摘要中的句子应尽量简短,主谓语要搭配。
关键词:长链烷烃;脱氢;表观动力学;失活;模型
长链烷烃催化脱氢制取长链单烯烃,进而与苯烷基化生产的长链烷基苯是合成洗涤剂的主要原料,且长链烷基苯的生物降解率高[1]。因此,长链烷烃催化脱氢制取长链单烯烃在合成洗涤剂工业中占有重要地位。
长链烷烃催化脱氢制长链单烯广泛使用的生产工艺是美国环球油品公司(UOP)开发的Pacol工艺[2]。该工艺采用非酸性Pt系催化剂,得到的反应产物是一个组成十分复杂的混合物,除了催化脱氢生成目标产物正构单烯烃外,异构反应和连续脱氢反应的发生会生成其他副产物。另外,长链烷烃转化率低,如提高反应温度,则单烯烃选择性降低,会生成较多的裂解产物、双烯烃及芳烃;如提高氢压,长链烷烃转化率将更低。
关于长链烷烃的脱氢反应动力学,国外已有不少研究报道。在20世纪80年代,俄罗斯学者对正癸烷与正构十一、十二烷烃在Pt系催化剂催化下脱氢制取单烯烃反应与失活动力学进行了大量研究[3-5],所建动力学模型反应组分计算值与实验值标准偏差在20%~30%范围;20世纪90年代以后,印度、伊朗、俄罗斯等国学者对C9~C14直链烷烃脱氢制烯烃动力学进行了更详细的报道[6-8],但大多为直链烷烃脱氢反应动力学,同时研究反应动力学与催化剂失活动力学的不多。国内关于直链烷烃脱氢制烯烃动力学方面的研究较少。1980年,张高勇等[9]采用绝热固定床研究了长直链烷烃催化脱氢主反应表观动力学和失活表观动力学;1985年,康保安等[10]将整个体系的副反应考虑在内,研究了长链烷烃脱氢反应动力学。
在本研究中,笔者针对长链烷烃催化脱氢工业反应条件,采用某新型国产长链烷烃脱氢催化剂,建立了直链烷烃催化脱氢表观反应动力学模型和催化剂失活模型,对产物进行集总分析,并对模型参数进行了优化计算。
1实验部分
1.1 原料
C10~C13直链烷烃混合物,纯度99.5%以上,其中C10、C11、C12、C13直链烷烃摩尔分数分别为6.7%、30.5%、38.4%、24.4%;氢气,纯度大于95%,进脱氢反应器前经分子筛精制。
1.2 实验装置和条件
采用轴向连续流动固定床微型反应器进行动力学实验。反应器为φ25 mm×6 mm、长60 cm的不锈钢管。在与工业长链烷烃催化脱氢反应条件相近、未消除催化剂内外扩散条件下进行实验,反应压力0.1 MPa、氢/烃摩尔比5.79。原料体积流率不变,通过改变催化剂装填体积而改变空速大小。
1.3 催化剂
某新型国产长链烷烃脱氢催化剂,负载主元素为Pt,载体为γ-Al2O3。催化剂密度0.86 g/mL。
1.4 分析仪器
日本岛津GC-2010Plus气相色谱仪,配有毛细管色谱柱和氢火焰离子化检测器,分析样品为两次采样之间的混合样。
2长链烷烃脱氢制单烯烃动力学模型的建立
2.1 模型集总的划分与反应网络的建立
直链烷烃催化脱氢反应原料为 C10~C13直链烷烃混合物,除了生成目标产物不同碳数长链单烯烃外,连续脱氢生成二烯、三烯、多烯直至生成氢和焦炭,异构化、环化和芳构化反应生成异构烷烃、异构烯烃、环烷烃、环烯烃和芳烃,裂解反应生成低碳数烷烃与烯烃。因分析条件所限,不能对所有组分达到分子尺度的测定,根据组分所具有的反应动力学特性,使用集总动力学来研究该反应体系最为合适[11]。根据Pacol工艺脱氢反应机理、气相色谱仪分析的实验数据及相关文献[6,12],对反应物与产物进行集总,建立了C10~C13直链烷烃催化脱氢6集总反应动力学模型反应网络,如图1所示。

图1 C10~C13直链烷烃催化脱氢制单烯烃反应网络
2.2 反应动力学方程与催化剂失活方程的建立
C10~C13直链烷烃脱氢制单烯烃反应网络复杂,为合理简化反应动力学模型,根据长链烷烃催化脱氢反应机理,对反应动力学模型作5点基本假定。(1)物料以平推流形式流经轴向固定床反应器;(2)不考虑分子的径向扩散;(3) 催化脱氢反应段处于恒温区,不考虑热效应对直链烷烃转化率的影响;(4)所有反应均在相同的金属活性中心上进行;(5) 脱氢反应为单分子反应,加氢及裂解反应为双分子反应。
在长链烷烃催化脱氢制单烯烃反应过程中,因反应体系中二烯烃、芳烃等在催化剂表面连续脱氢生成大分子聚合物使催化剂表面结焦,导致催化剂活性降低。为合理描述该反应体系,建立催化剂失活方程,结焦引起的催化剂失活可视为独立失活机理[11],使用分离动力学形式。
在本实验中,反应条件与工业脱氢反应条件相近,工业脱氢反应条件下催化剂内外扩散不能够完全消除,因此本动力学研究不考察催化剂内外扩散,所建反应方程为表观反应动力学方程。由反应动力学模型基本假定和催化剂独立失活机理,推导得到分离动力学模型方程。式(1)为表观反应动力学方程,式(2)为催化剂失活方程。
(1)
(2)
当d≠1时,可对式(2)进行积分,得到a随催化剂使用时间的变化关系式(3)。
(3)
由式(1)、(3)及相关文献[6,9-10,12]与假设,可得到C10~C13直链烷烃脱氢制单烯烃表观动力学模型为式(4)~(10)。
k-3CnsCH2-k5CpsCH2-k9Cps)·a
(4)
k-2CdsCH2+k4Cns-k6CmsCH2-k10Cms)·a
(5)
k7CnsCH2-k11Cns-k12Cns+k-12CdsCH2)·a
(6)
k12Cns-k-12CdsCH2)·a
(7)
(8)
(9)
2k8Cds+k3Cps-k5CpsCH2-k6CmsCH2-
k7CnsCH2-k-3CnsCH2+4k9Cps+3k10Cms+
3k11Cns+k12Cns-k-12CdsCH2)·a
(10)
2.3 模型参数的确定
C10~C13直链烷烃催化脱氢制单烯烃表观动力学模型中有15个反应速率常数,催化剂失活速率常数和级数各1个,即有16个指前因子和16个活化能(15个反应活化能与1个失活活化能)。采用文献所介绍的方法[13]计算直链烷烃生成直链单烯烃的反应平衡常数,根据计算出的正、逆反应速率常数计算其他可逆副反应的平衡常数。
采用自适应变步长龙格库塔法[14]求解动力学微分方程。求解微分方程得到的是某一具体时刻所对应的组分浓度,采样分析出的实验数据是某个组分在一个时间段内浓度的平均值,为了使求解微分方程得到的组分浓度与组分的实验值对应,使用高斯六点积分处理1个时间段内求解微分方程得到的6个时刻点的组分浓度。
采用多元函数包维尔(Powell)法进行函数最优化[14],优化目标函数如式(11)所示。根据最优化原则确定模型的各个动力学参数。
(11)
3C10~C13直链烷烃催化脱氢反应动力学模型参数计算和相应实验
3.1 反应条件
为了求取C10~C13直链烷烃脱氢制单烯烃表观动力学模型参数,动力学实验反应条件如表1所示。
3.2 结果与讨论
3.2.1模型参数计算结果
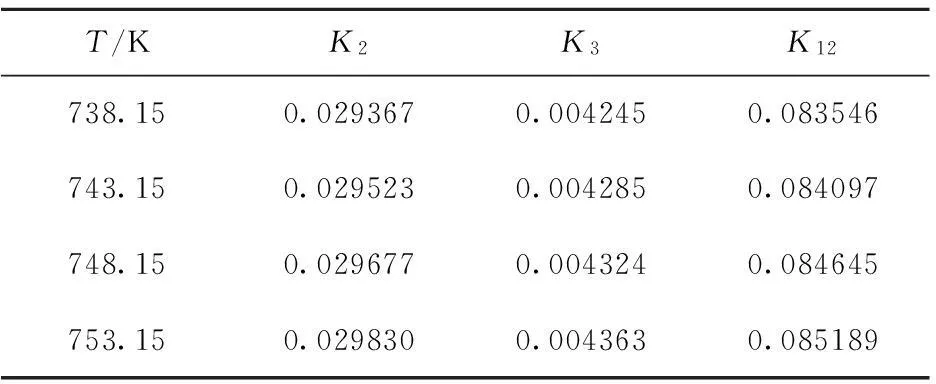
根据表1中实验编号1-5的反应条件计算761.15 K、不同体积空速下的反应速率常数(k)、失活速率常数(kd)与失活级数d,结果列于表2、表3。
为了使建立的模型预测不同温度下各组分浓度,需确定反应和催化剂失活的活化能(E)与指前因子(k0)。使用表1中实验编号6-9的反应条件计算活化能与指前因子,计算结果也列于表2。
反应速率常数大小表示一个反应的快慢,从表2可以看出,(1)直链烷烃脱氢生成直链单烯烃的反应速率远大于其生成非正构单烯烃和裂解产物的反应速率,说明直链烷烃催化脱氢过程中生成直链单烯烃的反应为主反应;(2)直链单烯烃和非正构单烯烃脱氢生成二烯烃的反应速率相差不多,但前者略大于后者,说明二次脱氢过程中直链单烯烃更易被催化剂活性中心吸附而发生脱氢反应;(3)二烯烃脱氢生成芳烃的反应速率远远大于直链烷烃、直链单烯烃和非正构单烯烃的反应速率,说明在二烯烃较易脱氢生成芳烃产物,而其他连续多次脱氢反应则较难;(4)直链烷烃裂解反应速率大于直链单烯烃和非正构单烯烃裂解速率,说明直链烷烃较易在催化剂活性中心发生加氢裂解。以上反应速率大小均符合长链烷烃脱氢反应特点[15]。

表1 动力学实验反应条件
LHSV—Liquid space velocity;C0—Concentration of feed component;F0—Total feed molar flow rate
p=0.1 MPa;n(H2)/n(Oil)=5.79;F0=2.74 mol/h
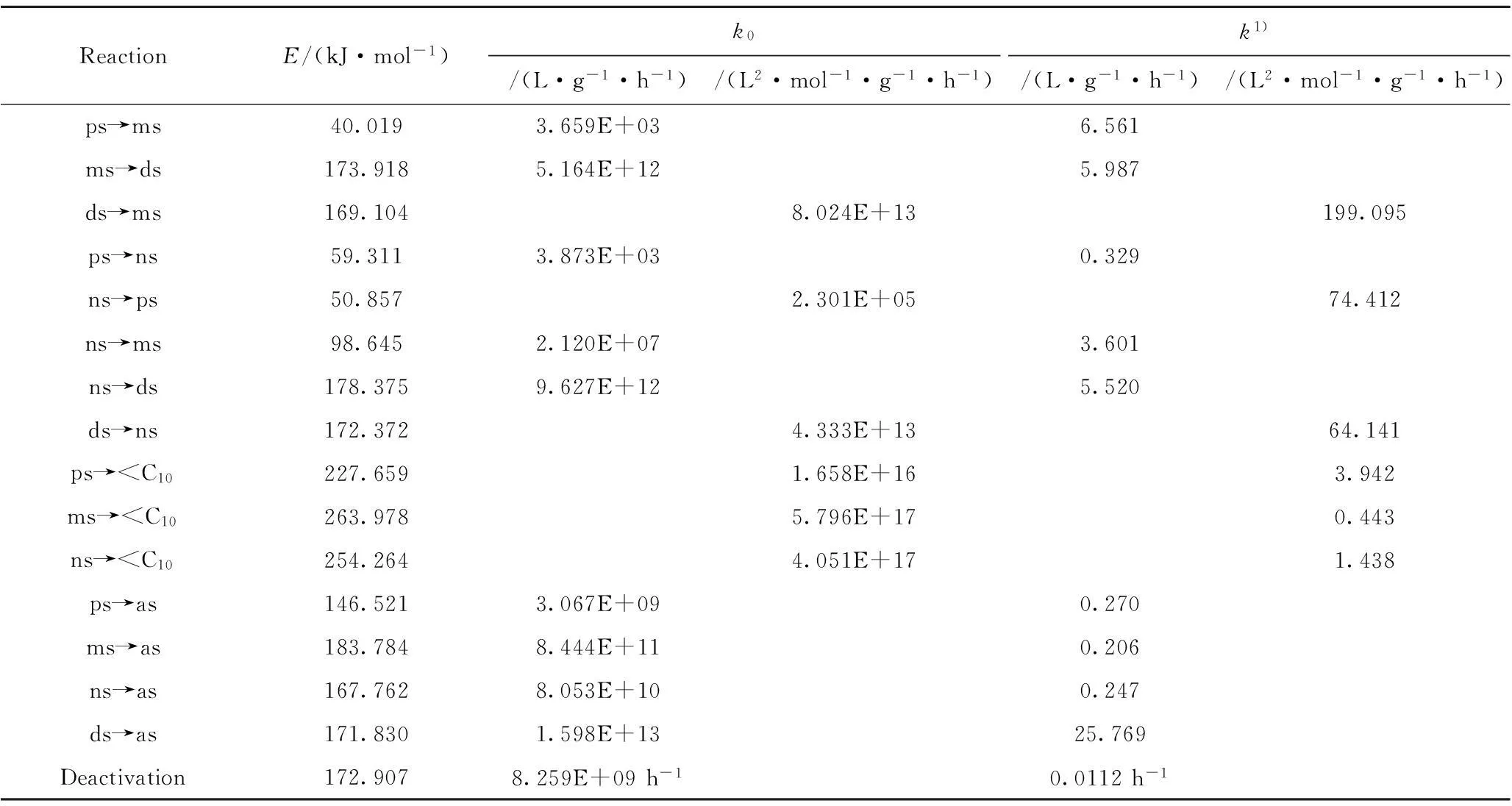
表2 C10~C13直链烷烃催化脱氢反应动力学模型参数
1)T=761.15 K

表3 C10~C13直链烷烃催化脱氢反应
活化能表示反应进行难易程度及受温度的影响程度,从表2可以看出,(1)直链烷烃脱氢生成直链单烯烃的活化能最小,说明直链烷烃较易脱氢生成直链单烯烃,且是主要反应。直链烷烃脱氢生成非正构单烯烃的活化能,大于生成直链单烯烃的活化能,因异构单烯烃需由异构反应产生,所需克服的反应能垒大于生成直链单烯烃的反应能垒;小于其他脱氢反应的活化能,说明直链烷烃更易脱氢生成单烯烃;(2)直链单烯烃和非正构单烯烃二次脱氢生成二烯烃的活化能相差不多,但远大于直链烷烃一次脱氢反应活化能,说明二次脱氢反应所需克服的反应能垒更大,所需反应温度更高;(3)直链单烯烃和二烯烃生成芳烃的活化能大于直链烷烃和非正构单烯烃生成芳烃的活化能,因其反应路径不同而活化能大小不同,前者先发生逐步脱氢反应而后环化生成芳烃,后者先发生环化反应而后脱氢生成芳烃;(4)直链烷烃、直链单烯烃和非正构单烯烃加氢裂解反应活化能均大于其他脱氢反应活化能,说明裂解反应发生所需克服的反应能垒较大,所需温度较高,而直链烷烃的裂解活化能均小于直链单烯烃和非正构单烯烃裂解活化能,故直链烷烃更容易发生裂解反应。
从表2还可以看出,相同空速下,催化剂失活活化能为正数,且数值较大,说明催化剂失活速率随反应温度升高而加快,且受温度影响比较明显。为了提高直链烷烃生成直链单烯烃的转化率,反应温度不宜过高,而由阿伦尼乌斯方程可知,温度是影响反应速率的关键因素,温度越高脱氢反应速率越快,所以,存在使目标产物收率和反应速率达到最佳值的最优反应温度。同样,催化剂失活速率常数大小也用来表示催化剂活性变化快慢。从表3可以看出,相同温度、不同体积空速的反应条件下,体积空速越大,催化剂活性变化越慢。因此,合理控制空速大小对于提高催化剂的寿命和主要产物的收率有重要影响。
3.2.2实验值与模型计算值比较
每一个反应条件下,催化剂的使用时间为67 h,共有9次采样分析数据。因文章篇幅所限,不同催化剂使用时间下,对相同温度、不同体积空速的反应条件只作出了21.8 h-1下各组分摩尔分数实验值与计算值的比较;对相同体积空速、不同温度的反应条件下只作出753.15 K下各组分摩尔分数实验值与计算值的比较,结果分别示于图2、图3。不同反应条件下,单组实验数据中各组分摩尔分数的平均相对偏差列于表4。从图2、3和表4可以看出,反应物直链烷烃和目标产物直链单烯烃摩尔分数实验值的平均相对偏差较小,二者的实验值和计算值也吻合较好;其他副产物因摩尔分数较小,导致实验值的平均相对偏差较大一些,二者的实验值和计算值也有一些差别。总的来看,实验值与计算值拟合结果良好,所求动力学模型参数可靠。

图2 761.15 K、21.8 h-1条件下直链烷烃催化脱氢反应产物各组分摩尔分数计算值与实验值
SerialnumberRelativedeviation/%n-Paraffins(ps)n-Olefins(ms)i-Olefins(ns)Diolefins(ds)Gases( 3.2.3平衡常数 脱氢反应为吸热反应,直链烷烃生成直链单烯烃的反应平衡常数由文献[13]计算得到,直链单烯烃生成双烯烃(K2)、直链烷烃生成非正构单烯烃(K3)、非正构单烯烃生成双烯烃(K12)的平衡常数由Ki=ki/k-i计算得到。表5为压力0.1 MPa、体积空速21.8 h-1和氢/烃摩尔比5.79时,不同反应温度下副产物烯烃的平衡常数。从表5可以看出,平衡常数随温度的升高而增大。所以,计算得到的动力学参数在热力学上也是合理的。 表5 不同反应温度下直链烷烃催化脱氢反应 p=0.1 MPa; LHSV=21.8 h-1;n(H2)/n(Oil)=5.79 4结论 (1) 根据长链烷烃催化脱氢反应机理,采用某新型国产长链烷烃脱氢催化剂,建立了基于工业脱氢反应条件下的C10~C13直链烷烃催化脱氢制单烯烃表观反应动力学模型与催化剂失活模型。本模型根据产物所具有的反应动力学特性进行集总,减少了动力学参数求解个数,并提高了精确度与可靠性。 (2) 采用Powell法对反应速率常数、失活速率常数与级数、活化能进行了优化计算,所建动力学模型的计算值与实验值误差均在合理的范围内。 (3) 只对体积空速和温度对催化剂活性的影响做了相关计算分析,而压力、氢/烃摩尔比对催化剂活性也有一定的影响,在后续工作中将会对其进行相关计算分析。 符号说明: A、B—— 物质A和B; a——催化剂的活性; as——集总组分:芳烃; C0——进料组分的总摩尔浓度,mol/L; CA、CB——物质A和B的摩尔浓度,mol/L; Cas——芳烃(as)的摩尔浓度,mol/L; C Cds——双烯烃(ds)的摩尔浓度,mol/L; CH2——氢气(H2)的摩尔浓度,mol/L; Cms——直链单烯烃(ms)的摩尔浓度,mol/L; Cns——非正构单烯烃(ns)的摩尔浓度,mol/L; Cps——直链烷烃(ps)的摩尔浓度,mol/L; d——失活级数; ds——集总组分:双烯烃; E——活化能,kJ/mol; F0——组分的总进料摩尔流速,mol/h; H2——氢气; i——集总组分中的某一个组分; K2——直链单烯烃生成双烯烃的平衡常数; K3——直链烷烃生成非正构单烯烃的平衡常数; K12——非正构单烯烃生成双烯烃的平衡常数; Ki=ki/k-i——平衡常数的计算; k——反应速率常数; k0——指前因子; kd——失活速率常数; ki——组分i的正反应速率常数; k-i——组分i的逆反应速率常数; l1、l2——反应级数; ms——集总组分:直链单烯烃; ns——集总组分:非正构单烯烃; ps——集总组分:直链烷烃; Q——各组分摩尔分数的相对偏差之和; -rA——物质A的反应速率; T——反应温度,K; t——催化剂的使用时间,h; LHSV——液时体积空速,h-1; W——催化剂质量,g; x——各组分的摩尔分数; xi,cal——集总组分i的计算值,摩尔分数; xi,exp——集总组分i的实验值,摩尔分数; z——集总组分的个数; τ=WC0/F0——实际空时,(g·h)/L。 参考文献 [1] MANSOURPOUR Z, SAHEBDELFAR S, SAEEDIZAD M. 11th National Chemical Engineering Congress[C]//TarbiatModarres University, Tehran, Iran, December, 2006. [2] 陈向前. 烷基苯生产和应用[M].北京:中国石化出版社,1994. [3] KRYLOVA T L, NEKRASOV N V, GUDKOY B S, et al. Mechanism and kinetics of dehydrogenation of highern-paraffins on promoted platinum catalysts I Hydrogen/deuteriumisotope exchange inn-decane [J]. Kinet Catal (Engl Transl), 1980, 21(6): 1482-1486. [4] SADYKHOVA Z A, NEKRASOV N V, GUREVICH V R, et al. Mechanism and kinetics of dehydrogenation of highern-paraffin on promoted platinum catalysts V. Kinetics of dehydrogenation ofn-undecane andn-dodecane on a platinum-tin catalyst [J]. Kinet Catal (Engl Transl), 1984, 25(3): 593-597. [5] MART’YANAOVA S K, GAIDAI N A, KOSTYUKOVSKII M M, et al. Mechanism and kinetics of dehydrogenation of highern-paraffins on promoted platinum catalysts IV. Kinetic study of coke formation in dehydrogenation ofn-decane on platinum-alumina catalyst [J].Kinet Catal (Engl Transl), 1982, 23(4): 907-912. [6] FRANTAINA E V, AFANASJEVA J I, IVANCHINA E D, et al. Simulator development of industrial process of normal alkanes C9-C14dehydrogenation using methods of quantum chemistry [J]. Petroleum & Coal, 2010, 52(2): 129-138. [7] PADMAVATHI G, CHAUDHURI K K, RAJESHWER D, et al. Kinetics ofn-dodecane dehydrogenation on promoted platinum catalyst[J]. Chemical Engineering Science, 2005, 60(15):4119-4129. [8] SAEEDIZAD M, SAHEBDELFAR S, MANSOURPOUR Z. Deactivation kinetics of platinum-based catalysts in dehydrogenation of higher alkanes[J]. Chemical Engineering Journal, 2009, 154(1):76-81. [9] 张高勇,刘骥, 唐鸿鑫.长链烷烃脱氢主反应及其失活过程表现动力学研究[J].燃料化学学报,1983,11(2):48-57.(ZHANG Gaoyong, LIU Ji, TANG Hongxin. Study on the apparent dynamics of reaction and deactivation of highern-paraffins [J]. Journal of Chemical Fuel, 1983, 11(2):48-57) [10] 康保安,唐鸿鑫, 张高勇,等.长链烷烃脱氢动力学的研究[J].日用化学工业,1986,1(3):1-6.(KANG Baoan, TANG Hongxin, ZHANG Gaoyong,et al. Study on the dynamics of highern-paraffins [J]. Daily Chemical Industry, 1986, 1(3):1-6.) [11] 朱炳晨,翁惠新, 朱子彬.催化反应工程[M].北京:中国石化出版社,2000. [12] KRAVTSOVA V, IVANCHINAE D, IVASHKINAEN, et al. Reactor block operation analysis and efficiency prediction in paraffins dehydrogenation process with use of technological modeling system [J]. Petroleum & Coal, 2010, 52(2): 155-163. [13] 张高勇,刘骥. C9-C14烷烃脱氢主反应热力学计算—长链正构烷烃脱氢热力学分析Ⅰ[J].日用化学工业,1983,(3):7-12.(ZHANG Gaoyong, LIU Ji. Thermodynamics calculation of C9-C14paraffins dehydrogenation main reaction—Thermodynamic analysis of heavy paraffins dehydrogenation[J]. Daily Chemical Industry, 1983, (3):7-12.) [14] 何光渝. VB常用算法大全[M].西安:西安电子科技大学出版社,2001. [15] 刘爱兵. 长链正构烷烃在陶瓷膜反应器中的脱氢反应[D].大连:大连理工大学,1996. Ei 对中英文摘要的要求 Kinetic Model of Heavy Paraffin Dehydrogenation to Mono-olefins JIANG Hongbo1, ZHANG Qing1, ZHOU Liqun2, WANG Yu2, CAO Jing2 (1.ResearchInstituteofPetroleumProcessing,EastChinaUniversityofScienceandTechnology,Shanghai200237,China; 2.LABPlantofJinlingPetrochemicalCorporationofSINOPEC,Nanjing210046,China) Abstract:Based on the reaction mechanism of heavy paraffin catalytic dehydrogenation, with a new domestic catalyst of paraffin dehydrogenation as research objective, apparent reaction kinetic model and catalyst deactivation model of heavy paraffins dehydrogenation to mono-olefins were established under industrial reaction conditions. Based on the experimental data of C10—C13paraffins dehydrogenation in an axial continuous flow fixed bed microreactor, the reaction rate constants, deactivation rate constants, deactivation order and activation energy were calculated by multivariate function Powell method, and the fitting effect of experimental values and calculated values is good. The analysis of kinetic model parameters showed the rationality of kinetics and thermodynamics. Key words:heavy paraffins; dehydrogenation; apparent reaction kinetics; deactivation; model 中图分类号:TE65;O0643.1 文献标识码:A doi:10.3969/j.issn.1001-8719.2016.01.021 文章编号:1001-8719(2016)01-0156-08 收稿日期:2014-10-22 通讯联系人: 江洪波,男,副教授,博士,从事石油加工动力学研究;E-mail:hbjiang@ecust.edu.cn