一种新型腰椎可降解椎间融合器的体外生物力学评价*
韩振川熊森张雅斌王博顾挺帅张权李修璨王旭翾毛克亚*
一种新型腰椎可降解椎间融合器的体外生物力学评价*
韩振川1熊森1张雅斌1王博2顾挺帅1张权1李修璨1王旭翾1毛克亚1*
目的 介绍一种新型腰椎可降解椎间融合器(cage)的设计理念和结构,对其生物力学性能进行初步评价。方法采用新型可降解骨水泥-磷酸镁水泥(Magnesium phosphate cement,MPC)经过特殊模具压缩凝固成可降解椎间融合器作为实验组(n=8),大小型号相同聚醚醚酮(PEEK)椎间融合器(n=8)及取猪髂骨块做成的三面皮质骨椎间融合器(n=8)作为对照组,利用Instron 10000N生物力学机做压缩载荷测试。当各组椎间融合器受压丢失椎间融合器高度1/3时即判定为椎间融合器失效,记录椎间融合器的轴向压缩栽荷及其刚度。若未达到丢失高度1/3时即发生椎间融合器损毁的,记录损毁时的位移、轴向压缩栽荷及其刚度。结果MPCcage组压缩损毁时丢失的高度明显小于PEEK cage组及髂骨块cage组,差异有显著统计学意义(<0.01);MPC cage组压缩损毁时所承受载荷明显高于PEEK cage组及髂骨块cage组丢失高度1/3时所承受载荷,差异存在显著统计学意义(<0.01);MPC cage自身刚度远远高于PEEK cage及髂骨块cage,差异存在显著统计学意义(<0.01)。结论 磷酸镁可降解椎间融合器(MPCcage)具有优良的抗形变能力及能够承受较大的压力载荷,能够提供人体腰椎间隙的支撑-压缩稳定作用,能满足临床植入的生物力学要求。
生物力学;可降解材料;椎间融合器;磷酸镁水泥
脊柱融合是治疗退行性脊柱疾病保守治疗失败后的常规治疗选择。椎间融合器不仅可以提供融合椎体间的稳定性,还可以限制移植骨的活动及恢复椎间隙高度和体积,扩大椎间孔,提高了融合率,有效地缓解了椎间盘内压力和疼痛[1,2]。Bagby等于1979年发明了一种称为Basket的圆柱形带孔不锈钢椎体间融合器,用于治疗赛马颈椎不稳定引起的共济失调获得成功[3]。Kuslich于1988年将其应用于人的腰椎,成为历史上著名的 BAK融合架[4]。随着椎间融合器(cage)在脊柱外科手术中的广泛使用,学者们发现金属cage其弹性模量与人椎体骨差别巨大,应力遮挡效应明显,不利于椎体间融合;高分子材料cage具有与皮质骨相近的弹性模量,可透过 X线,长期临床应用效果良好,但其无法降解吸收,植入体内有发生远期并发症的风险[5]。这些问题促使学者们开始寻找一种弹性模量与人体皮质骨相近,并随着时间延长可在人体内被自体骨吸收替代的新型材料来制作椎间融合器。新型的骨粘合剂-磷酸镁骨水泥(MPC)因具有粘结性能好[6]、生物相容性高、反应得到的固化产物对环境pH影响小[7]、可以在动物体内降解[8]、相较于磷酸钙骨水泥具有更好的力学性能[9]等优点,备受关注。本研究设计了一种用磷酸镁骨水泥制作新型腰椎椎间融合器-MPC椎间融合器,将其与己广泛应用于临床的PEEK材料cage及猪髂骨块(鉴于新鲜人髂骨获取困难,以此代替)进行体外力学比较,进而对MPCcage体外力学性能进行初步评价,体外力学特征是体内评价的基础和前期研究。
1 材料与方法
1.1 材料
MPC cage采用可降解新型无机骨水泥磷酸镁骨水泥作为制作材料,经特殊模具一次压缩成型。其外形设计借鉴非吸收型 PEEK腰椎间融合器特点。制作出箱状实心 MPC cage,cage头端有30°的倾斜度,便于打入椎间隙内,上下终板接触面带有1.0mm高的咬合齿。规格:长×宽×高:20mm ×9mm×7mm,见图1。PEEKcage由 DePuySynthes公司提供,规格:长×宽×高:20mm×9mm×7mm。猪髂骨选自实验动物猪长白猪,制作为三面皮质骨cage,规格:长×宽×高:20mm×9mm×7mm。

图1 磷酸镁cage样品外观
1.2 力学实验
使用 Instron 10000N生物力学测试系统对 MPC cage、PEEKcage及猪髂骨块行压缩载荷测试,每组样本n=8。在25℃室温下,将椎间融合器置于万能力学测试机上,cage的上下糙面与万能力学测试机上下压板相对。操作方法为:以1mm/min速度加压,当测试cage被压缩丢失高度1/3时停止(cage被压缩2mm)测试,位移传感器自动记录每次载荷与位移变化。若丢失高度未达到 cage高度1/3时即发生损毁的,记录损毁时载荷及对应位移,计算出各组融合器的刚度(N/mm)。见图2。

图2 3组cage压缩试验
1.3 评价方法
3组椎间融合器均行同一实验,记录并计算出位移(mm)、载荷(N)及其刚度(N/mm)。刚度是指材料或结构在受力时抵抗弹性变形的能力,是材料或结构弹性变形难易程度的表征,刚度越大说明材料抵抗弹性变形的能力越强。对3组cage刚度(N/mm)、压缩载荷(N)、位移(mm)加以比较分析,采用SPSS19.0统计软件(SPSS公司,美国)进行分析,所有计量资料用均数±标准差(±s)表示,实验数据经正态性检验及方差齐性检验,不符合方差齐性,所以采用非参数成组资料秩和检验,<0.05为差异有统计学意义,<0.01为差异有显著统计学意义。
2 结果
3组cage力学实验后位移、载荷、刚度数据的比较。见表1。

表1 3组cage位移、载荷、刚度比较
MPC cage组压缩位移未达到2mm时均发生碎裂损毁,压缩位移明显小于PEEK cage组及猪髂骨cage组,差异有显著统计学意义(<0.01),PEEK cage组及猪髂骨cage组均发生2mm压缩形变。MPCcage组在压缩损毁时的压缩载荷(4976.34±302.09)N显著大于PEEK cage组(4076.46± 439.78)N及猪髂骨 cage组(350.70±27.18)N压缩位移2mm时的载荷,差异同样存在显著统计学意义(<0.01);PEEK cage组压缩载荷也显著大于猪髂骨cage组,差异存在统计学意义(<0.01)。MPC cage组刚度显著高于PEEK cage组及猪髂骨cage组,差异存在显著统计学意义(<0.01)。见表2。
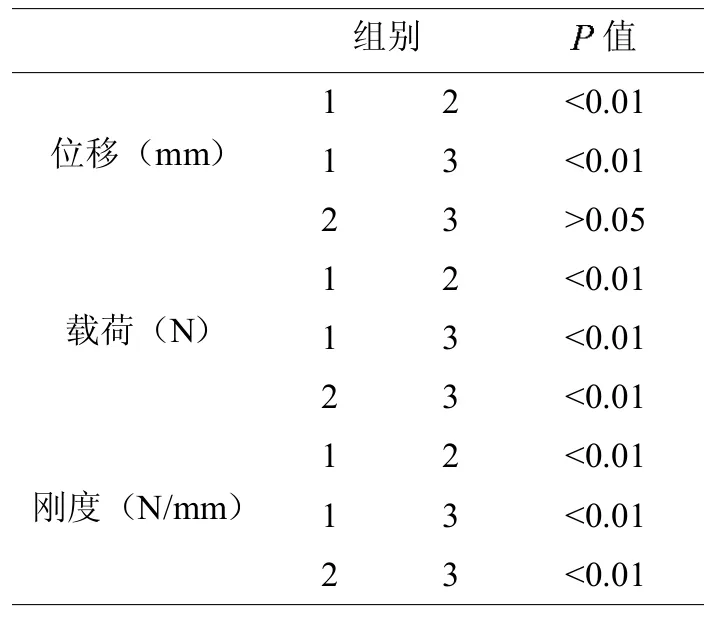
表2 位移、载荷、刚度组间比较
实验结束后不同cage形变情况。可见MPCcage发生碎裂,PEEK cage组及猪髂骨cage组均发生2mm压缩形变,并且部分PEEK cage发生断裂。见图3。

图3 压缩实验后cage变化
3 讨论
脊柱外科各种内固定系统是维持脊柱稳定的必要手段,对脊柱起到暂时的固定作用,只有实现骨性融合,才能使脊柱获得恒久的稳定[10]。自体骨移植是脊柱融合的金标准,但由于自体骨来源有限,增加供区创伤、无法提供即时的力学稳定,在植骨爬行替代过程中,伴随着植骨块的吸收,力学强度不断降低,不能很好地维持椎间隙高度,从而影响手术疗效[11,12]。传统椎间融合器其固有的缺陷一直没能得到妥善解决,如钛合金 cage与人体骨弹性模量差距显著;PEEK cage有发生椎体沉降、脊柱前弯、假关节形成继而增加椎体延迟融合甚至不融合的风险[13,14]。自从意识到了非降解椎间融合器带来的种种弊端之后,学者们便希望能寻找到一种更“理想”的融合器材料。目前临床应用较多的可降解材料有:聚乙醇酸类材料(Polyglycolide,PGA)、聚乳酸类材料(Polylactide,PLA)及其混聚物[15]。PGA不稳定,多在1个月内完全降解,无法单独用作椎间融合器的材料;PLA及其衍生的混合共聚物降解时间长,但其最主要的缺陷是植入体内产生迟发型炎症反应和侵蚀作用,酸性降解产物可导致的内固定失败和假关节形成[16]。本研究设计的可降解 cage由磷酸镁可降解水泥制成,磷酸镁骨水泥是由氧化镁、磷酸盐、缓凝剂及固化液混合制备而成的一种反应型胶粘材料,凝固后弹性模量与人皮质骨接近。镁元素属于人体必需的微量元素之一,具有一定的诱导骨生长的作用;镁基合金具有良好的生物相容性,可以在体内自动降解,无需再次手术取出;并且在人体体液中生成的镁离子可被周围机体组织吸收,然后通过体液排出体外[17]。吴子征等用MPC骨水泥粘接固定犬胫骨平台骨折的组织学研究中发现,骨水泥和骨质之间通过相互镶嵌固定而具有粘接作用,在骨小管内可看到通过溶解而吸收的骨水泥的块状物,说明骨水泥可能是通过逐步溶解而吸收[18]。也有学者分别用 MPC骨水泥与“L”形钢板固定家兔胫骨平台骨折,通过影像学及组织学观察得到MPC对家兔胫骨平台骨折的治疗和钢板固定组达到同样治疗效果的结论[19]。张秉文等在磷酸镁骨粘合剂的生物安全性研究中,通过遗传毒性实验、体外细胞毒性实验及细胞炎性因子表达测试实验,证明了MPC骨水泥符合生物安全性的要求,具有良好的生物相容性[20]。
本研究结果显示,MPC cage刚度远大于PEEK cage及猪髂骨cage,说明MPCcage在承受相同外力时抵抗形变的能力显著强于PEEK cage及猪髂骨cage,MPC cage组的压缩位移较其他两组也证明了这一点。究其原因,是由材料本身的性质决定的,MPC属于化学键结合的类陶瓷材料,具有强度和体积稳定性高的特性[21]。研究中也发现,MPCcage所能承受的压缩载荷(4976.337±302.091)N显著高于PEEK cage组(4076.463±439.788)N及猪髂骨cage组(350.698± 27.176)N。来自Nachemson等的研究表明,生理状态下椎间盘内的压力与人体的姿势有关,最大压力可以是人体体重的2~3倍[22]。Wilke等对一志愿者脊柱L4/5节段进行椎间盘压力测量,结果表明椎间压力与人体进行的活动、姿势、承重状态和肌肉的紧张程度有关,测量结果如下:肌肉放松站立状态0.5Mpa,站立前屈状态1.1Mpa,站立后伸状态0.6Mpa,坐立状态0.46Mpa,身体侧弯时的最大压强为0.6Mpa,轴向扭转时0.7Mpa,弯腰抬20kg物体时为2.3Mpa,屈膝时1.7Mpa,坐立做直腰动作为0.55Mpa[23]。参照Wilke的测量数据可以推算出,在日常生活中体重为70kg的成年人 L4/5椎间压力最大值为1960N。本研究设计的MPCcage可承受(4976.337±302.091)N压力,远远高于这一压力值。另有文献报道,正常人体腰椎所承受的负荷一般在3000N以内[24],MPCcage同样能承受此压力。受制于人新鲜髂骨获取困难,猪骨密度高于人骨,抗压强度高于人骨,所以本研究用新鲜猪髂骨替代人新鲜髂骨。
本研究不足为仅评价了MPCcage的体外力学特征,后期还需体内研究探讨其在体内随植入时间的延长力学特征如何改变。本研究中,cage的上下压板均为金属制成,与cage在体内与上下椎体终板接触有所不同,不能代表椎体间真实的生物力学环境。此外,MPC cage自身的不足是脆性高,手术植入过程中及植入后有碎裂的风险,但其可降解吸收,即使发生碎裂其对人体危害相对较小。为弥补脆性高的不足,在后期的cage设计制作过程中一方面要采用真空高压成型技术,降低cage气泡数量增加cage的密度及抗压能力;另一方面在cage外层包裹锌镁合金,内部增加镁合金骨架,来改善cage的脆性高的问题。目前现有椎间融合器远期效果良好,如:PEEK及碳纤维材料椎间融合器,但最大不足是不可降解,永久作为异物存在体内,这让广大患者在接受程度上存在顾虑。本研究是初步探讨研制一种可降解椎间融合器,主要创新点在于植入体内后随时间延长可降解吸收。
综上所述,MPC cage具有良好的抗形变能力及能够承受较大的压力载荷,能够提供人体腰椎间隙的支撑-压缩稳定作用,初步说明其在体外生物力学方面安全有效。针对其自身不足,经过后期的不断改进,临床应用前景广阔。
[1]Chen NF,Smith ZA,Stiner E,et al.Symptomatic ectopicbone formation after off-label use of recombinant human bone morphogeneticprotein-2 in transforaminal lumbar interbodyfusion[J].J Neurosurg Spine,2010,12(1):40-46.
[2]McAfee PC.Interbody fusion cages inreconstructive operations on the spine[J].JBone Joint Surg Am,1999,81(6):859-880.
[3]Bagby GW.Arthrodesis by the distraction-compression method using a stainless steel implant[J].Orthopedics,1988,11(6):931-934.
[4]KuslichSD.The scientific Basis for the bagby method of spinal Interbodyfusion.6th.ISSLSAnnual Meeting,Arizona USA,1993: 23.
[5]周春光,宋跃明,刘浩,等.可降解椎间融合器的研究进展[J].中国修复重建外科杂志,2010,12(24):1500-1505.
[6]LIU ZISHENG,LIU CHANGSHENG.Progress in research on magnesium phosphate cement as inorganic binder for bone repair [J].Materials Review,2000,14(5):29-32.
[7]MESTRES G,GINEBRA M P.Novel magnesium phosphate cements with high early strength and antibacterial properties[J].ActaBiomaterialia,2011,7(4):1853-1861.
[8]Waselau M,SamiiVF,Weisbrode SE,et al.Effectsof amagnesium adhesive cement on bone stability and healing following a metatarsal osteotomy inhorses[J].AmJ Vet Res,2007,68(4):370-378.
[9]Pina S,Olhero SM,GheduzziS,et al.Influence of setting liquid composition andliquid-to-powder ratio on propertiesof aMg-substituted calcium phosphate cement[J].ActaBiomater,2009,5(4): 1233-1240.
[10]Klopfenstein JD,Kim LJ,Feiz-Erfan I,et al.Retroperitoneal approachfor lumbar interbody fusion with anterolateral instrumentation for treatment ofspondylolisthesis and degenerative foraminalstenosis[J].SurgNeurol,2006,65(2):111-116.
[11]Khanna G,Lewonowski K,Wood KB.Initial results of anterior interbody fusion achieved with a less invasive bone harvesting technique[J].Spine(Phila Pa 1976),2006,31(1):111-114.
[12]Chen WJ,Tsai TT,Chen LH,et al.The fusion rate of calcium sulfate with localautograft bonecompared with autologous iliac bone graft for instrumented short-segment spinal fusion[J].Spine(Phila Pa 1976),2005,30(20):2293-2297.
[13]Barsa P,Suchomel P.Factors affecting sagittal malalignment due to cagesubsidence in standalone cage assisted anterior cervical fusion[J].Eur Spine J,2007,16(9):1395-1400.
[14]Kast E,Derakhshani S,Bothmann M,et al.Subsidence after anteriorcervical inter-body fusion[J].NeurosurgRev,2009,32(2):207-214.
[15]李嵩,祁敏,曹鹏,等.可吸收脊柱椎间融合器的研究与应用进展[J].脊柱外科杂志,2014,02(12):103-106.
[16]王乐,刘少喻.可吸收聚合物材料制作椎间融合器的临床应用[J].中国组织工程研究,2013,42(17):7462-7468.
[17]张芳.生物医用镁合金专利技术发展综述[J].生物骨科材料与临床研究,2015,01(12):72-75.
[18]吴子征,孟德华,张键.磷酸镁骨水泥粘接固定犬胫骨平台骨折的实验研究[J].中国临床医学,2009,01(16):133-135.
[19]吴子征,张键,陈统一,等.磷酸镁骨粘合剂粘接骨折的实验研究[J].中国修复重建外科杂志,2006,09(20):912-915.
[20]张秉文.磷酸镁骨粘合剂的生物安全性研究[D].复旦大学,上海,2010.
[21]雒亚莉.新型早强磷酸镁水泥的试验研究和工程应用[D].上海交通大学,上海,2010.
[22]NaehemsonA,MorrisJM.In vivo measurements of intradisealpressure:diseometry,amethodfordetermination ofpressurein the lower lumbar dises[J].J Bone Joint Surg Am,1964,46:1077-1092.
[23]Wilke H,Neef P,Hinz B,et al.Intradiscal pressure together withanthropometric data--a data set for the validation of models[J]. ClinBiomech(Bristol,Avon),2001,16(Sup11):111-126.
[24]马金梁,张记恩,刘克斌,等.一种新型腰椎间融合器的研制及生物力学评价[J].重庆医学,2014,04(43):465-468.
In vitro biomechanical evaluation of a model of biodegradable lumbar intervertebral fusion cage
HanZhenchuan1,Xiong Sen1,Zhang Yabin1,et al.
1 Department of Orthopaedics,the Chinese PLA General Hospital, Beijing,100853;2 Department of Orthopaedics,the Chinese PLA 322 Hospital,Datong Shanxi,037000,China
Objective To introduce the design concept and structure of a new type of biodegradable lumbar intervertebral fusioncageand toevaluate its biomechanicalproperties.Methods A noveltype of biodegradablebone cement-magnesium phosphate cemen(tMPC),which wascompressedand solidifiedbya special model tomake intervertebral fusioncageswere identified as the experimental group(n=8).The same size polyetheretherketone(PEEK)intervertebral fusion cages(n=8)and the pig iliac bone block-made intervertebral fusion cages(n=8)were the control groups.Compression load test using 10000N Instron biomechanical machine.When the lumbar intervertebral fusion cage was compressed and the height of the intervertebral fusion cage loss 1/3,it was judged as failure,the load and stiffness of the intervertebral fusion cage was recorded.If the cage was damaged when the height lossless than 1/3 of its height,the displacement,the load and the stiffness wererecorded.Results As the MPC cagedamaged,its height loss was obvious less than the PEEK cage group and the pig iliac bone cage group,the difference was statistically significant(<0.01);Once the MPC cage wasdamaged,the load was significantly larger than the PEEK cage group and the pig iliac bone cage group at 1/3 of heightloss,the difference was statistically significant(<0.01);MPC cage group's stiffness was statistically significant than the PEEKcageandhe pig iliac bone cage group(<0.01).Conclusion Magnesium phosphate cement biodegradable intervertebral fusion cage,which has excellent anti deformation ability and can bear large pressure load,can provide the supportandstability of lumbar intervertebralspace,MPC cagecanmeet the biomechanicsrequirements of clinical implant.
Biomechanics;Biodegradablematerials;Lumbarintervertebral fusioncage;Magnesiumphosphate cement
R318
A
10.3969/j.issn.1672-5972.2016.02.001
swgk2015-09-00166
韩振川(1987-)男,在读硕士,医师。研究方向:脊柱外科。
*[通讯作者]毛克亚(1970-)男,博士,硕士研究生导师,主任医师。研究方向:脊柱外科及生物材料。
2015-09-04)
国家自然科学基金(51372276)
1解放军总医院骨科,北京100853;2解放军322医院骨科,山西大同037000

