斑玉蕈培养过程中酶活性与菌包成熟度的关系*
张职视,林 辉,王丽芬,陈桂珍,赖淑芳,詹森然,李佳欢,孙淑静,,胡开辉,**
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学 (古田)菌业研究院,福建 古田 352200)
斑玉蕈培养过程中酶活性与菌包成熟度的关系*
张职视1,林 辉2,王丽芬2,陈桂珍2,赖淑芳1,詹森然1,李佳欢1,孙淑静1,2,胡开辉1,2**
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学 (古田)菌业研究院,福建 古田 352200)
为建立科学可靠的判断斑玉蕈(Hypsizygus marmoreus)菌包成熟度的生物学参数评价指标,为工厂化生产菌包成熟度的判断提供科学依据。分别通过3,5-二硝基水杨酸法、碘试液比色法、福林酚法、2,2-联氮-二 (3-乙基-苯并噻唑-6-磺酸)二铵盐法、愈创木酚法分析斑玉蕈菌包不同培养时间其羧甲基纤维素酶、木聚糖酶、淀粉酶、中性蛋白酶、漆酶和锰过氧化物酶活性变化,以及培养时间与出菇产量之间的关系。结果表明,菌包培养温度在21℃~25℃,培养时间120 d左右,菌包上、中、下各部木聚糖酶活力趋于13.7 U·mL-1;在70 d菌包上部漆酶活力达到最高值,在100 d中部与下部漆酶活力达到最大值;在120 d各部分漆酶活力趋于173.5 U·L-1,纤维素酶活力达6 U·mL-1~8 U·mL-1,淀粉酶活力保持在20 U·mL-1左右,中性蛋白酶活力4 U·mL-1左右,下部锰过氧化物酶活力达40 U·mL-1时,此阶段出菇的产量最高达461.7 g·袋-1。
斑玉蕈;酶活力;生物学效率
斑玉蕈(Hypsizygus marmoreus) 是近年来福建省工厂化生产的重要品种之一。菌包成熟度是斑玉蕈栽培过程中的关键影响因子之一。目前国内外的研究主要集中在其生物学特性[1]、遗传育种[2-3]、子实体营养物质及生理活性物质[4]、原材料的开发与栽培特性[5-9]、酶活性和蛋白质组[10-11]等方面,对栽培过程中菌包成熟度的判断指标缺乏系统研究。由于斑玉蕈是一个低温结实性品种,在栽培生产中发菌较为缓慢,后熟培养时间长,生产周期长达120 d~150 d以上[12]。发菌时间长短取决于菌包成熟度,菌包不够成熟会导致产量低下甚至不出菇,造成产量不稳定,商品价值低;而菌包过于成熟,又造成栽培周期过长,加大企业的生产成本。目前国内工厂化生产斑玉蕈过程中,对菌包成熟度的判断主要凭借生产经验,缺乏有效的判断依据,以致工厂化生产出菇不整齐,稳定性差。因此,有学者曾经对不同栽培时间的瓶装斑玉蕈失重和含水量与出菇产量和质量的关系进行了研究[13-14],但未见利用酶活性进行成熟度判定的相关报道。本研究通过观察不同培养时间斑玉蕈菌包的生物学参数,研究培养时间对斑玉蕈现蕾、出菇速度、子实体品质和产量的影响,以期为建立科学地判断菌包成熟度的方法提供参考,为设定斑玉蕈标准化生产的栽培参数提供有力的证据,为工厂化生产中稳定产量发挥指导作用。
1 材料与方法
1.1 供试菌种
斑玉蕈(闽真2号),为福建农林大学生命科学学院微生物工程实验室保藏菌种。
1.2 菌包制作方法
生产菌包配方:棉籽壳48%、木屑10%、甘蔗渣10%、麸皮20%、玉米粉5%、豆粕5%、石灰2%,含水量63%,每袋装干料500 g,121℃灭菌2 h。
1.3 不同成熟度斑玉蕈菌包出菇及生物学参数测定
将菌种接入菌包,置于25℃培养,培养时间分别为60 d、70 d、80 d、90 d、100 d、110 d、120 d、130 d和140 d,每个处理设置8袋,设置3个重复。然后搔菌,出菇,定时观察菌袋出菇情况,记录菌丝恢复料面泛白时间、原基形成时间,采收时间、出菇产量以及品质。
出菇管理分4个阶段:16℃~19℃,湿度95%~98%,无光照,不通风3 d;13℃~16℃,湿度90%~95%,CO2浓度控制在2 700 μL·L-1,每2 h光照2 min至原基形成,时间约7 d;13℃~16℃,湿度90%~95%,CO2浓度控制在2 400 μL·L-1,无光照,培养至菌柄长2 cm~4 cm,菌盖2 mm~4 mm,时间约7 d;2℃~15℃,湿度90%~95%,CO2浓度控制在7 000 μL·L-1,无光照,培养至采收,时间约10 d,整个出菇时间约27 d。
1.4 斑玉蕈菌包酶活力测定
1.4.1 酶液提取方法
取每个阶段的菌包3袋,每个菌包分为上、中、下三部分,每部分培养料用手充分揉碎混匀,称取10 g于50 mL烧杯中,加40 mL蒸馏水,25℃,150 r·min-1震荡2 h,过滤,取滤液于50 mL离心管,9 000 r·min-1离心15 min,上清液即为粗酶液。
1.4.2 羧甲基纤维素酶活力测定
在试管中加入1 mL 1%CMC-Na溶液,再往试管中加入0.5 mL粗酶液,50℃保温30 min。在试管中加入1.5 mL DNS试剂,再沸水浴7 min,然后用冷流水冷却终止反应。用蒸馏水定容至10 mL,充分混匀。用灭活酶液作空白对照。在520 nm处测吸光度。酶活力单位的定义为:在50℃、pH4.6的条件下,每分钟水解底物生成1 μg葡萄糖所需的酶量定义为1个酶活力单位“U”[15]。
1.4.3 木聚糖酶活力测定
吸取1%木聚糖750 μL到试管中,再往试管中加入250 μL粗酶液,50℃保温30 min。在试管中加入1.5 mL DNS试剂,再沸水浴7 min,然后用冷流水冷却终止反应。用蒸馏水定容至10 mL,充分混匀。用灭活酶液作空白对照。在550 nm下测吸光度值。酶活力单位的定义为:在50℃、pH5.2的条件下,每分钟水解底物生成1 μg D-木糖所需的酶量定义为1个酶活力单位“U”[16]。
1.4.4 淀粉酶活力测定
吸取4 mL可溶性淀粉溶液于试管中,置于60℃恒温水浴中预热5 min。加入磷酸缓冲液1 mL,再加入粗酶液500 μL,计时反应30 min。立即吸取反应液1 mL,加入盛有0.5 mL稀盐酸和5 mL稀碘液的试管中,摇匀。用灭活酶液作空白对照。在660 nm处测定吸光度。酶活力单位定义:在 60℃、pH6.0条件下,每分钟液化1 μg可溶性淀粉,定义为1个淀粉酶活力单位“U”[17]。
1.4.5 蛋白酶活力测定
在2 mL离心管内加入粗酶液0.5 mL,置于40℃水浴中预热2 min,再加入经同样预热的酪蛋白0.5 mL,精确保温30 min。时间到后,立即再加入0.4 mol·L-1的三氯乙酸1 mL,以终止反应。8 000 r·min-1离心1 min。另取10 mL离心管若干,每管内加入上清液1 mL,再加0.4 mol·L-1碳酸钠5 mL,福林酚试剂100 μL,摇匀,40℃保温发色20 min,以灭活的酶液为对照。于660 nm处测定吸光度。酶活力单位的定义为:在40℃、pH7.2条件下,每分钟水解酪蛋白产生1 μg·L-1酪氨酸,定义为1个蛋白酶活力单位“U”[18]。
1.4.6 漆酶活力测定
准确移取HAc-NaAc缓冲液 (pH4.5)2.7 mL、1 mmol·L-1ABTS溶液0.2 mL,混合,摇匀,在30℃恒温水浴锅中水浴预热5 min。将上述混合试剂倒入容积为3 mL的比色皿中,420 nm处调零。准确加入粗酶液100 μL,立即记录吸光值,每隔30 s记录1次,共记录3 min。酶活力单位的定义为:每分钟氧化1 μmol底物所需要的酶量为一个酶活单位“U”[11]。1.4.7 锰过氧化物酶活力测定
准确移取4 mmol·L-1愈创木酚 0.7 mL、100 mmol·L-1pH4.5琥珀酸钠缓冲液2 mL、2.5 mmol·L-1的H2O20.1 mL、5 mmol·L-1的MnSO40.2 mL,混合,摇匀,在40℃恒温水浴锅中水浴预热5 min。将上述混合试剂倒入容积为3 mL的比色皿中,465 nm处调零。加入0.2 mL粗酶液,立即记录吸光值,每隔30 s记录1次,共记录3 min。酶活力单位的定义为:每分钟氧化1 μmol MnSO4的酶量为一个酶活单位“U”[19]。
1.5 数据处理
实验数据用DPS软件LSD多重比较法进行单因素方差分析,用EXCEL软件进行绘图。
2 结果与分析
2.1 斑玉蕈菌包的酶活性
2.1.1 羧甲基纤维素酶活力变化
纤维素酶是一种能分解纤维素的胞外酶,是由多种水解酶组成的复杂酶系,可以一直将纤维素分解到葡萄糖为止,从而为菌丝生长提供能源,是真菌碳代谢过程中的重要酶系。羧甲基纤维素酶活力随斑玉蕈菌包培养时间变化见图1。
由图1可知,斑玉蕈菌包羧甲基纤维素酶活性比较低,在菌包培养的各个阶段变化不大,活力基本维持在6 U·mL-1~8 U·mL-1。说明斑玉蕈培养过程中始终存在降解纤维素的过程,也是斑玉蕈生产周期长的原因之一。对羧甲基纤维素酶活力变化的方差分析(见表1)表明,各阶段纤维素酶活性间差异不显著。

图1 羧甲基纤维素酶活力随斑玉蕈菌包培养时间的变化Fig.1 Changes in cellulase activity of Hypsizygus marmoreus bag with incubation time

表1 羧甲基纤维素酶活力变化的方差分析Tab.1 Variance analysis on cellulase activities of Hypsizygus marmoreus bag
2.1.2 木聚糖酶活力变化
斑玉蕈在水解木聚糖时产生的酶往往是一个多酶复合体,各种酶相互调节和协同作用,才能使木聚糖完全降解。斑玉蕈生长发育过程分泌木聚糖酶较多,因此可以作为判断菌包成熟度的指标。木聚糖酶活力随斑玉蕈菌包培养时间的变化见图2。

图2 木聚糖酶活力随斑玉蕈菌包培养时间的变化Fig.2 Change in xylanase activity of Hypsizygus marmoreus bag with incubation time
从图2可以看出,菌包木聚糖酶活力随着斑玉蕈菌包培养时间增加,酶活力也随之逐步增高:菌包长满菌袋后,木聚糖酶活力从上部到下部逐步增强,酶活逐渐上升,到110 d之后就基本稳定;随斑玉蕈菌包培养时间而不断增大,到后期上、中、下部的酶活力基本相同。主要原因是木聚糖酶可以分解木聚糖成为木糖,为菌包生长提供能量。经木聚糖酶活力变化方差分析(见表2) 表明,60 d菌包上、中、下部木聚糖酶酶活力差异显著,140 d菌包上、中、下部木聚糖酶活力差异不显著。2.1.3淀粉酶活力变化

表2 木聚糖酶活力变化的方差分析Tab.2 Variance analysis on xylanase activities of Hypsizygus marmoreus bag
淀粉酶是水解淀粉和糖原酶类的统称。斑玉蕈培养料中含有大量淀粉,需将其水解后才能供给菌丝生长发育,因此淀粉酶也是斑玉蕈碳代谢中关键酶之一。淀粉酶活性随斑玉蕈菌包培养时间的变化见图3。
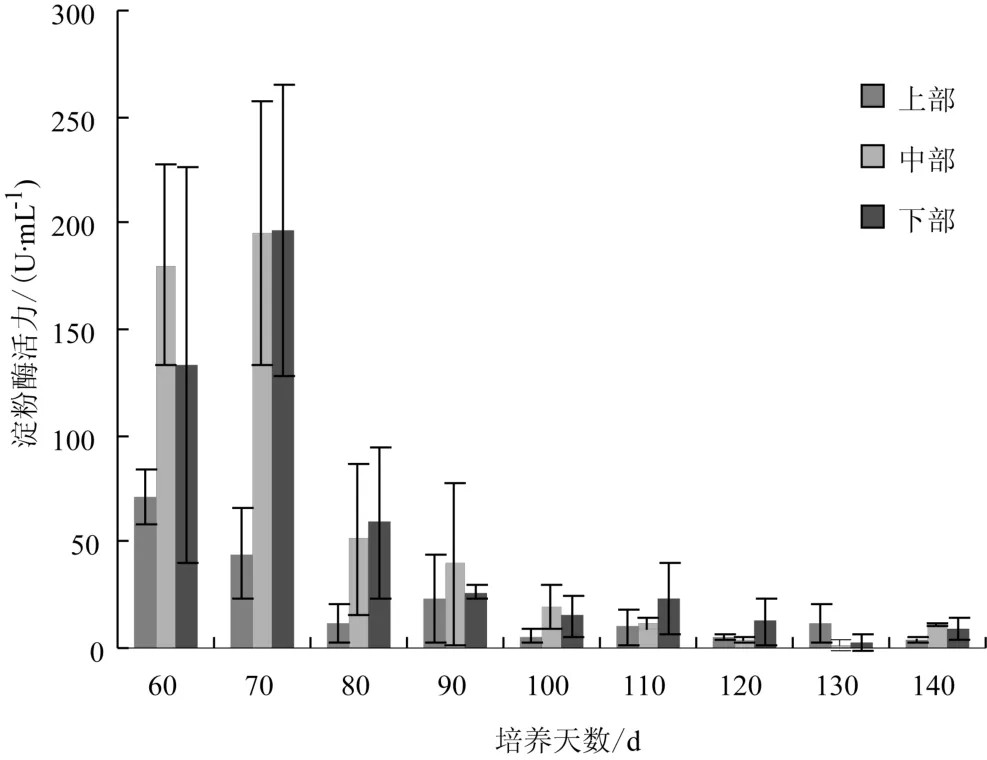
图3 淀粉酶活性随斑玉蕈菌包培养时间的变化Fig.3 Change in amylase activity of Hypsizygus marmoreus bag with incubation time
从图3可以看出,淀粉酶活性在60 d~80 d时出现一个高峰,之后就逐渐降低。原因可能是斑玉蕈淀粉酶是诱导酶,随着淀粉含量的减少酶活力逐步下降。100 d过后,菌丝已经基本后熟完成,此时的生长速度下降,酶活也降低并且较稳定,保持在20 U·mL-1左右。淀粉酶活性变化经方差分析(见表3)表明,70 d淀粉酶活性与110 d淀粉酶活性差异极显著,110 d~140 d淀粉酶活性差异不显著。

表3 淀粉酶活性变化的方差分析Tab.3 Variance analysis on xylanase activities of Hypsizygus marmoreus bag
2.1.4 中性蛋白酶活力变化
通过中性蛋白酶可把动植物的大分子蛋白质水解成小分子肽或氨基酸,以利于蛋白质的有效吸收和利用。蛋白酶在菌丝吸收氮素营养过程中起着至关重要的作用。菌丝生长发育所需要的氮源来自蛋白酶的水解作用。中性蛋白酶活性随培养时间的变化及方差分析见图4和表4。
由图4可以看出,中性蛋白酶活力随着斑玉蕈菌包培养时间不断降低,可能原因是栽培料中的豆粕等有机氮逐渐用完,因此蛋白酶的需求量降低。由表4方差分析表明,60 d中性蛋白酶活性显著高于140 d中性蛋白酶。

图4 中性蛋白酶活性随斑玉蕈菌包培养时间的变化Fig.4 Change in proteinase activity of Hypsizygus marmoreus bag with incubation time

表4 中性蛋白酶活性变化的方差分析Tab.4 Variance analysis on proteinase activities of Hypsizygus marmoreus bag
2.1.5 漆酶活力变化
据研究发现很多食用菌菌体中富含漆酶。在菌体生长过程漆酶不仅参与木质素的降解,为菌体生长提供养料;同时还会产生酚类或醌类化合物抑制杂菌生长,还参与菌包转色过程,影响产品的产量和质量。漆酶活性随斑玉蕈菌包培养时间的变化情况及方差分析见图5和表5。
由图5可以看出,菌包上部漆酶活力在70 d达到最高值,随后降低至平均水平;中部与下部漆酶活力在100 d达到最大峰值,随后各部分酶活力有波动,总体维持在200 U·L-1左右。表5方差分析表明70 d菌包上、中、下部漆酶活力有显著差异,110 d~130 d菌包上、中、下部漆酶活性差异不显著。2.1.6 锰过氧化物酶活力变化
锰过氧化物酶活性随斑玉蕈菌包培养时间的变化情况及方差分析见图6和表6。
锰过氧化物酶与木质素的降解密切相关。木质素是高等植物的主要成分之一,主要存在于细胞壁中,占植物细胞壁的15%~30%。木质素和半纤维素一起包围着纤维素。在斑玉蕈培养阶段,随着栽培时间的延长,锰过氧化物酶活性逐渐增强,才能先分解木质素,再摄取细胞中更多的营养,为其生长发育所用。在菌丝后熟期间,锰过氧化物酶的活性呈上升的趋势,菌丝后熟完成之后活性略有下降。各部分遵循先逐渐增高而后慢慢降低的规律:上部在80 d达到最大峰值,中部在90 d达到最大峰值,下部在110 d~120 d达到峰值,酶活力有41 U·mL-1(图6)。经方差分析表明,120 d菌包下部锰过氧化物酶活力显著高于60 d菌包下部锰过氧化物酶活力。

图5 漆酶活性随斑玉蕈菌包培养时间的变化Fig.5 Change in laccase activity of Hypsizygus marmoreus bag with incubation time

表5 漆酶活性变化的方差分析Tab.5 Variance analysis on laccase activities of Hypsizygus marmoreus bag
2.2 菌包成熟度与生物学效率的关系
本研究采用工厂化稳定生产中的斑玉蕈菌包作为试验材料,在环境条件、培养料的营养配比、料水气比例、菌种一致情况下,测定其前期酶活性变化,同时做了出菇管理实验,测定了菌包生物学效率。并参照作者之前发表文章[20],从而可以为分析酶活力与出菇产量以及生物学效率之间关系提供依据。菌包培养时间对菌丝恢复泛白时间无影响,但是对原基形成时间和采摘时间有显著影响。不同培养时间出菇产量和生物学效率各不相同,110 d之前产量和生物学效率随着培养天数增加而增加,110 d之后差异不显著。菌包不同培养时间出菇外观有明显的差别,但出菇时间不影响子实体色泽。培养时间加长对子菌盖厚度和子实体含水量影响也不显著,但是对菌盖大小和菌柄柄长度有影响。

图6 锰过氧化物酶活性随斑玉蕈菌包培养时间的变化Fig.6 Change in manganese peroxidase activity of Hypsizygus marmoreus bag with incubation time

表6 锰过氧化物酶活性变化的方差分析Tab.6 Variance analysis on manganese peroxidase activities of Hypsizygus marmoreus bag
3 讨论
本研究采用工厂化生产中的斑玉蕈菌包作为试验材料,设置平行和对照并进行显著性分析。试验结果表明,后熟期不足导致原基形成晚,采摘时间推迟,成品率低下;后熟期过长产量增加不明显,并且增加了企业生产成本。因此本研究结果可为建立斑玉蕈菌包成熟度判定方法提供参照,为斑玉蕈工厂化生产过程中选择正确出菇时间提供理论支持。
菌包菌丝体生长阶段,是培养料及菌丝体生理成熟度不断提高和积累的过程。在环境条件适宜、培养料营养配比得当、料水气比例合适,菌种优良的前提下,斑玉蕈培养期间的一切变化都有一定规律,可根据前期表现预测后期结果。但是,纤维素酶活力在6 U·mL-1~8 U·mL-1波动,后期增长不明显,这与对白灵菇的研究结果不同[20]。菌包内含有大量纤维素,长期需要纤维素酶,但本文该酶降解缓慢,其原因不明。淀粉酶活力变化趋势与平菇液体培养及白灵菇、金针菇固体培养相似[21-23],在后熟期后期活性低。由于淀粉酶可能是一种诱导酶,前期培养料中含有较高的淀粉,淀粉酶活力较高,后期淀粉分解含量低时,酶活力显著下降。蛋白酶活力在无子实体形成时活力低,与王玉万的研究结果相似[24],并且逐渐降低。这是因为培养料中如豆粕等有机蛋白消耗完后,蛋白酶活力下降。木聚糖酶活力逐渐升高并且上部>中部>下部,后期上、中、下部活力差距减小,主要原因是木聚糖酶可以分解木聚糖成为木糖,为菌包生长提供能量。这与周晨妍、胡奎娟等人研究结果有所不同[16,25],可能是由于黑曲霉、木霉与斑玉蕈物种间的差异,导致酶活变化不呈“钟”状。上、中、下部漆酶活力都依次先上升后降低,后期差异不大,在200 U·L-1左右波动。因为漆酶不仅参与木质素降解,为菌体生长提供养料,同时还产生酚类或醌类化合物抑制杂菌生长,并且参与菌包转色过程,影响产品产量和质量[11]。锰过氧化物酶活力变化趋势与张丁倩研究结果相似[19],前期上部>中部>下部,后期下部和中部逐渐超过上部,研究发现当菌包下部酶活力超过中上部达到最高值即40 U·mL-1时,出菇品质好,产量高。
从培养过程中斑玉蕈的木聚糖酶、漆酶、锰过氧化物酶等的活性变化可以看出,培养60 d~90 d这段阶段酶活力波动较大,此时菌丝生长处于旺盛阶段;110 d~120 d阶段酶活力相对较平稳,说明此时菌丝生长已经基本达到生理后熟期;超过130 d酶活力又有大幅度变化,此时菌丝生长超过一定的成熟度,产量有相应的下降。在23℃温度培养下,菌丝培养120 d,漆酶、木聚糖酶活力上、中、下趋于一致时,表示菌包已经成熟,产量最高。因此,斑玉蕈工厂化生产菌包培养后熟不够或过熟都会影响产量和外观品质。
研究斑玉蕈菌丝体生长阶段培养料各种关键酶活规律的意义在于:掌握菌丝体生长阶段酶活规律,有助于对生产过程进行监控,及时发现问题、提前解决问题,最大程度地降低因斑玉蕈生产周期长而带来的技术风险;根据该变化规律,能够对新工艺、新技术的开发提供较为快捷的判断标准或参考;把研究斑玉蕈菌丝体生长阶段酶活变化规律的方法应用到其他菇类上,有助于提高对其它菇类生物学特征的认识,更好地指导生产。
[1]刘建中,孙淑静,胡开辉,等.真姬菇融合菌株生物学特性及生产性能的研究[J].中国食用菌,2010,29(3):22-25.
[2]董岩,陈辉,赵明文,等.真姬菇栽培菌株的ITS和SSR分析[J].上海农业学报,2009,25(3):59-64.
[3]胡开辉,刘建中,孙淑静,等.斑玉蕈育种中漆酶转化体系建立的初步研究[J].菌物学报,2010(4):528-535.
[4]林忠宁,陈敏健,刘明香,等.真姬菇菇脚和菌糠氨基酸含量测定及营养评价[J].中国食用菌,2012,31(2):44-46.
[5]沙春娥,李富得,王振坤.利用油橄榄冬剪枝栽培真姬菇试验[J].食用菌,2010(4):35.
[6]苏启苞,刘传森.利用木薯、木薯渣栽培真姬菇试验[J].中国食用菌,2008,27(4):59,61.
[7]程继红,冯志勇,高君辉.米糠添加量对真姬菇产量和品质的影响[J].食用菌学报,2004,11(1):42-45.
[8]黄忠英.金针菇废菌料栽培真姬菇试验[J].食用菌,2014(4):30-31.
[9]孙淑静,颜松,胡开辉.斑玉蕈不同菌种类型的生产性能[J].河南科技大学学报,2010,31(1):66-69.
[10]胡开辉,黄贵英,颜松,等.斑玉蕈低温胁迫下菌丝体酶活变化及差异蛋白质组学研究[J].菌物学报,2009,28(4):584-590.
[11]郭艳艳,阮玲云,冯宏昌,等.不同营养条件下斑玉蕈菌丝生长及产酶特性[J].菌物学报,2014(3):697-705.
[12]胡开辉,出小平.外界因子对蟹味菇菌丝特性的影响[J].中国食用菌,2008,27(2):16-18.
[13]程继红,冯志勇,高军晖.栽培种培养时间对斑玉蕈产量和质量的影响[J].食用菌学报,2003,10(2):45-49.
[14]高君辉,冯志勇,陈辉.斑玉蕈培养时间与栽培料失重、含水量和产量的关系[J].食用菌学报,2008,15(3):23-26.
[15]赵玉萍,杨娟.四种纤维素酶酶活测定方法的比较[J].食品研究与开发,2006,27(3):116-118.
[16]周晨妍,张金华,马雪婷,等.黑曲霉产木聚糖酶的固态发酵条件优化[J].安徽农业科学,2010,38(21):11052-11054.
[17]孙静,耿慧莉,莫德馨.中温α-淀粉酶活性的定量测定[J].教学仪器与实验,2009,25(11):44-45.
[18]SB/T10317-1999,蛋白酶活力测定法[S].
[19]张丁倩,柯丽霞,赵文科,等.混菌固态发酵油菜秸秆铜离子和草酸对灵芝木质素酶系分泌的影响[J].安徽师范大学学报:自然科学版,2010,33(1):57-61.
[20]张职视,林辉,王丽芬,等.斑玉蕈菌包理化指标与其成熟度之间的关系[J].中国食用菌,2015,34(5):53-59.
[21]周长青,王秀峰,李玉.白灵菇生长发育过程中胞外酶活性的变化规律[J].食用菌学报,2008,15(2):64-68.
[22]王宜磊.侧耳液体培养特性及胞外酶活性研究[J].中国食用菌,2000,19(4):33-35.
[23]李蕤,吴克,骆军,等.金针菇固体培养几种胞外酶活力变化的研究[J].中国食用菌,2002,21(1):12-14.
[24]王玉万,潘贞德,李秀玉,等.玉蕈降解木质纤维素的生理生化基础[J].真菌学报,1993,12(3):219-225.
[25]胡奎娟,吴克,潘仁瑞,等.固态混合发酵提高木聚糖酶和纤维素酶活力的研究[J].菌物学报,2007,26(2):273-278.
Relationship Between Enzyme Activities and the Maturity of Hypsizygus marmoreous Bag
ZHANG Zhi-shi1,LIN Hui2,WANG Li-fen2,CHEN Gui-zhen2,LAI Shu-fang1, ZHAN Sen-ran1,LI Jia-huan1,SUN Shu-jing1,2,HU Kai-hui1,2
(1.College of Life Sciences,Fujian Agriculture and Forestry University,Fuzhou 350002,China; 2.Gutian Edible Fungi Research Institute,Fujian Agriculture and Forestry University,Gutian 352200,China)
In order to establish a scientific and reliable biological parameters evaluation index of Hypsizygus marmoreus bag maturity and provide a scientific basis for judgment of the industrialized H.marmoreus bag maturity,the relationship between cellulase,xylanase,amylase,proteinase,laccase,manganese peroxidase activities and different incubation time were analysed by 3,5-dinitrosalicyic acid method,Iodine-potassium iodide method,Folin-phenol method,ABTS method,Guaiacol method respectively.The results showed that cultivated about 120 days at 21℃-25℃,xylanase activities of the various parts of the fungi bag were about 13.7 U·mL-1and in upper part laccase activity reach maximum at 70 days,middle and lower part laccase activity reach maximum at 100 days,and various parts laccase activities of the fungi bag were about 173.5 U·L-1at 120 days.Cellulase activities were about 6 U·mL-1-8 U·mL-1.Amylase activities were about 20 U·mL-1.Proteinase activities were about 4 U·mL-1.Lower part anganese peroxidase activity reach 40 U·mL-1.The production of this period is up to 461.7 g·bag-1.
Hypsizygus marmoreus;enzyme activities;biological efficiency
S646.9
A
1003-8310(2016)01-0053-06
10.13629/j.cnki.53-1054.2016.01.015
福建省高校产学合作科技重大项目(2013N5101);珍稀食用菌品种创新与自动化生产技术产业化工程(2014S1477-8);福建省食用菌产业技术重大研发平台(2014N2101);福建省重大农技推广项目(KNJ-153000)。
张职视(1991-),男,硕士研究生,主要从事食用菌开发与利用研究。E-mail:746830163@qq.com
**通信作者:胡开辉(1962-),男,本科,教授,主要从事食用菌栽培与遗传育种研究。E-mail:2692609765@qq.com
2015-11-01

