香菇液体菌种深层发酵工艺探索
刘世玲,卢兴潮,江 坤,尚东妮,唐 悦,田少平,李克彬,曹现涛*
(1.湖北五林中地农业科技有限公司,湖北 宜昌 443000;2.宜昌市农业科学研究院,湖北 宜昌 443000)
香菇液体菌种深层发酵工艺探索
刘世玲2,卢兴潮1,江 坤1,尚东妮1,唐 悦1,田少平1,李克彬2,曹现涛1*
(1.湖北五林中地农业科技有限公司,湖北 宜昌 443000;2.宜昌市农业科学研究院,湖北 宜昌 443000)
在香菇菌种液体发酵培养基筛选、50 L发酵罐工艺试验的基础上,探索500 L发酵罐发酵工艺。发酵30 h时pH开始降低;38 h时溶氧开始下降;120 h菌丝球固形物体积达92.16%;76 h~120 h流加碱(饱和Na2CO3溶液)频率最高;168 h发酵菌丝体接种栽培袋的菌丝体活力明显下降;192 h在显微镜下可观测到大量菌丝体片段;接种量在5 mL和10 mL时菌丝萌发最好。运用无菌培养接种罐接种(已申请专利),可有效降低接种环节培养基被污染的风险;香菇液体菌种深层发酵在24℃,pH4.5,溶氧量90%~98%,搅拌速率180 r·min-1条件下进行比较适宜;最佳接种时间为96 h~144 h,接种量为每个接种孔5 mL~10 mL。
香菇;液体菌种;发酵;工艺
香菇隶属于担子菌门(Basidiomycota) 伞菌纲(Agaricomycetes) 伞菌目 (Agaricales) 小皮伞科(Marasmiaceae)香菇属(Lentinus)[1]。据统计,目前我国香菇产量占世界香菇总产量约70%,香菇产业的发展关系到国家食用菌产业的整体发展。目前香菇的种植主要依靠固体菌种,而固体菌种具有成本高、生长周期长、接种效率低等缺点。随着科技进步和食用菌产业的发展,食用菌生产方式由家庭作坊式操作、季节性生产的模式向设施化、工厂化、周年化、规模化生产模式转变,采用深层发酵工艺制备食用菌菌种已成为研发热点[2]。金针菇、杏鲍菇等在工厂化生产中已运用液体菌种[3-4]。液体菌种具有生长周期短、菌丝生长快、多点萌发、出菇整齐等优势[5]。香菇液体菌种尚未在实际生产中大规模采用,目前香菇液体菌种的研究多停留在实验室摇瓶和小型发酵罐中培养的阶段[6-8]。本研究在前期培养基筛选、摇瓶培养、50 L发酵罐培养的基础上,运用500 L发酵罐深层发酵香菇液体菌种,对发酵过程全程监控,并进行接种试验,以其得到可运用到实际生产中的香菇液体菌种发酵工艺。
1 材料和方法
1.1 材料
1.1.1 香菇菌种
香菇菌种为香菇808A,由宜昌微生物研究所提供。
1.1.2 主要仪器和设备
超净工作台、往复式恒温震荡培养箱、高压蒸汽灭菌锅、电子天平、无菌培养接种罐、5 mL移液枪、500 L搅拌式发酵罐。
1.1.3 培养基
菌种活化培养基为PDA培养基。液体菌种及发酵罐培养基相同:糖蜜7%、豆粕粉0.3%、玉米粉0.3%、酵母浸粉 0.1%、KH2PO40.05%、MgSO40.03%。另外在发酵罐中添加0.029%的消泡油,以及在发酵过程中流动加碱流(饱和NaCO3溶液),使pH保持在一定范围内。PDA培养基和液体菌种培养基121℃灭菌。
1.2 方法
1.2.1 供试菌种活化
在无菌条件下将母种菌丝接种至PDA斜面上,24℃温度下培养14 d后,挑选菌丝生长浓密、洁白、健壮的试管作为供试菌株。
1.2.2 液体菌种的制备
将2块1 cm3的供试菌株菌丝块,接种至含100 mL液体菌种培养基的250 mL三角瓶中,24℃摇床培养,前2 d转速为160 r·min-1,后4 d转速为180 r·min-1。6 d后扩大培养,即将液体菌种转接至装有2 L培养基的5 L三角瓶中,接种量为5%,培养方法与上述相同,6 d后得到液体菌种。
1.2.3 发酵罐灭菌
发酵罐及配套设备空消(未加培养基前对设备灭菌),时间1 h,温度121℃,压力0.1 MPa~0.15 MPa;配料后(装料系数为70%,初始pH调至5.0)发酵原料液和发酵罐进行实消(加培养基后灭菌),时间1 h,温度121℃,压力0.1 MPa~0.15 MPa;流加罐实消,时间1 h,温度121℃,压力0.1 MPa~0.15 MPa。
1.2.4 接种
实消后,培养液温度冷却到24℃~25℃时接种,将液体菌种无菌条件下转入旁氏罐中,利用旁氏罐将种子液接入500 L发酵罐,接种量为2%。
1.2.5 参数控制及发酵过程中检测要求
培养基初始pH值为5;整个发酵过程中pH设定值为4.5,温度设定24℃,压力0.13 MPa;整个发酵过程中要求溶氧量为90%~98%(通过调节转速与空气流量实现)。搅拌转速:前36 h,100 r·min-1~150 r·min-1;后期36 h~120 h,160 r·min-1~250 r·min-1(视溶氧量和菌丝球直径大小调整)。进风量100 L·min-1~250 L·min-1(视溶氧量调整)。前24 h,取样2次,取样要求检测菌丝体浓度和离线pH值,同时镜检香菇菌丝形态,并检测是否感染杂菌;25 h~120 h,每隔6 h取样一次,检测总菌丝体浓度和离线pH值,同时镜检香菇菌丝形态,并检测是否感染杂菌。整个发酵过程中每小时记录1次在线pH值、通风量、溶氧量、温度、碱加入量等数据。
1.2.6 菌丝萌发试验
当香菇菌丝体发酵至第6天和第7天时,分别取样接种至栽培袋中。栽培料配方为木屑68%、棉籽壳10%、麸皮20%、蔗糖1%、石膏1%,含水量60%左右,栽培袋大小15 cm×30 cm。灭菌冷却后,无菌条件下在栽培袋同一侧面相隔约15 cm处,用打孔器打2个孔(大小1 cm×1 cm×10 cm)。用移液枪接种,接种量分别为每孔1.5 mL、2.5 mL、5 mL、10 mL、15 mL,接种后用胶带及时封住接种口。每个处理20个重复,同时栽培袋接固体菌种作为对照。所有处理均置于24℃环境下暗培养,观察菌丝萌发情况。
2 结果与分析
2.1 发酵过程中pH的变化
香菇液体菌种发酵过程中pH随时间的变化情况见图1。
由图1可见,发酵前36 h时pH变化缓慢,由5.00降低至4.95,表明这一阶段香菇菌丝处在适应期,代谢缓慢;65 h时pH下降至4.44,此时开始流动加碱,将pH调至4.50附近;152 h后pH开始上升,76 h~120 h流加碱的频率最高(每次约0.10 kg),表明期间菌丝体大量增多,代谢活跃,产生大量酸性物质,这个阶段应该是菌丝生长的对数期至稳定期。
2.2 溶氧的变化
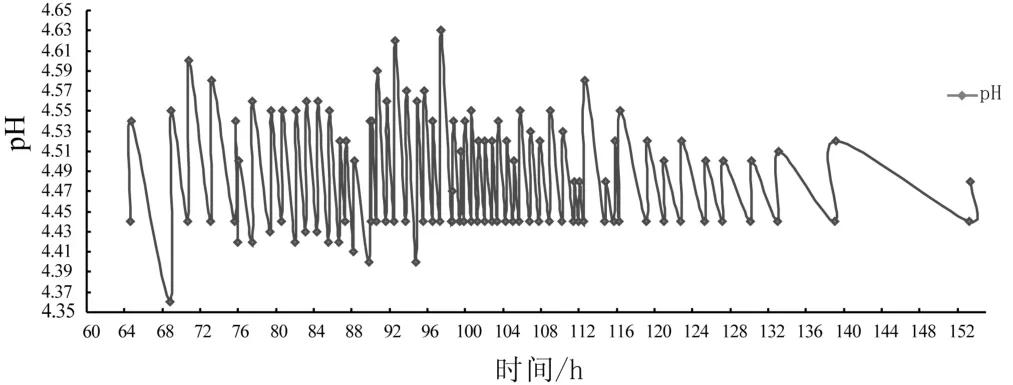
图1 香菇液体菌种发酵过程中pH随时间的变化Fig.1 pH changed with time during the fermenting
在菌丝发酵进行38 h后溶氧量开始降低,54 h~76 h之间培养基溶氧量低于50%,84 h后溶氧量恢复至初始值。此期间通过增加搅拌转速(最高250 r·min-1)和增大通风量(阀门开量由15%增至33%)来保持培养基中的溶氧量,以保证菌丝体生长代谢所需要的氧气。这期间菌丝代谢旺盛,需要消耗大量的氧气,因此造成培养基中溶氧量明显下降。溶氧量开始下降的时间点(38 h)与pH开始降低的时间点(36 h) 较一致,同样标志香菇菌丝体大量繁殖,菌丝由适应期进入对数生长期。
2.3 菌丝球固形物体积的变化
由于培养基中有难以分解的豆粕粉颗粒等固体物质,通过检测培养基中菌丝球的干重或者湿重,难以真实反映菌丝体的生物量。本研究通过检测取样样品中发酵固形物(主要是香菇菌丝体)的体积占样品总体积的百分数,来反映生成的香菇菌丝体的量。具体方法为每隔6 h取样一次,将样品混匀后取100 mL倒入100 mL量筒中,静置2 h后等固形物体积不再减少,记录固形物的体积,并计算固形物的百分比,见图2。

图2 固形物体积比随时间的变化Fig.2 Volume ratio of solid content changed with time
由图2可见,香菇菌丝体量在36 h之前很少,无法统计;在48 h开始明显增多,达15%,此时菌丝体处于对数生长期。相对于pH和溶氧量,这个指标反映的香菇菌丝的生长时期较滞后,因为只有菌丝体体积累到一定量时才能反映出来。48 h~102 h固形物体积增长最快,由15%增至88%,平均每小时增加量达1.35%,114 h固形物体积比达到92.1%;此后不再增加,198 h后固形物体积开始减少,其原因可能是菌丝体开始自溶。
2.4 菌丝形态变化
正常的香菇双核菌丝体细长,壁光滑,隔膜不明显,隔膜之间的间距较大,且有明显的锁状联合,可作为区分香菇菌丝体和其它杂菌的重要标志之一。在发酵过程中取样检测发现6 d之前香菇菌丝检测形态正常,菌丝分节少,壁光滑,有明显的锁状联合,菌丝体短片段较少;而第7天~第9天,搅拌速率保持80 r·min-1时,取样发现有大量菌丝体短片段生成,推测培养基中溶氧偏少、空间不足、营养成分的消耗和次级代谢产物的积累等原因致使香菇菌丝发生自溶现象,从而观察到大量菌丝体片段。
2.5 培养基的变化
培养基开始由于一些物质不溶而呈浑浊状,随着营养物质的消耗,发酵进行6 d后,发酵上清液开始澄清。这一方面可以作为发酵液是否有细菌污染的标志(细菌污染发酵液变浑浊),另一方面也可以作为发酵终点的标志。
2.6 菌丝在栽培袋中的萌发情况
不同的发酵时间及接种量对香菇菌丝萌发的影响见表1。

表1 不同发酵时间及接种量对香菇菌丝萌发的影响Tab.1 Influence on germinating of L.edodes of different fermentation time and inoculation volume
由表1可见,接种液体菌种4 d时,香菇菌丝体已开始萌发。而接种固体菌种4 d时,香菇菌丝体均未萌发;第8天时才观察到固体菌种在栽培袋上萌发,说明液体菌种在栽培料上的萌发所需要的时间要比固体菌种快。由表1可以看出,不同的接种量对菌丝在栽培料上萌发影响较大:接种量在1.5 mL和2.5 mL时不能萌发,说明接种量偏少;接种量在5 mL和10 mL时,菌丝均能萌发,且长势良好;接种量为15 mL时,发酵144 h的香菇菌丝体可以萌发,但发酵168 h的菌丝体只有部分能萌发;8 d后约40%接种孔没有萌发。以上可以看出,香菇菌种液体发酵不易超过7 d,7 d后菌丝体活力下降,直接影响接种后菌种在栽培料上的萌发。
3 讨论
食用菌液体菌种深层发酵,其中重点之一是要防止污染,一旦液体菌种被细菌或者真菌污染,整个发酵罐中的菌种将会被丢弃,这在实际生产中会带来较严重的经济损失。除了种子本身的质量外,另一个容易引起污染的环节就是接种。一般情况下将种子液接种到发酵罐时,发酵罐培养基和种子液是暴露在外界环境中的,这时如果环境的洁净等级达不到要求,很容易被杂菌污染。本研究为降低接种环节被污染的风险,采用无菌培养接种罐接种。即先将种子在超净工作台上转入无菌培养接种罐,在无菌空气中将罐中的种子液压入发酵罐中。因接种罐和发酵罐构成的是一个密闭系统,与外界完全隔离,有效降低这一环节被污染的风险。
通气量、搅拌速率、温度和pH是影响香菇液体菌种发酵的重要因素。其中通气量和搅拌速率的目的是为了调节溶氧量和菌丝球大小。在菌丝生长的对数期,有大量菌丝体生成,代谢旺盛,对氧气的消耗也多,此时要适当增加通风量和搅拌速率。但在试验中发现,搅拌速率过快(250 r·min-1)会导致菌丝球过小,且会产生很多絮状物。这些絮状物是否会对接种后菌丝的萌发产生影响,尚需进一步研究。通过将溶氧量、pH及菌丝体生成量相结合,可以推测菌丝发酵所处于的阶段。在发酵过程中采用流加饱和Na2CO3的方式,可使pH始终处于较适宜香菇菌丝生长范围,同时根据流加碱的频率和量,也能反映出香菇菌丝发酵所处阶段。
香菇菌丝液体发酵时间和接种量对液体菌种在栽培袋中的萌发至关重要。在研究中发现,液体菌种发酵6 d时要比7 d时萌发理想,在接种量低于2.5 mL时不能萌发;而发酵7 d,接种量为15 mL时,香菇菌丝只有部分萌发。分析认为,其可能原因是7 d时已有部分菌丝自溶,水分过多的不利影响超过了菌丝量增多的影响。在接种量为5 mL和10 mL时,发酵6 d和7 d均可萌发。以上分析结合经济考虑,建议香菇液体菌种发酵不要超过6 d,每个接种孔接种量在5 mL~10 mL。
[1]Kirk P,Minter DS.Dictionary of the fungi(10th edition)[M]. Oxon:CABI Europe-UK,2008.
[2]黄传华.平菇与鸡腿蘑液体菌种培养及应用技术研究[D].泰安:山东农业大学,2006.
[3]王桂金.金针菇工厂化生产液体菌种制作工艺研究[J].食用菌,2007,29(2):16-17.
[4]沈敏,李文生,周雷.杏鲍菇液体菌种研制与工厂化栽培应用[J].中国农技推广,2011,27(6):14-15.
[5]缪学翔.食用菌液体菌种生产优势、特性和效益初探[J].杭州农业科技,2003(3):18-19.
[6]沈维铎,姚志伟,杨群.香菇液体培养的工艺优化[J].武汉生物工程学院学报,2012,8(2):86-89.
[7]林翔鹰,党俊梅,马凯峰,等.香菇液体菌种深层发酵的研究[J].食用菌,2006,28(1):14-16.
[8]秦秀丽.香菇液体培养的工艺研究[J].北方园艺,2009(6):227-229.
Submerged Fermentation Technology of Liquid Spawn of Lentinus edodes
LIU Shi-ling2,LU Xing-chao1,JIANG Kun1,SHANG Dong-ni1,TANG Yue1, TIAN Shao-ping1,LI Ke-bin2,CAO Xian-tao1
(1.Hubei Wulin Land Agricultural Science&Technology Co.Ltd.,Yichang 443000,China; 2.Yichang Academy of Agricultural Sciences,Yichang 443000,China)
The submerged fermentation technology of liquid spawn of Lentinus edodes with 500 L fermenter based on the media and technology of 50 L fermenter were studied.pH value began to decline after 30 h,the dissolved oxygen tension began to decline after 38 h.The volume ratio of mycelia reached 92.16%after 120 h,the frequency of the flowing-alkaline (saturated solution of Na2CO3)is frequent highest within the range of 76 h-120 h,and the vitality of spawn mycelia cultivated for 168 h declined significantly.Lots of L.edodes mycelia fragments were seen under microscope after 192 h,and the mycelia germinated well when inoculation amount ranged within 5 mL-10 mL.The risk of contamination could be reduced effectively by inoculating with sterile culture and inoculation canister which has been patented,the proper condition for submerged fermentation of L.edodes spawn was 24℃,pH 4.5,dissolved oxygen tension within 90%-98%,agitation speed 180 r·min-1,and the optical inoculating period was within 96 hours-144 hours,inoculation volume was within the range of 5 mL-10 mL.
Lentinus edodes;liquid spawn;fermentation;technology
S646.9
A
1003-8310(2016)01-0021-04
10.13629/j.cnki.53-1054.2016.01.005
刘世玲(1966-),女,本科,正高职高级工程师,主要从事应用微生物学方面的研究工作。E-mail:2896006619@qq.com
*通信作者:曹现涛(1989-),男,硕士,工程师,主要从事香菇液体菌种发酵工艺与应用研究。E-mail:wh201206@126.com
2015-11-20

