结肠癌组织中p53凋亡刺激蛋白家族表达水平及其与临床病理学特征的相关性研究
刘 燕,周长春,田 强,孙阿妮,丰义宽,李国庆
·临床医学·
结肠癌组织中p53凋亡刺激蛋白家族表达水平及其与临床病理学特征的相关性研究
刘 燕1,周长春2,田 强1,孙阿妮3,丰义宽1,李国庆1
目的:探讨结肠癌组织中p53凋亡刺激蛋白(ASPP)家族表达水平及其与临床病理学特征的相关性。方法:选取结肠癌患者的结肠癌组织共50例,以及健康人的正常结肠组织共30例。分析ASPP家族与结肠癌的组织分化程度、浸润深度和淋巴结转移等临床特征的相关性。结果:结肠癌组织与正常结肠组织中ASPP1和ASPP2的阳性表达率差异均无统计学意义(P>0.05);而结肠癌组织中iASPP的阳性表达率显著高于正常结肠组织(P<0.05);结肠癌组织中iASPP的阳性表达率在肿瘤病理分级间差异均无统计学意义(P>0.05),而ASPP1和ASPP2的阳性表达在肿瘤病理分级间差异均有统计学意义(P<0.05和P<0.01);结肠癌组织中ASPP1与iASPP的阳性表达在肿瘤浸润深度间差异均无统计学意义(P>0.05),ASPP2的阳性表达在肿瘤浸润深度间差异有统计学意义(P<0.05);而结肠癌组织中ASPP1、ASPP2和iASPP的阳性表达均在淋巴结有无转移间差异均无统计学意义(P>0.05)。结论:iASPP在结肠癌组织和正常组织的阳性表达的差异,表明其有可能成为结肠疾病良、恶性的诊断及鉴别指标之一;ASPP2的阳性表达与结肠癌病理分期和分级有相关关系,表明其有可能成为结肠癌预后指标之一。
结肠肿瘤;p53凋亡刺激蛋白;免疫组织化学;细胞凋亡
结肠癌是常见的胃肠道恶性肿瘤,由于近年来人们饮食和生活习惯等因素的影响,其发病率显著提高,严重危害人们的健康[1]。结肠癌早期无明显症状,患者常常在确诊后就失去了根治的机会[2]。目前为止发现的与人类肿瘤相关性最高的基因是抑癌基因P53,对维持基因组稳定具有关键性的作用。而在肿瘤发生发展过程中,抑癌基因P53因子发挥着十分重要的作用,P53凋亡刺激蛋白(apoptosis stimulating protein of P53,ASPP)具有保守的C端序列,可通过Src同源结构域3以及锚蛋白重复序列与P53产生相互影响。目前为止,ASPP基因家族中已发现ASPP1、ASPP2、iASPP三个成员,其中P53与ASPP1、ASPP2结合可激活并促进其抑癌功能,而与iASPP则会对其抑癌功能起抑制作用。研究[3-4]表明,ASPP家族可作为肿瘤早期诊断和治疗以及判断预后研究的新方向,即通过促进ASPP1和ASPP2的阳性表达,抑制iASPP的阳性表达从而促进P53诱导肿瘤细胞凋亡,抑制肿瘤的发展。但目前少见对ASPP家族与结肠癌的关系的相关报道。本研究探讨结肠癌组织中ASPP家族表达水平及其与临床病理学特征的相关性。现作报道。
1 资料与方法
1.1 一般资料 收集2008年3月至2014年11月收治于潍坊市人民医院的结肠癌患者的结肠癌组织标本共50例,男32例,女18例;年龄37~76岁;按组织学等级分为高分化腺癌组12例,中分化腺癌组23例,低分化腺癌组分别15例;按TNM分期分为T1(浸润黏膜下层)组8例,T2(浸润固有肌层)组9例,T3(穿透肌层至浆膜下)组28例,T4(穿透浆膜层和侵及其他脏器)组5例;按有无淋巴转移分为有淋巴转移组21例,无淋巴转移组29例。同时选取30例健康人的正常结肠组织标本作为对照组。
1.2 免疫组织化学SP法检测ASPP1、ASPP2和iASPP表达 将结肠癌患者和健康人正常结肠组织石蜡标本按4 μm的厚度进行连续切片,并分别进行常规病理组织检查(HE染色)和免疫组织化学染色(SP法)。以已知的阳性切片作阳性对照,用PBS取代一抗作阴性对照。若肿瘤细胞细胞质中见棕黄色颗粒则可判定为阳性细胞,高倍镜下取4个视野各计数200个细胞,把染色结果按阳性细胞百分比分为:-表示阳性细胞<5%;+表示阳性细胞5%~25%;2+表示阳性细胞>25%~50%;3+表示阳性细胞>50%;其中-和+为表达阴性,2+和3+为表达阳性。
1.3 统计学方法 采用χ2检验和秩和检验。
2 结果
2.1 结肠癌组织和正常结肠组中ASPP1、ASPP2和iASPP的阳性表达率比较 结肠癌组织中ASPP1和ASPP2的阳性表达率与正常结肠组织差异均无统计学意义(P>0.05);而结肠癌组织中iASPP的阳性表达率比正常结肠组织高(P<0.05)(见表1)。
表1 结肠癌组织和正常结肠组中ASPP1、ASPP2和iASPP的阳性表达率比较[n;百分率(%)]
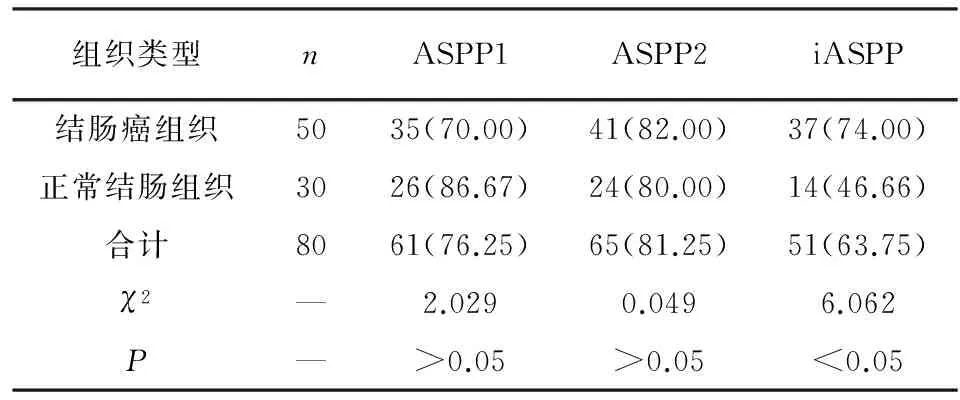
组织类型nASPP1ASPP2iASPP结肠癌组织5035(70.00)41(82.00)37(74.00)正常结肠组织3026(86.67)24(80.00)14(46.66)合计8061(76.25)65(81.25)51(63.75)χ2—2.0290.0496.062P—>0.05>0.05<0.05
2.2 不同病理分级结肠癌组织中ASPP1、ASPP2和iASPP阳性表达率比较 高、中、低分化结肠癌组织中ASPP1的阳性表达率差异有统计学意义(P<0.05);高、中、低分化结肠癌组织中ASPP2的阳性表达率差异亦有统计学意义(P<0.01);而高、中、低分化结肠癌组织中iASPP的阳性表达率差异无统计学意义(P>0.05)(见表2)。
表2 不同病理分级结肠癌组织中ASPP1、ASPP2和iASPP阳性表达率比较[n;百分率(%)]
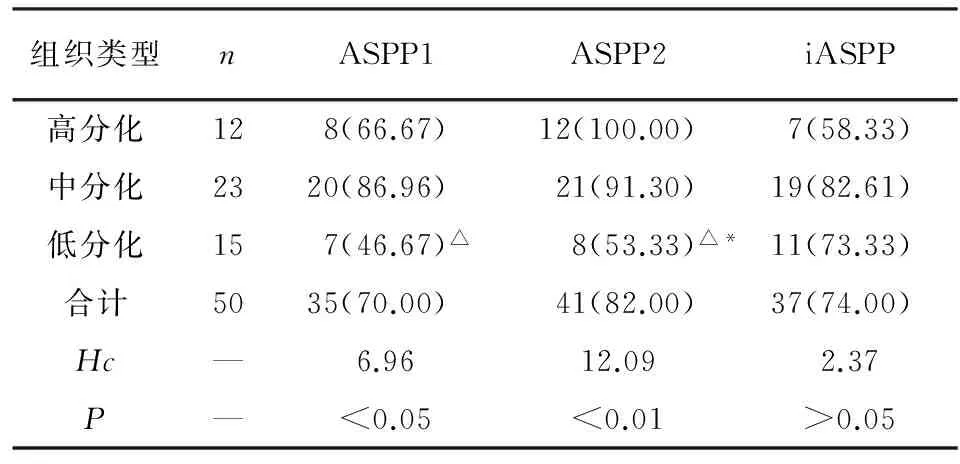
组织类型nASPP1ASPP2iASPP高分化128(66.67)12(100.00)7(58.33)中分化2320(86.96)21(91.30)19(82.61)低分化157(46.67)△8(53.33)△*11(73.33)合计5035(70.00)41(82.00)37(74.00)Hc—6.9612.092.37P—<0.05<0.01>0.05
两两比较秩和检验:与高分化比较*P<0.05;与中分化比较△P<0.05
2.3 不同TNM分期结肠癌组织中ASPP1、ASPP2和iASPP的阳性表达率比较 结肠癌组织中ASPP1和iASPP在T1、T2、T3、T4期的阳性表达率差异均无统计学意义(P>0.05);而ASPP2在T1、T2、T3、T4期的阳性表达率差异有统计学意义(P<0.05)(见表3)。
表3 不同TNM分期结肠癌组织中ASPP1、ASPP2和iASPP的阳性表达率比较[n;百分率(%)]

TNM分期nASPP1ASPP2iASPPT188(100.00)8(100.00)6(75.00)T296(66.67)8(88.89)5(55.56)T32819(67.86)23(82.14)21(75.00)T452(40.00)2(40.00)5(100.00)合计5035(70.00)41(82.00)37(74.00)Hc—5.577.863.30P—>0.05<0.05>0.05
2.4 淋巴结转移和无转移结肠癌组织中ASPP1、ASPP2和iASPP阳性表达率比较 淋巴结转移和无转移结结肠癌组织中ASPP1、ASPP2和iASPP的阳性表达率差异均无统计学意义(P>0.05)(见表4)。
表4 淋巴结转移和无转移结肠癌组织中ASPP1、ASPP2和iASPP阳性表达率比较[n;百分率(%)]
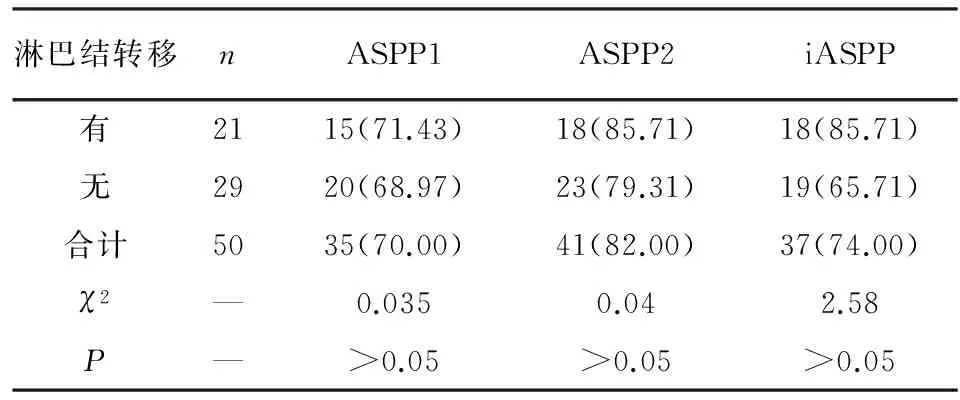
淋巴结转移nASPP1ASPP2iASPP有2115(71.43)18(85.71)18(85.71)无2920(68.97)23(79.31)19(65.71)合计5035(70.00)41(82.00)37(74.00)χ2—0.0350.042.58P—>0.05>0.05>0.05
3 讨论
ASPP家族能通过与P53家族的结合从而控制细胞的凋亡,是ASPP家族最主要的功能。其中ASPP1和ASPP2可通过SH3以及锚蛋白重复序列与P53的DNA结合域结合产生相互影响,激活P53的促凋亡功能,并在特异性上使凋亡相关因素提前表达;iASPP通过与ASPP1、ASPP2的竞争中与P53结合,从而抑制P53的促凋亡活性。
有研究[5]显示,ASPP的表达失调明显影响乳腺癌的发生发展,且ASPP家族成员的表达在突变型和野生型P53的肿瘤细胞中均有发生,而ASPP1和ASPP2的表达一般下调,iASPP则相反。有关白血病的研究[6]显示,ASPP1在白细胞中均呈低表达,而iASPP的表达则升高,提示ASPP家族各成员的不同表达是造血系统肿瘤发生过程中的关键环节,ASPP有可能作为白血病诊断其中之一的分子标志物。而iASPP在前列腺癌组织中的表达明显比正常组织的高,抑制iASPP的表达后,肿瘤细胞的生长得到有效抑制[7]。有研究[8]表明,幽门螺旋杆菌感染可能会由于ASPP2表达的下调和iASPP表达的上调从而诱发胃癌。ASPP家族各成员表达差异对肿瘤的发生发展具有重要影响,但其对结肠癌影响尚未得到足够的关注和研究。因此,本研究采用免疫组织化学方法对ASPP家族各成员在结肠癌组织不同分化程度、浸润深度、淋巴结转移中表达情况进行检测,分析二者的相关关系以及对结肠癌预后的影响,从而帮助阐明结肠癌的发病原理,并为临床治疗结肠癌提供理论依据。
本研究中,结肠癌组织中ASPP1、ASPP2的阳性表达率(70.00%、82.00%)与正常结肠组织ASPP1、ASPP2的阳性表达率(86.67%、80.00%)差异均无统计学意义(P>0.05);而结肠癌组织中iASPP的阳性表达率(74.00%)高于正常结肠组织(46.66%)(P<0.05),提示iASPP的表达率的改变可影响结肠癌的发生,在肿瘤细胞的生成中起重要作用,iASPP表达升高改变P53与DNA的结合能力,从而抑制P53的促细胞凋亡功能。因此猜测iASPP可能会成为结肠疾病良、恶性的诊断和鉴别指标之一。
本研究中,结肠癌组织中iASPP与肿瘤细胞分化程度和浸润深度均无明显关系(P>0.05),且ASPP家族3个成员的表达在淋巴结有无转移间差异均无统计学意义(P>0.05),但ASPP2的阳性表达率在肿瘤细胞分化程度与浸润深度间差异均有统计学意义(P<0.01和P<0.05),提示ASPP2可能与结肠癌的恶性程度有紧密关系,因此ASPP2可能作为结肠癌预后指标之一。
[1] 王贲士,乔录新,石英,等.p53凋亡刺激蛋白2抑制奥沙利铂诱导的结肠癌细胞自噬并促进凋亡[J].细胞与分子免疫学杂志,2015,31(7):898.
[2] CAN G,AKPINAR B,BARAN Y,etal.5-Fluorouracil signaling through a calcium-calmodulin-dependent pathway is required for p53 activation and apoptosis in colon carcinoma cells[J].Oncogene,2013,32(38):4529.
[3] 王海莉,李晓莹,韩笑,等.ASPP家族在结肠癌组织中的表达及其临床意义[J].吉林大学学报(医学版),2014,12(3):659.
[4] RUDOLF K,CERVINKA M,RUDOLF E.Sulforaphane-induced apoptosis involves p53 and p38 in melanoma cells[J].Apoptosis,2013,19(4):1.
[5] SHIBATA MA,MAROULAKOU G,JORCYK CL,etal.Large T Antigen Transgenic Mice:Suppression of Apoptosis during the Transition from Preneoplasia to Carcinoma1[J].Cancer Research,2013,56(13):2998.
[6] 侯庆生,赵红伟,公维鹏,等.奥沙利铂诱导结肠癌HCT116细胞凋亡过程中p53凋亡刺激蛋白2的磷酸化对p53促凋亡功能的影响[J].中华肿瘤杂志,2014,36(6):418.
[7] 陈杰,杨益民,杨靓靓,等.iASPP真核表达载体构建及其功能鉴定[J].重庆医学,2013,3(35):4233.
[8] CHEN DY,DAI DF,HUA Y,etal.p53 suppresses 14-3-3γ by stimulating proteasome-mediated 14-3-3γ protein degradation[J].Int J Oncol,2015,46(2):818.
(本文编辑 刘梦楠)
The expression of ASPP family genes and its correlation with clinical pathological features in colon cancer tissue
LIU Yan1,ZHOU Chang-chun2,TIAN Qiang1,SUN A-ni3,FENG Yi-kuan1,LI Guo-qing1
(1.DepartmentofGastroenterology,3.OfficeofInfection,ThePeople′sHospitalofWeifang,WeifangShandong261000;2.DepartmentofInternalMedicine,TheWestBranchofWeifangTraditionalChineseMedicineHospital,WeifangShandong261000,China)
Objective:To explore the expression levels of apoptosis stimulating protein of P53(ASPP) family genes in colon cancer tissue,and its correlation with clinical pathological features.Methods:Fifty colon cancer tissue specimens and 30 normal colon tissue specimens were investigated.The correlations of the ASPP family with the differentiation,depth of invasion and lymph node metastasis of colon cancer were analyzed.Results:The differences of the expressions of ASPP1 and ASPP2 between the colon cancer and normal colon tissue were not statistically significant(P>0.05),and the positive expression rate of iASPP in colon cancer was significantly higher than that in normal colon tissue(P<0.05).The differences of the positive expression rate of iASPP in different tumor pathological grading was not statistically significant(P>0.05),and the differences of the positive expression rate of ASPP1 and ASPP2 in different tumor pathological grading were statistically significant(P<0.05 andP<0.01).The differences of the positive expression rates of ASPP1 and iASPP in different tumor invasion depth were not statistically significant(P>0.05),and the difference of the positive expression rate of ASPP2 in different tumor invasion depth was statistically significant(P<0.05).The differences of the positive expression rates of ASPP1,ASPP2and iASPP in different lymph node metastasis of tumor were not statistically significant(P>0.05).Conclusions:The positive expression of iASPP between colon cancer and normal tissue is different,which may become one index in the diagnosis and differential diagnosis of colon malignant and benign diseases.The positive expression of ASPP2 is correlated with the pathological stage and grade of colon cancer,which may be one prognostic indicator of colon cancer.
colonic neoplasms;apoptosis stimulating protein of p53;immunohistochemistry;apoptosis
2016-01-11
山东省潍坊市人民医院1.消化内科,3.感染办公室,261000;2.山东省潍坊市中医院西城分院 内科,261000
刘 燕(1974-),女,主治医师.
1000-2200(2016)12-1594-03
R 735.35
A
10.13898/j.cnki.issn.1000-2200.2016.12.017

