香叶木素诱导人肝癌HepG2细胞凋亡及周期阻滞的机制研究
杨阳,林满洲,黄艺文,陈明
(广东医学院附属医院肝胆外科,广东 湛江 524001)
香叶木素诱导人肝癌HepG2细胞凋亡及周期阻滞的机制研究
杨阳,林满洲,黄艺文,陈明
(广东医学院附属医院肝胆外科,广东 湛江 524001)
目的研究香叶木素对人肝癌HepG2细胞的增殖、凋亡及周期阻滞的影响并揭示其分子机制。方法MTT方法检测不同浓度香叶木素对肝癌HepG2的细胞活力的影响;流式细胞术检测不同浓度香叶木素处理对HepG2细胞周期阻滞及细胞凋亡的作用;Western blot检测香叶木素处理对细胞p53、Bcl-2、Bax、Cleaved-caspase3、Cleaved-caspase8、Cleaved-PARP、Bak、cdc2、cyclinB1、p21等细胞周期调节或细胞凋亡相关蛋白表达的调节。结果香叶木素能显著抑制人肝癌HepG2细胞的增殖并且诱导细胞凋亡(P<0.05);流式细胞术对细胞周期检测示:香叶木素处理HepG2细胞,使G0/G1期细胞比例显著降低,而G2/M期细胞比例显著升高(P<0.05)。香叶木素可下调HepG2细胞中抗凋亡蛋白Bcl-2、cdc2、cyclinB1的蛋白表达,上调p53、p21、Bax、Bak,Cleaved-caspase3、Cleaved-caspase8、Cleaved-PARP等促凋亡蛋白。结论香叶木素在体外实验能通过激活p53/Bcl-2细胞凋亡通路抑制人肝癌HepG2细胞的增殖及促进细胞凋亡,同时通过上调p53、p21下调cdc2、cyclinB1诱导细胞G2/M周期阻滞。
香叶木素;细胞凋亡;细胞周期阻滞;肝癌
肝细胞癌是常见的恶性肿瘤之一,我国肝癌患者多有肝炎肝硬化背景,手术切除率低,为延长肝癌患者生存期,化学药物治疗仍是一个重要措施,临床上化疗药物主要是通过诱导细胞凋亡来消除肿瘤细胞,其疗效过程中如何与抑制细胞增殖,诱导细胞凋亡的水平有关。
临床上合成的化疗药物副作用大,选择性差,开发新的及强大功效的天然药物显得十分重要,本研究中香叶木素(DIOS)是我国南方药用植物的有效成分,其主要活性成分为黄酮类化合物,此类物质具有抗氧化、抗感染、抗休克等多种作用,目前,有关研究报道关于香叶木素在诱导细胞凋亡方面的抗肿瘤作用机制的文章甚少。本实验以此为切入点,选择HepG2细胞作为实验研究对象,通过细胞实验研究香叶木素对人肝癌HepG2细胞活力、细胞凋亡率及细胞周期阻滞的影响。
1 材料与方法
1.1 细胞 人肝癌细胞系HepG2由广东医学院附属医院临床医学研究中心肝胆外科提供。用含有10%胎牛血清、100 U/ml青霉素、100 mg/L链霉素的RPMI-1640培养基在5%CO237℃恒温培养箱中培养。2~3 d传代1次,取对数生长期细胞进行实验。
1.2 试剂 香叶木素(Sigma,美国),AnnexinVFITC/PI细胞调亡检测试剂盒(BD,美国),人p53、Bcl-2、Bax、Cleaved-caspase3、Cleaved-caspase8、Cleav ed-PARP、Bak、cdc2、cyclinB1、p21抗体(CST,美国),八甲基偶氮唑蓝(MTT)及碘化丙啶(PI)染液(Sigma,美国),细胞蛋白提取试剂盒(碧云天,中国),PRMI1640培养基(Gibco,美国)。
1.3 方法
1.3.1 细胞增殖检测(MTT法) 取对数生长期的HepG2细胞,消化,计数,用10%胎牛血清(FBS)培养液配制成7.5×103个/孔接种于96孔培养板,孵育24 h待细胞贴壁后加入香叶木素(终药物浓度分别为0 μg/ml、1 μg/ml、2 μg/ml、5 μg/ml、10 μg/ml、15 μg/ml、20 μg/ml、25 μg/ml、30 μg/ml),每组设5个复孔,设置对照组及实验组,分别培养6 h、12 h、24 h、48 h,弃上清液,每孔加入100 μl DMSO,振荡10 min待结晶充分溶解后在酶标仪490 nm波长处测定每孔吸光度(A)。计算细胞增殖抑制率,实验重复3次。抑制率=(对照组A-试验组A)/(对照组A-空白组A)×100%
1.3.2 流式细胞术检测细胞凋亡变化 收集对照组和实验组不同浓度香叶木素处理24 h后的HepG2细胞制成细胞悬液,加入预冷的磷酸盐缓冲液(PBS)离心5 min,洗涤细胞,重复一次。取100 μl细胞悬液,分别加入5 μl AnnexinV-FITC和PI混匀,避光放置20 min,上机前加入400 μl缓冲液,混匀后用流式细胞术检测细胞凋亡率。
1.3.3 检测细胞周期的变化 取对数生长期的HepG细胞(4.5×103个/ml的浓度,3 ml/孔接种于6孔培养板内,培养24 h后),对照组进行换液,实验组给予香叶木素(终浓度分别为0 μg/ml、5 μg/ml、10 μg/ml、20 μg/ml)作用24 h后收集细胞,离心1 000 r/min×5 min,用预冷PBS洗涤后用70%乙醇固定过夜,离心除去乙醇,再用预冷PBS洗涤,PI染色,4℃避光孵育染色30 min后,用流式细胞仪检测细胞周期时相的分布,此实验重复3次。
1.3.4 细胞周期蛋白p21、cdc2、cyclinB1及凋亡蛋白Bcl-2及Bax、Cleaved-caspase3、Cleaved-caspase8、Cleaved-PARP、Bak蛋白表达变化的检测 收集对数生长期的HepG2细胞,按照细胞蛋白质提取试剂盒的步骤提取细胞总蛋白,收集细胞,用BCA法测定蛋白含量,95℃变性10 min,上20 μg蛋白样品进行聚丙烯酰胺凝胶电泳,将凝胶中分离的蛋白转印PVDF膜。5%脱脂牛奶封闭2 h后,一抗4℃孵育24 h,二抗37℃孵育2 h,用TBST洗膜后进行化学发光检测目的条带的表达,实验独立重复3次。
1.4 统计学方法 应用SPSS17.0统计软件进行实验数据分析。计量资料以均数±标准差(±s)表示,多组间均数比较采用方差分析,其中两两比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 DIOS对HepG2细胞形态学的影响 倒置相差显微镜下观察到:对照组细胞触角纤细,生长旺盛,形态规则,细胞轮廓清晰,大小均一,折光度强,贴壁良好。经香叶木素处理后的实验组可见HepG2细胞形态不规则,细胞形态变圆,细胞间隙增大,部分细胞呈漂浮状态或贴壁不牢,细胞碎片随浓度的增大而增多,且随药物浓度增加,细胞数明显减少,见图1。

图1 不同浓度香叶木素(0 μg/ml、5 μg/ml、10 μg/ml、15 μg/ml)处理肝癌HepG2细胞24 h后光学显微镜观察
2.2 DIOS对HepG2细胞活力的影响 香叶木素能够抑制HepG2细胞的活力,且具有时间浓度依赖性(P<0.05),见图2。
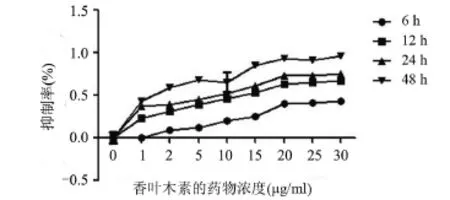
图2 香叶木素作用HepG2细胞不同时间的细胞活力
2.3 DIOS对HepG2细胞凋亡的影响 香叶木素可促使HepG2细胞凋亡,且随香叶木素药物浓度的增加,早期凋亡及晚期凋亡的细胞数逐渐增加且具有一定的浓度依赖性(P<0.05),见图3。

图3 不同浓度香叶木素作用HepG2细胞24 h后诱导肝癌HepG2细胞的凋亡率
2.4 DIOS对HepG2细胞周期的影响 香叶木素可促使HepG2细胞凋亡,且随香叶木素药物浓度的增加,早期凋亡及晚期凋亡的细胞数逐渐增加(P<0.05),细胞周期结果显示导致G0/G1期细胞数比例降低,G2/M期细胞数比例升高,且具有一定的浓度依赖性(P<0.05),见图4。
2.5 DIOS对HepG2细胞Bcl-2、Bax、Bad、cdc2、p21、p53、cyclinB1、Cleaved-caspase3、Cleaved-caspase8、Cleaved-PARP蛋白的影响 随着香叶木素药物浓度的增加,Bax、Bak、Cleved-capase3、Cleaved-caspase8、Cleaved-PARP、p21、p53蛋白表达增高,Bcl-2、cyclinB1、cdc2蛋白表达下调,见图5。

图4 不同浓度香叶木素对HepG2细胞周期的影响

图5 不同浓度香叶木素作用HepG2细胞24 h后周期蛋白及凋亡蛋白的表达
3 讨 论
我国肝癌发病率高,大多数患者有肝硬化基础,约70%的患者失去手术切除机会,故在肝癌综合治疗中化疗占据着重要的地位,目前常用的化疗药物对肝细胞肝癌疗效欠佳,副作用大,寻求疗效好、副作用低的天然药物具有很重要的科学与应用价值[1]。
香叶木素存在自然界的草本药物中,它是我国南方药用植物[Striga asiatica(L.)O.Kuntze(玄香科,Scrophulariaceae)]的有效成分,含有香叶木素的Dianthus versicolor Fisch曾作为传统蒙古药材用于治疗肝细胞恶性肿瘤等疾病。其主要的药物活性成分为黄酮类化合物,此类物质具有抗活性氧自由基、抗感染、抗肿瘤等多种奇特功效;而香叶木素是较为特殊的一种黄酮类化合物,它含有一种抑制人类肝细胞CYP1A酶活力的天然黄酮类化合物,具有抗诱变和抗变应特性[2]。香叶木素对于抑制肿瘤细胞的生长及侵袭的细胞实验研究甚少,因此深入研究香叶木素对肿瘤细胞的周期阻滞及细胞凋亡作用机制为研发新型抗癌药物更具有科研意义。
Cdc2(Cyclin-dependent kinases1,CDK1)生物学上称为细胞周期蛋白依赖性激酶1,是一个高度保守的丝氨酸/苏氨酸蛋白激酶。Cdc2能促使真核细胞周期G2/M期检测点起正性调节作用,它与细胞色素B1(cyclinB1)相互作用形成有丝分裂促进因子复合物,促进细胞进入M期。有研究表明,cyclinA和Cdc2的表达能抑制cyclinB/Cdc2复合体的形成,而cyclinB/Cdc2复合体在细胞进入有丝分裂过程中发挥了重要的作用。而该研究表明香叶木素能下调Cdc2及cyclinB1的蛋白表达,从而促使肝癌HepG2细胞的细胞周期阻滞于G2/M期。香叶木素同样能够通过激活p53通路调控p21周期蛋白的高表达,而p21周期蛋白能抑制cdc2表达,从而促使细胞周期阻滞于G2/M期[3]。
本实验中通过倒置相差显微镜观察到香叶木素能够明显诱导人肝癌HepG2细胞的凋亡,且通过MTT实验进一步说明香叶木素对人肝癌HepG2细胞的活力有明显的抑制作用。而其后的流式细胞术检测香叶木素处理后的肝癌细胞将进一步证明随着香叶木素药物浓度的增加与人肝癌HepG2细胞的凋亡数呈正相关[4]。而实验最后的Western blot的结果发现p53、Bcl-2、Bax、Bak、Cleaved-PARP、Cleavd-caspase8、Cleaved-caspase3高表达进一步证明了香叶能通过p53/线粒体通路诱导细胞凋亡。
Bcl-2蛋白是Bcl-2原癌基因的编码产物,是细胞存活促进因子,Bcl-2为细胞凋亡过程中的原癌基因之一。Bcl-2蛋白家族参与细胞线粒体途径凋亡调控,Bcl-2蛋白家族可分为凋亡抑制蛋白和促细胞凋亡蛋白两大类。其中Bcl-2是抑制细胞凋亡蛋白,Bax是典型的促细胞凋亡蛋白,而Bax与Bcl-2相结合发挥调控这细胞凋亡这一过程,而本实验中发现香叶木素对HepG2细胞的Bcl-2家族蛋白的检测发现香叶木素能够通过线粒体通路诱导Bcl-2蛋白的低表达,增强Bax凋亡促进蛋白的高表达,且Bax/Bcl-2比值逐渐增大,这一现象进一步阐明香叶木素能够通过线粒体途径的Bcl-2蛋白家族诱导细胞凋亡[5]。
在维持DNA的稳定性和完整性的过程中,PARP (聚二磷酸腺苷核糖聚合酶)是DNA损伤的一个重要敏感感受器。Caspase-3在正常细胞内以无活性酶原形式存在于胞浆中,当细胞凋亡程序被激活,形成两个小亚基和大亚基,随之导致细胞的凋亡。而PARP是细胞凋亡的最终执行者,通过外源性及内源性线粒体途径启动细胞凋亡,细胞的最终凋亡也反馈性的激活Caspase-3的表达。因此,在生物学上一致认为Caspase-3的活化是细胞凋亡发生的重要标志。若DNA损伤严重且无法修复时,以底物形式参与凋亡从而诱发细胞生物学的改变[6]。而PARP是通过Caspase-3的活化来诱导细胞的最终凋亡,也是凋亡进程中的最后一阶段。该研究中发现香叶木素能随着浓度的增加促使Cleaved-PARP表达显著上升,且在这一过程中Cleaved-caspase3表达显著上升,与Cleaved-PARP的变化一致[7]。
综上所述,香叶木素通过p53及线粒体凋亡通路调控Bcl-2表达的下调,上调Bax、Cleaved-caspase3、Cleaved-caspase8、Cleaved-PARP、Bak,在上述体外实验证明香叶木素能以时间-浓度效应抑制人肝癌HepG2细胞的活力、促进细胞凋亡,影响细胞周期蛋白的表达从而促使细胞周期阻滞于G2/M期,促使肝癌细胞HepG2细胞的生长阻滞。因此,香叶木素是一种潜在的肝癌化疗候选药物,且未来实验对香叶木素如何影响细胞周期蛋白的表达将作进一步探讨。
[1]Darvesh AS,Aggarwal B,Bishayee A.Curcumin and liver cancer∶a review [J].Current Pharmaceutical Biotechnology,2012,13(1)∶218-228.
[2]Kanaze FI,Bounartzi MI,Niopas I.A validated HPLC determination of the flavone aglycone diosmetin in human plasma[J].Biomedical Chromatography,2004,18(10)∶800-804.
[3]Obmann A,Werner I,Presser A,et al.Flavonoid C-and O-glycosides from the Mongolian medicinal plant Dianthus versicolor Fisch[J]. Carbohydrate Research,2011,346(13)∶1868-1875.
[4]刘溪.吴茱萸碱诱导人肝癌细胞HepG-2细胞周期阻滞机制研究[D].哈尔滨∶哈尔滨商业大学,2012.
[5]Liu B,Zhou Z,Zhou W,et al.Resveratrol inhibits proliferation in human colorectal carcinoma cells by inducing G1/S phase cell cycle arrest and apoptosis through caspase/cyclin CDK pathways[J].Molecular Medicine Reports,2014,10(4)∶1697-1702.
[6]Eleawa SM,Alkhateeb MA,Alhashem FH,et al.Resveratrol reverses cadmium chloride-induced testicular damage and subfertility by downregulating p53 and Bax and upregulating gonadotropins and Bcl-2 gene expression[J].The Journal of Reproduction and Development,2014,60(2)∶115.
[7]Lin B,Tan X,Liang J,et al.A reduction in reactive oxygen species contributes to dihydromyricetin-induced apoptosis in human hepatocellular carcinoma cells[J].Scientific Reports,2014,4∶7041.
Promoting effect of Diosmetin on the cell cycle arrest and cell apoptosis in HepG2 cell and its mechanism.
YANG Yang,LIN Man-zhou,HUANG Yi-wen,CHEN Ming.Department of Hepatobiliary Surgery,the Affiliated Hospital of Guangdong Medical College,Zhanjiang 524001,Guangdong,CHINA
ObjectiveTo study the effect of Diosmetin on cell proliferation,cell apoptosis and cell cycle arrest in human hepatocellular carcinoma HepG2 cells,and dissect the underlying mechanism.MethodsMTT assay was performed to detect the viability of HepG2 cells under different levels of Diosmetin.The cell apoptosis rate and cell cycle arrest were analyzed by flow cytometry(FCM).Western blot was applied to measure the protein levels of P53, Bcl-2,Bax,Cleaved-caspase3,Cleaved-caspase8,Cleaved-PARP,Bak,cdc2,cyclinB1,P21.ResultsDiosmetin treatment on HepG2 cells significantly inhibited cell proliferation and induced cell apoptosis(P<0.05).FCM results showed that Diosmetin treatment significantly promoted cell cycle arrest in G2/M phase in HepG2 cells(P<0.05),with the proportion of cells in G0/G1phase significantly reduced.Besides,Diosmetin significantly downregulates Bcl-2,cdc2,cyclinB1,and up-regulated Bax,Cleaved-caspase3,Cleaved-caspase8,Cleaved-PARP,Bak,P53,P21.ConclusionDiosmetin inhibits HepG2 cell proliferation and induces cell apoptosis by activation of p53/Bcl-2 pathway.Meanwhile,Diosmetin treatment induces G2/M cell cycle arrest in HepG2 cell by down-regulation of cell cycle related protein cdc2,cyclinB1 and up-regulation of P53,P21.
Diosmetin;Cell apoptosis;Cell cycle arrest;Hepatocellular carcinoma
R735.7
A
1003—6350(2016)03—0354—04
2015-09-05)
陈明。E-mail:fykjk@163.com
doi∶10.3969/j.issn.1003-6350.2016.03.004

