一株鲢鱼肠道中嗜水气单胞菌拮抗菌株的筛选、鉴定及特性
洪 军, 白玉珍, 马肖梦, 韩 莎, 孔 丽
(河南城建学院 生命科学与工程学院,河南 平顶山 467036)
一株鲢鱼肠道中嗜水气单胞菌拮抗菌株的筛选、鉴定及特性
洪 军, 白玉珍, 马肖梦, 韩 莎, 孔 丽
(河南城建学院 生命科学与工程学院,河南 平顶山 467036)
从鲢鱼肠道中筛选嗜水气单胞菌的拮抗菌株,并对生长培养条件进行研究,以期为鲢鱼养殖过程中嗜水气单胞菌病的生物防治提供理论依据。通过对鲢鱼肠道中嗜水气单胞菌拮抗菌株的分离、筛选,并对其中拮抗作用较稳定的菌株进行生理生化、分子鉴定以及生长培养特性优化。经过多次筛选得到了15株拮抗效果较好的目标菌株,其中拮抗作用较稳定的S4为气单胞菌属,是偏碱性革兰氏阴性短杆菌;通过单因素和正交实验表明,S4最佳生长培养条件为1.5 g/dL淀粉,1.5 g/dL牛肉膏,1 g/dL氯化钙,32℃,pH 8.5,接种体积分数3%。研究结果为嗜水气单胞菌的防治及拮抗菌S4的应用提供理论依据。
嗜水气单胞菌;鲢鱼;拮抗作用;菌株鉴定;S4;生长培养条件
我国淡水资源丰富,鲢鱼是我国四大淡水鱼之一,产量最高[1]。嗜水气单胞菌(Aeromonas hydrophila)是淡水养殖鱼类暴发性传染病的主要病原菌之一,它能引发多种水生动物的传染病,导致水产动物的出血症,给养殖业造成严重的经济损失[2]。治疗该菌引发的疾病主要使用化学药物、抗生素、中草药提取物等[3-4],如应用大量抗生素,虽然在一定时期内取得了令人满意的效果,但因抗生素易产生耐药、药物残留及毒副作用,长期在动物饲料中添加和滥用抗生素不仅影响动物和人类的健康,而且还导致“超级病菌”的出现,威胁着人类的生存。因此探索利用有益微生物进行生物防治成为必然。目前已有许多关于通过分离筛选拮抗微生物进行防治水产细菌性病害的报道,且取得较好的效果[5-6]。生物防治作为综合防治水产病害的措施之一正倍受关注,它符合环境保护和有机化食品的要求,对生态平衡和农业的可持续发展具有特别重要的意义。
目前关于从鲢鱼体内分离筛选拮抗嗜水气单胞菌菌株及相关研究未见报道。因此,作者拟以平顶山白龟山水库中野生的鲢鱼为研究对象,从其肠道粘膜中分离菌株进行筛选,以致病性鲢鱼嗜水气单胞菌为指示菌,采用滤纸片法和打孔法等分离拮抗效果好、遗传稳定的菌株进行生理生化和16S rRNA分子鉴定以及生长培养特性优化,旨在为鲢鱼养殖过程中嗜水气单胞菌病的生物防治和将来商品化的拮抗微生物制剂的制备提供理论依据。
1 材料与方法
1.1 实验材料
实验菌:鲢鱼肠道单菌;病原菌:嗜水气单胞菌(XS91-4-1),从患出血性败血症的鲢鱼中分离,购于中科院水生研究所;试验用鱼:来自平顶山白龟山水库中野生健康鲢鱼;培养基:营养琼脂和营养肉汤,其中营养肉汤在培养条件优化实验中,作为基础培养基使用;指示菌:金黄色葡萄球菌(ATCC25922)、大肠杆菌(ATCC25922)、嗜水气单胞菌(GIM1.172)、绿脓杆菌(CCTCC2620)、巨大芽孢杆菌(CICC0.217)、F41:均由作者所在实验室保存。
1.2 实验方法
1.2.1 鲢鱼肠道中微生物的分离 参照蒋启欢[7]等的方法,在无菌条件下用解剖刀刮取除肠道内容物后,用无菌生理盐水冲洗3次,然后用解剖剪将肠道剪短,用研磨器研碎,并加无菌生理盐水适量,振荡均匀后静置,取上层液。将上层液按100、101、102倍梯度稀释,取稀释液各100 μL用涂布棒均匀涂布平板,最后将平板分别倒置,37℃培养24~36 h。选择合适稀释度的平板,挑取可疑菌落进行平板划线,并经多次划线得到纯化细菌。
1.2.2 拮抗菌株的筛选 采用琼脂平板扩散法[6],将病原性嗜水气单胞菌培养过夜,调整菌液密度为107CFU/mL,取100 μL涂布于营养琼脂平板上,打孔,取疑似拮抗菌株50 μL加入孔中,再置于28℃培养24 h,观察孔穴周围是否产生抑菌圈,对产生抑菌圈的菌落进行分离纯化,反复筛选后-80℃超低温冰箱保存。
1.2.3 拮抗菌株的抗菌谱测定 采用琼脂平板扩散法[8],将指示菌(大肠杆菌、绿脓杆菌等)培养过夜后,调整菌液密度为107CFU/mL,取100 μL涂布于营养琼脂平板上,打孔,分别向各孔中加入培养20 h的拮抗菌菌液50 μL,每个样品做3个重复,用空白培养基作对照。分别在37℃或28℃下培养 24 h,测量孔穴周围抑菌圈直径。
1.2.4 拮抗菌生理生化鉴定及分子鉴定
1)拮抗菌生理生化鉴定:参照《伯杰氏细菌鉴定手册》(第八版)[9],将筛选到的菌株进行鉴定。鉴定项目包括形态观察、革兰氏染色、各项生理生化指标等。
2)分子鉴定:从拮抗菌中选取其中一株S4,对其16S rDNA基因序列的测定及系统发育树的构建,测序所需的上游引物 Seq forward (5′-GAGCGGATAACAATTTCACACAGG-3′)和下游引物Seq reverse(5′-CGCCAGGGTTTTCCCAGTCACG AC-3′)由生工生物工程(上海)股份有限公司提供,该公司同时协助完成测序工作。所得序列提交到NCBI的RefSeq数据库中进行BLAST分析,搜集相似序列,然后用MEGA5.1软件中的 N-J法(Neighbor-joining)构建系统发育树,设置自展值为1 000。
1.2.5 拮抗菌株S4培养特性研究
1)生长曲线的测定:参照Niall等[10]的方法。待测菌S4和嗜水气单胞菌于营养肉汤中培养20 h后,取l0 μL菌液分别加入含250 μL营养肉汤的96孔板各孔中,每个样品做6个平行,以空白培养基作对照。将96孔板分别置于37℃培养箱中培养,转速80 r/min,每隔1小时用酶标仪测定各孔OD630值,连续测定32 h,根据OD630值绘制生长曲线。
2)最佳接种体积分数的确定:将拮抗菌按1%、2%、3%、4%、5%、6%的接种体积分数接种于装有5 mL营养肉汤的试管中,于37℃、160 r/min培养16 h后,取200 μL加入96孔板各孔中用酶标仪测定各孔OD630值,每个处理作6个重复。
3)最佳碳源的确定:在基础培养基中,按1 g/dL分别添加淀粉、甘露醇、麦芽糖、乳糖、果糖、葡萄糖制成培养基,分别按最佳接种体积分数接种,于37℃、160 r/min培养16 h后,取200 μL加入96孔板各孔中,用酶标仪测定各孔OD630值,每个处理作6个重复。
4)最佳氮源的确定:添加选出的最佳碳源,分别用1 g/dL的酵母浸粉、蛋白胨、牛肉膏、硫酸铵、亚硝酸钠作氮源替换蛋白胨和牛肉膏制成培养基,分别按最佳接种体积分数接种,于37℃、160 r/min培养16 h后,取200 μL加入96孔板各孔中,用酶标仪测定各孔OD630值,每个处理作6个重复。
5)无机盐的选择:用上述实验获得的最佳碳源和氮源来替换基础培养基中碳源和氮源,选择磷酸氢二钾(K2HPO4·3H2O)、硫酸镁、氯化钙、氯化钠4种不同的无机盐替换氯化钠,分别以1%制成培养基后,分别按最佳接种体积分数接种,于37℃、160 r/min培养16 h后,取200 μL加入96孔板各孔中用酶标仪测定各孔OD630值,每个处理作6个重复。
6)最适初始pH值的确定:用最佳碳源、氮源、无机盐,制成优化培养基,将拮抗菌分别按最佳接种体积分数分别接种于pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.5的制成优化培养基中,于37℃、160 r/min培养16 h后,取200 μL加入96孔板各孔中用酶标仪测定各孔OD630值,每个处理作6个重复。
7)最佳培养温度的确定:待测菌S4培养16 h后,分别按最佳接种体积分数接种于最适pH的优化培养基中,分别于20、28、37、42℃且转速为160 r/min培养16 h后,取200 μL加入96孔板各孔中用酶标仪测定各孔OD630值,每个处理作6个重复。
8)优化条件的正交试验:在单因素的基础上选取对拮抗菌S4影响较大的温度、氯化钙、淀粉、牛肉膏4个因素;按四因素三水平进行正交试验设计进一步优化S4的生长培养条件,采用正交软件对试验数据进行单因素方差分析及极差分析。若P<0.05,则表示有显著差异。
2 结果与分析
2.1 拮抗菌株的筛选
从表1可知,从鲢鱼肠道中分离到120多个菌株,从中分离筛选获得15株对嗜水气单胞菌具有不同拮抗能力的拮抗菌株。其中S12、S46拮抗效果较好,但是在多次筛选的实验过程中S4、S50拮抗作用较稳定。
2.2 拮抗菌株的抗菌谱测定
从15株菌株中选取3株拮抗菌进行抗菌谱的测定,结果见表2。其中S4、S50抗菌谱较窄,S941抗菌谱较广。
2.3 拮抗菌S4生理生化及分子鉴定
菌株S4在普通营养琼脂培养基上培养24 h后,菌落边缘整齐、圆形、中央凸起、表面光滑、菌落湿润粘稠、呈乳白色。在油镜下观察呈短杆状,革兰氏染色后呈阴性,无芽孢。部分生理生化鉴定,结果见表3。
经过测序,获得菌株S4的16S rRNA基因序列为 (1 490 bp): 在 GenBank序列登录号为KP340798,在GenBank数据库中通过BLAST方法比对, 菌株 S4与多株气单胞菌(Aeromonassalmonicida)的相似性达99%~100%。采用MEGA 5.1软件用N-J法构建进化树,可知S4与杀鲑气单胞菌杀鲑亚种 (Aeromonas salmonicida subsp. salmonicida A449)遗传距离最近,相似度达95%,初步判断为此拮抗菌株为气单胞菌属,见图1。但是否为同一进化支,将根据此菌的生长培养特性进一步探讨。
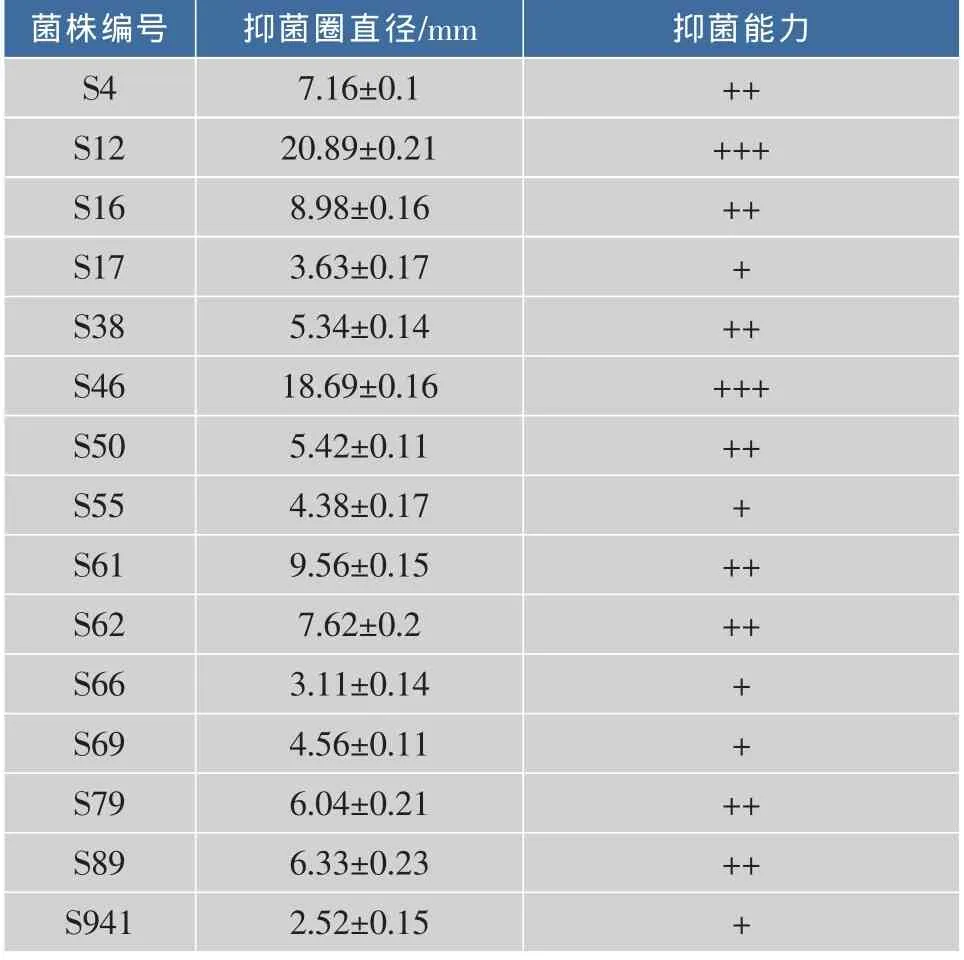
表1 拮抗菌株对嗜水气单胞菌的抑制效果Table 1 Inhibitory effect of antagonistic bacterial strains on Aeromonas hydrophila
注:透明圈直径为减去打孔器直径(6 mm)。抑菌能力:“+++”表示:(10 mm<抑菌直径);“++”表示:(5 mm<抑菌直径<10 mm);“+”表示:(抑菌直径<5 mm)
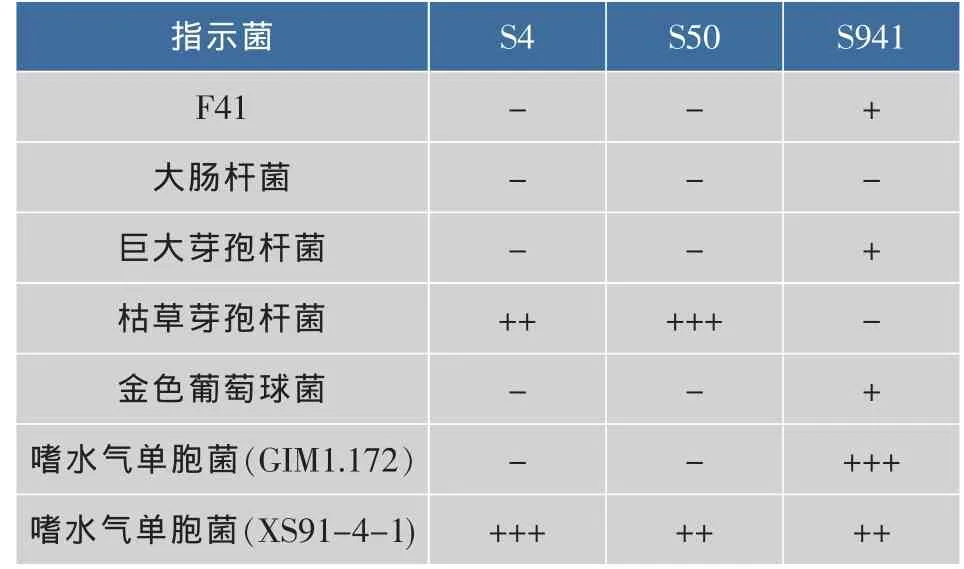
表2 抗菌谱的测定Table 2 Determination of the antibacterial spectrum
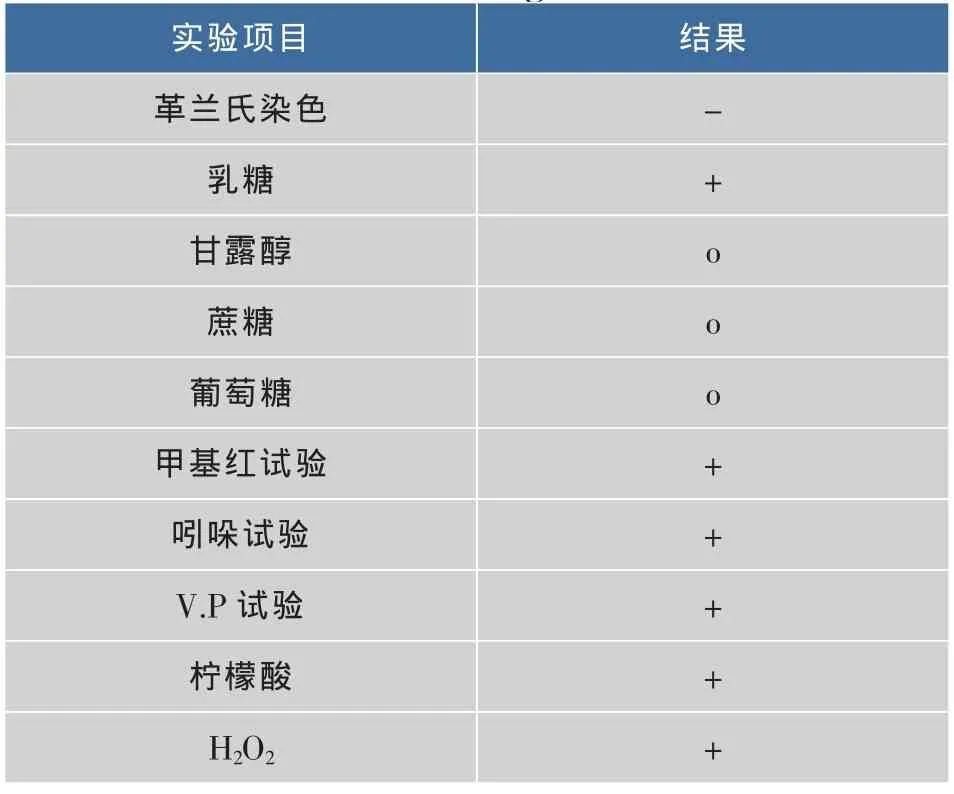
表3 拮抗菌株S4的部分生理生化特征Table 3 Results of physiological and biochemicalidentification of antagonistic strains S4

图1 根据16S rRNA基因序列构建的系统进化树Fig.1 Phylogenetic tree based on 16S rRNA gene sequences
2.4 S4培养特性研究
2.4.1 生长曲线的测定 拮抗菌S4和嗜水气单胞菌的生长曲线见图2。由图2可知,此两种菌按1%接种体积分数接种于营养肉汤培养基中,拮抗菌S4培养14 h后达到了稳定期,而嗜水气单胞菌在培养12 h左右时达到了稳定期,此后至32 h时均为稳定期。后续试验均按达到稳定期时培养16 h测定。
2.4.2 最佳接种体积分数的确定 由图3接种体积分数对拮抗菌S4的生长影响可知,接种体积分数对S4的生长影响比较小,但总的趋势为随接种体积分数的增加,拮抗菌S4的生长密度先增大后减小,最佳接种体积分数可以初步定为3%。
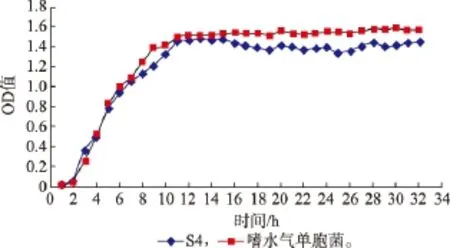
图2 嗜水气单胞菌和S4的生长曲线Fig.2 Growth curve of Aeromonas hydrophila and S4

图3 接种体积分数对拮抗菌S4生长的影响Fig.3 Effects of inoculum amount on S4 growth
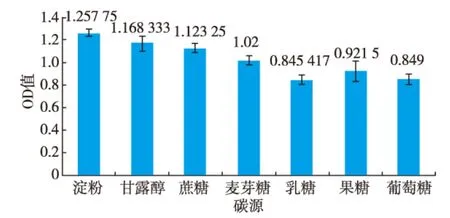
图4 不同碳源对拮抗菌S4生长的影响Fig.4 Effects of different carbon sources on S4 growth
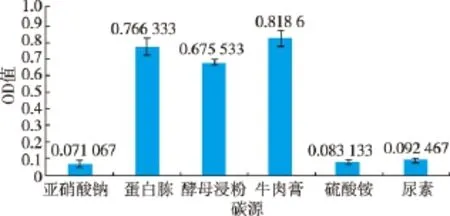
图5 不同氮源对S4生长的影响Fig.5 Effects of different nitrogen sources on S4 growth
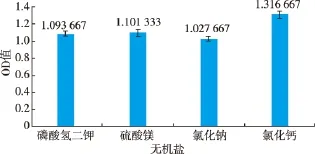
图6 不同无机盐对拮抗菌S4生长的影响Fig.6 Effects of different inorganic salts on S4 growth
2.4.6 最适初始pH值的确定 用1 g/dL淀粉,1 g/dL牛肉膏,1 g/dL氯化钙分别调节pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0制成的优化培养基中,拮抗菌S4按3%接种体积分数接种培养16 h,不同pH对拮抗菌S4的生长影响见图7。可知pH值对拮抗菌S4的生长影响比较大,最佳pH值为8.5,表明此菌为嗜碱性细菌。

图7 不同pH对拮抗菌S4生长的影响Fig.7 Effects of different pH on S4 growth
2.4.7 最佳培养温度的确定 不同温度对拮抗菌S4的生长影响见图8。可知温度对拮抗菌S4的生长影响比较小,最佳温度为37℃。
2.4.8 优化条件的正交试验 正交实验设计方案及结果见表4—5。由表5可知,按极差大小顺序排列出因素的主次为D>C>A>B,即温度>氯化钙>淀粉>牛肉膏,按直观分析及极差分析最佳组合为A3B3C2D1和A3B2C2D1。经进一步验证,S4的最佳生长培养条件组合为:淀粉(1.5 g/dL),牛肉膏(1.5 g/dL),氯化钙(1 g/dL),温度为32℃。由表6的方差分析可知,温度对S4的生长影响显著。
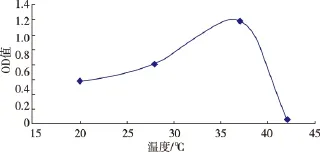
图8 不同温度对拮抗菌S4生长的影响Fig.8 Effects of different temperatures on S4 growth

表4 正交试验因素水平表Table 4 Level designation of orthogonal test
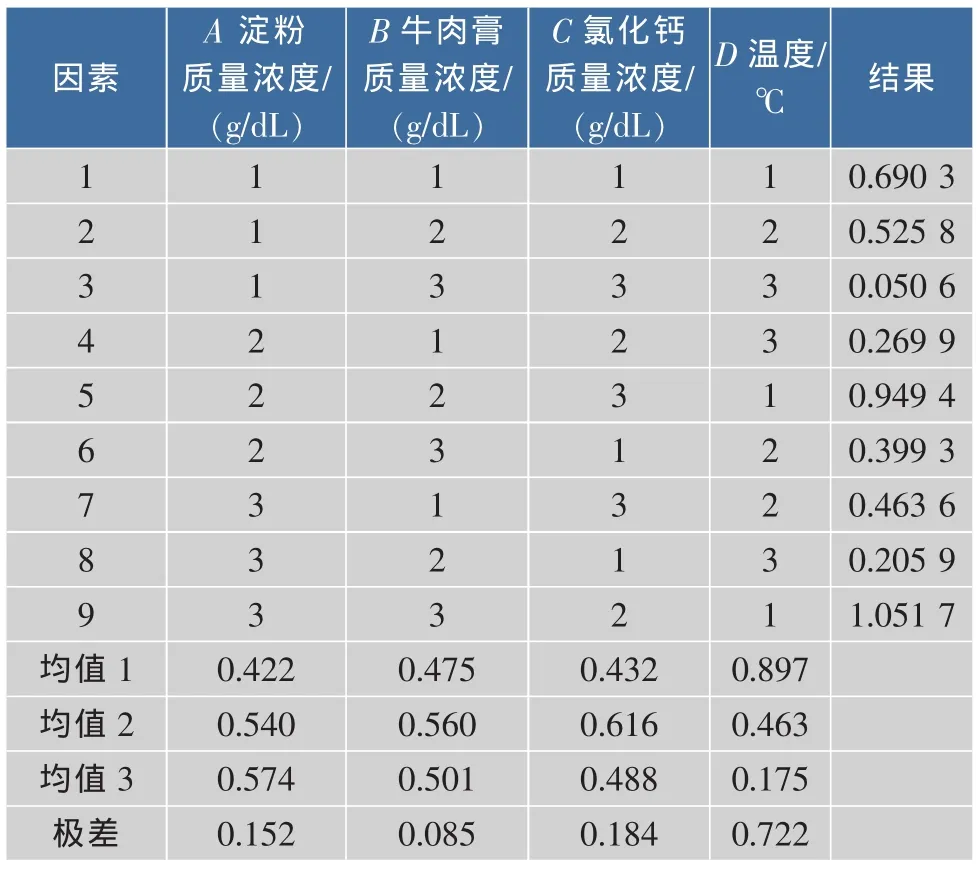
表5 L9(34)正交实验设计方案及结果Table 5 L9(34)orthogonal experiment design and results
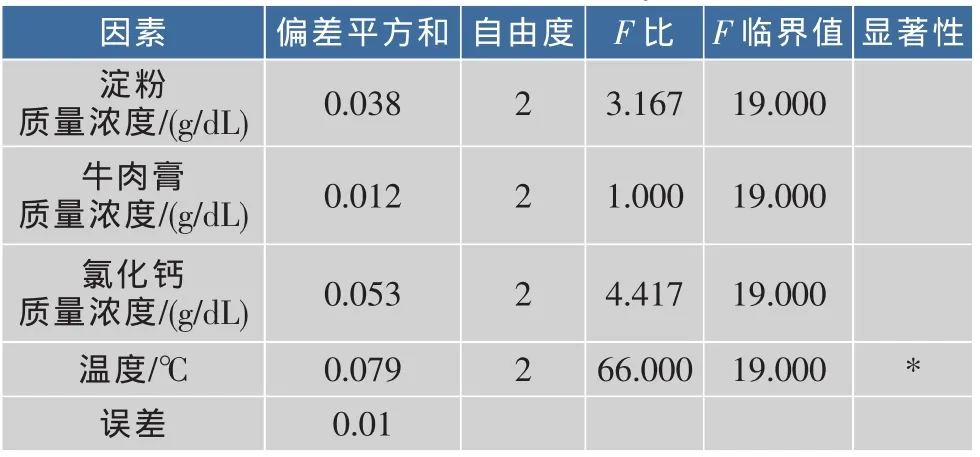
表6 方差分析表Table 6 Variance analysis
3 结语
作者以平顶山市白龟山水库中鲢鱼肠道的微生物为研究对象,以抑制病原菌嗜水气单胞菌效果为依据,根据体外拮抗试验筛选出15株有明显拮抗活性的菌株。拮抗微生物因具有不易使病原菌产生耐药性,对人畜安全无毒,不污染环境,无残留,能保持生态平衡,工艺较简单以及不少拮抗微生物同时具有提高生命力等特点而引起越来越多人们的关注和重视,在水产动物病害的生物防治中发挥着重要的作用。目前报道较多分离出的拮抗微生物主要有芽孢杆菌类、乳酸菌类、光合细菌类和酵母类等拮抗菌株,有些拮抗菌株已进入商品化。关于鱼类中病原菌拮抗菌株的筛选及应用方面较多,如曹海鹏等[11]从养殖池污泥中分离筛选了一 株优良的鲟源嗜水气单胞菌拮抗芽孢杆菌;蒋启欢等[12]从养殖的银鲫肠道中分离纯化出一株拮抗嗜水气单胞菌的芽孢杆菌;Hagi等[13]从鲤肠道内分离出10株益生菌,鉴定后发现来自于10个种和5个属;Villamil等[14]研究了6株乳酸杆菌及其产物-乳酸对养殖卤虫的影响,发现加入乳酸杆菌(1×108个/mL)和乳酸的实验组,鳗弧菌的数量明显减少,而且体外拮抗实验也表明,乳酸杆菌的胞外产物可以抑制鳗弧菌的生长。
在本研究中,针对1株拮抗效果较稳定的拮抗菌S4经部分生理生化、16S rDNA鉴定,初步判断为气单胞菌属,此菌作为致病性嗜水气单胞菌拮抗菌株未见报道。通过分子进化树表明,与杀鲑气单胞菌的遗传距离最近(95%),但是否为同一进化支,此菌的生长培养特性有待进一步研究。为了更好地了解此菌的生长特性和培养条件,利用琼脂平板扩散法和单因素正交实验对此菌的抗菌谱和生长培养条件进行了研究。结果表明,此菌具有较窄的抗菌活性,pH为8.5左右,属嗜碱性细菌,单因素实验时,最佳培养温度为37℃,优化后最适培养温度为32℃,方差分析表明,温度对S4的生长影响有显著差异。
与目前报道的典型杀鲑气单胞菌的生长培养条件为22~25℃,生长pH为7差别较大,优化后的生长温度与大多数气单胞菌的生长温度为30℃接近。这些研究结果表明,S4可能属于气单胞菌属,但具体的哪个种有待进一步鉴定。作为致病菌的拮抗菌,在养殖系统使用中如何使其大量繁殖,缩短培养时间至关重要。因此,对S4的培养条件进行了优化,结果表明,在培养基为1.5 g/dL淀粉,1 g/dL牛肉膏,1 g/dL氯化钙中,接种体积分数以3%生长最佳。优化之后,对其生长曲线及拮抗效果进行研究。结果表明,菌体生长的延滞期缩短,稳定期延长,并提高了拮抗效果。通过最佳生长和培养条件的研究,S4将来作为微生物菌剂使用时,菌种制备可以缩短培养时间,提高产量,降低成本,达到高效目的。
S4作为一种致病菌的拮抗菌株,能否作为饲料添加剂或抗菌药物应用于水产养殖中,此菌的抑菌机制、安全性检验以及菌株拮抗效果规模化发酵条件优化还有待于进一步的研究。本研究为嗜水气单胞菌的防治及拮抗菌S4的应用提供理论依据。
[1]崔珏,李超,万健.鲢鱼皮胶原蛋白酶解工艺的优化及产物抗氧化活性的研究[J].农业机械,2012(27):114-116. CUI Jue,LI Chao,WAN Jian.Proteolytic digestion process optimization of Silver carp skin and its product research on antioxidant activity[J].Agricultural Machinery,2012(27):114-116.(in Chinese)
[2]陈爱平.2004年中国水产养殖病害监测报告[J].科学养鱼,2005(9):48-49. CHEN Aiping.The monitoring report from Chinese aquaculture disease in 2004[J].Scientific Fish Farming,2005(9):48-49.(in Chinese)
[3]艾晓辉,左文功.淡水养殖鱼类细菌出血性败血病药物防治研究[J].中国水产科学,1997,4(3):54-60.AI Xiaohui,ZUO Wengong.A study on control of the bacterial hemorrhagic septicemia in cultured freshwater fishes by drug administration[J].Journal of Fishery Sciences of China,1997,4(3):54-60.(in Chinese)
[4]陈霞,张其中,李春涛.50种中草药体外抑杀嗜水气单胞菌的药效研究[J].中国预防兽医学报,2011,33(11):862-865. CHEN Xia,ZHANG Qizhong,LI ChunTao.Bacteriostasis of 50 traditional Chinese medicine herbs against Aeromonas hydrophila in vitro[J].Chinese Journal of Preventive Veterinary Medicine,2011,33(11):862-865.(in Chinese)
[5]单晓枫,张洪波,郭伟生,等.嗜水气单胞菌拮抗菌的筛选[J].淡水渔业,2007,37(6):45-47. SHAN Xiaofeng,ZHANG Hongbo,GUO Weisheng,et al.Screening of antergic germ against Aeromonas hydrophila[J]. Freshwater Fisheries,2007,37(6):45-47.(in Chinese)
[6]张新明,李键,刘淇.弧菌拮抗菌的筛选及其效果[J].中国水产科学,2004,11(4):325-332. ZHANG Xinming,LI Jian,LIU Qi.Selection and effect of vibrios-antagnism bacteria[J].Journal of Fishery Sciences of China,2004,11(4):325-332.(in Chinese)
[7]蒋启欢,叶应旺,胡王,等.银鲫肠道内抑制嗜水气单胞菌的潜在益生菌筛选及其特性研究[J].淡水渔业,2012,42(20):23-26. JIANG Qihuan,YE Yingwang HU Wang,et al.Selection and characteristic analysis of potential probiotic strains against Aeromonas hydrophila from the intestine of Carassius auratus gibelio[J].Freshwater Fisheries,2012,42(20):23-26.(in Chinese)
[8]HONG Jun,HU Jianye,LIU Junhong,et al.In vitro antioxidant and antimicrobial activities of flavonoids from Panax notoginseng flowers[J].Natural Product Research,2014,28(16):1260-1266.
[9]坎布南.《伯杰细菌鉴定手册》(第八版中译本)[M].北京:科学出版社,1984.
[10]NIALL G V,WINSTON D L,HORST K.In vitro growth characteristics of five candidate aquaculture probiotics and two fish pathogens grow in fish intestinal mucus[J].Fems Microbiology Letters,2004,231(1):145-152.
[11]曹海鹏,何珊,刘丽玲,等.鲟源病原性嗜水气单胞菌拮抗芽孢杆菌的鉴定及其生物学特性[J].微生物学通报,2011,38(9):1377-1384. CAO Haipeng,HE Shan,LIU Liling,et al.Identification and biological characteristics of a Bacillus strain antagonistic against pathogenic Aeromonas hydrophila of sturgeons[J].Microbiology China,2011,38(9):1377-1384.(in Chinese)
[12]HAGI T,HOSHINO T.Screening and characterization of potential probiotic lactic acid bacteria from cultured common carp[J]. Biosci Biotechnol Biochem,2009,73(7):1479-1483.
[13]VILLAMIL L,FIGUERAS A.Control of vibrio alginolyticus in artemia culture by treatment with bacterial probiotics[J]. Aquaculture,2003,219(1-4):43-56.
Screening,Identification and Properties of One Antagonistic Strain Against Aeromonas hydrophila from Hypophthalmichthys molitrix Intestinal Tract
HONG Jun, BAI Yuzhen, MA Xiaomeng, HAN Sha, KONG Li
(College of Life Science and Engineering,Henan University of Urban Construction,Pingdingshan 467036,China)
In order to provide the theory basis for prevention and treatment the disease caused by Aeromonas hydrophila in the process of Hypophthalmichthys molitrix breeding,the strains which have the strong and stable abilities against A.hydrophila from H.molitrix intestinal tract were screened and their growth and culture conditions were studied.Antagonistic strains against A. hydrophila were separated and screened from H.molitrix intestinal tract.Then,the physiological and biochemical,molecular identification and the optimization of growth conditions of the stable antagonistic bacterium were determined.After many times of screening,15 antagonistic strains were got.Among them,the more stable antagonistic bacterium is number S4,which was an alkalineGram-negative bacillus brevis bacteria and belonged to Aeromonas genus.Orthogonal test indicated that the optimal growth conditions were 1.5 g/dL starch,1.5 g/dL beef extract,1 g/dL CaCL2,32℃,pH 8.5 and inoculation quantity 3%.The results provide the theoretical basis for the prevention of A.hydrophila and the application of antagonistic bacterium S4.
Aeromonas hydrophila,Hypophthalmichthys molitrix,antagonistic effect,strains identification,S4,growth and culture conditions
2.4.4 氮源试验 不同氮源对拮抗菌S4的生长影响见图5。可知不同氮源对拮抗菌S4的生长影响比较大,依次为:牛肉膏>蛋白胨>酵母浸粉>尿素>硫酸铵>亚硝酸钠,其中蛋白胨、酵母浸粉、牛肉膏作为生长氮源较好。
2.4.5 无机盐的选择 不同无机盐对拮抗菌S4的生长影响见图6。可知不同无机盐对拮抗菌S4的生长影响差异比较小,依次为:氯化钙>硫酸镁>磷酸氢二钾>氯化钠,最佳无机盐为氯化钙。
TQ 920.1
A
1673—1689(2016)12—1285—07
2015-02-26
国家自然科学基金项目(31540060);2014年度河南城建学院大学生科技创新基金项目;河南城建学院博士启动基金项目。
洪 军(1977—),女,河南商丘人,农学博士,副教授,主要从事抗微生物菌剂的研发及多肽作用机理方面的研究。
E-mail:hongjun@hncj.edu.cn

