定点突变提高毕赤酵母产葡萄糖氧化酶的氧化稳定性
闻一凡, 顾 磊, 张 娟, 堵国成*
定点突变提高毕赤酵母产葡萄糖氧化酶的氧化稳定性
闻一凡1,2, 顾 磊1,2, 张 娟1,2, 堵国成*1,2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
通过定点突变的方法,将来源于黑曲霉Aspergillus niger的葡萄糖氧化酶的甲硫氨酸替换为亮氨酸,以期提高葡萄糖氧化酶的耐氧化性。野生型的葡萄糖氧化酶和突变酶M305L、M524L、M556L和M582L的基因分别在巴斯德毕赤酵母中分泌表达,对突变酶与野生型葡萄糖氧化酶纯化后进行性质比较。结果表明:突变酶的耐氧化性与野生型葡萄糖氧化酶相比均有不同程度的提高,其中,突变酶M556L在100 mmol/L和500 mmol/L过氧化氢存在下的氧化稳定性是野生型葡萄糖氧化酶的近2倍,且催化效率 (kcat/Km)提高至野生型葡萄糖氧化酶的2.08倍。定点突变后,突变酶的最适反应温度为35℃,与野生型葡萄糖氧化酶基本保持一致,同时,突变酶M524L的pH稳定范围由4.0~6.0扩展到3.0~7.0。
葡萄糖氧化酶;重组;定点突变;黑曲霉;巴斯德毕赤酵母
葡萄糖氧化酶 (β-D-glucose:oxygen 1-oxidoreductase;EC1.1.3.4,简称GOD)是一种富含糖基的黄素蛋白,它利用分子氧作为电子受体,专一性催化β-D-葡萄糖生成葡萄糖酸和过氧化氢[1]。葡萄糖氧化酶的主要来源是黑曲霉,但黑曲霉产葡萄糖氧化酶酶活低、催化效率低、杂蛋白质多,使得其在实际应用中有一定的局限性[2-3]。目前毕赤酵母表达系统是倍受关注的真核表达系统,将黑曲霉葡萄糖氧化酶基因在该系统中进行表达在近年来屡见不鲜。
GOD在食品保鲜、葡萄糖酸生产等工业领域有重要的应用价值[4]。在制药领域中,GOD可用来检测葡萄糖含量;在食品工业中用来除去葡萄糖或者氧气以提高各种产品的色泽、味道等,同时由于反应产生过氧化氢,也可起到杀菌作用[1,5]。在食品添加剂领域作为抗菌剂的应用中,GOD的作用原理主要是产生的过氧化氢具有杀菌作用,然而,过氧化氢的积累会抑制GOD的活性而影响其本身的催化效率。研究发现,当过氧化氢浓度达到30 mmol/L时就会对GOD活性产生抑制作用[6]。提高GOD对氧的耐受性可使该酶在应用中更加稳定。
近年来,国内外有很多关于提高酶耐氧化性的研究,其中包括用抗氧化性较强的氨基酸取代甲硫氨酸的方式来减少由于氨基酸残基被氧化而引起的酶活降低甚至失活[7]。来自嗜热脂肪土芽孢杆菌属US110的α-淀粉酶197位蛋氨酸被置换为丙氨酸后,该突变体在1.8 mol/L的H2O2的存在下处理60 min后保留了70%的活性[8]。Peng等人[9]通过将N-酰基-D-氨基酸酰胺水解酶221位蛋氨酸替换为亮氨酸后,酶催化效率kcat/Km提高了2.4倍。
葡萄糖氧化酶的定向分子改造方面有很多相关研究[10-12],但在提高其耐氧化性方面鲜有报道。另外,有文献报道,葡萄糖氧化酶的每个单体中除辅酶FAD外,有3个关键氨基酸残基参与催化反应,即412位的谷氨酸残基和516、559位的组氨酸残基。有多个证据指明His516是主要催化基团[13-14]。
作者在前人研究的基础上,选择靠近关键氨基酸残基的M305,M524,M556和M582等4个可能的关键点进行定点突变体的构建以提高葡萄糖氧化酶的氧化稳定性和催化效率。
1 材料与方法
1.1 菌株与质粒
葡萄糖氧化酶基因GOD:由作者所在实验室从黑曲霉Aspergillus niger BBE11721中获得并构建在重组毕赤酵母表达载体pPIC9K-GOD上;菌株大肠杆菌Escherichia coli JM109,载体pPIC9K(amp+)和毕赤酵母菌株Pichia pastoris GS115(His-):均由作者所在实验室保存。
1.2 培养基
1.2.1 LB培养基 胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0。添加氨苄青霉素0.1 mg/mL用于质粒筛选。
1.2.2 YPD培养基 胰蛋白胨20 g/L,酵母粉10 g/L,葡萄糖20 g/L。一般用于种子活化。
1.2.3 BMGY生长培养基 胰蛋白胨20 g/L,酵母粉10 g/L,YNB 13.4 g/L,生物素0.4 mg/L,甘油10 g/L,0.1 mol/L磷酸钾缓冲液,pH 6.0。一般用于发酵基本培养。
1.2.4 BMMY诱导培养基 胰蛋白胨20 g/L,酵母粉10 g/L,YNB 13.4 g/L,生物素0.4 mg/L,甲醇体积分数1%,0.1 mol/L磷酸钾缓冲液,pH 6.0。一般用于发酵诱导培养。
1.2.5 MD培养基 YNB 13.4 g/L,生物素0.4 mg/L,葡萄糖20 g/L,琼脂粉20 g/L。添加遗传霉素0.25 mg/mL,用于阳性转化子初筛。
1.3 工具酶和生化试剂
Phusion high-fidelity DNA polymerase、限制性内切酶 DpnI和限制性内切酶 MSSI:Thermo Scientific公司;DNA相对分子质量标准、质粒提取试剂盒和YNB:上海生工生物公司;葡萄糖:国药集团化学试剂有限公司;邻联茴香胺、葡萄糖氧化酶、辣根过氧化物酶:Sigma公司;其他化学试剂均为国产分析纯。
1.4 方法
1.4.1 培养方法
1)E.coli种子培养条件:培养基装液量为10%,采用250 mL摇瓶进行培养,培养温度为37℃,培养时间为10 h,转速为200 r/min。
2)P.pastoris种子培养条件:种子甘油管保藏在-80℃超低温冰箱中,划线活化菌种后,挑单菌落,接种于50 mL YPD中(50 mL培养基/500 mL三角瓶中),于30℃、200 r/min培养24 h。
3)P.pastoris发酵培养条件:将培养好的种子液接种到50 mL(500 mL三角瓶)液体生长培养基BMGY中,其中接种体积分数为10%。置于摇床中,培养温度为30℃,转速为200 r/min。培养24 h后离心收集全部菌体,生理盐水洗涤2次,重悬后菌体全部转入50 mL(500 mL三角瓶)液体诱导培养基BMMY中,置于30℃、200 r/min摇床培养,每24小时补加体积分数1%的甲醇,诱导产酶。
1.4.2 定点突变 以重组质粒pPIC9K-GOD为模板,设计突变引物,进行全质粒PCR。反应体系含5×FD PCR buffer 5 μL,DNTP Mixture 2 μL,模板DNA 1 μL,上游引物各1 μL,Phusion高保真DNA聚合酶0.5 μL,加双蒸水至终体积为25 μL。5×FD PCR buffer 5 μL,DNTP Mixture 2 μL,模板DNA 1 μL,下游引物各1 μL,phusion酶0.5 μL,DMSO 1.5 μL,加双蒸水至终体积为25 μL。反应5个循环后,将对应PCR反应液混合,继续反应25个循环。PCR条件:8℃预变性3 min;98℃变性15 s;53℃退火30 s;72℃延伸11 min(5个循环);72℃延伸10 min。混合后扩增条件:98℃预变性3 min;98℃变性15 s;53℃退火30 s;72℃延伸11 min(25个循环);72℃延伸10 min。PCR产物 DpnI消化,转化E.coli JM109感受态细胞,涂布在含氨苄青霉素LB平板上。挑取阳性克隆子培养后测序。
1.4.3 重组葡萄糖氧化酶工程菌的构建与表达
将测序成功突变质粒pPIC9K-GOD用MSSI单酶切使之线性化,电击转化毕赤酵母P.pastoris GS115,转化液涂布于MD平板上,30℃培养至转化子出现。挑取200个转化子,点种到含0,1.0,1.5,2.0,2.5 g/L的遗传霉素(G418)的YPD培养基平板上,30℃同步培养2 d后,鉴定转化子的G418抗性,在含高浓度遗传霉素(G418)平板上生长较好的为高拷贝阳性转化子,将被用于后续发酵表达。电转化及筛选方法参见操作手册[15]。由于G418抗性水平大致依赖于所整合的细菌卡那霉素基因数目,因而也反映了重组质粒的整合拷贝数。
将筛选获得的高拷贝酵母工程菌作为生产菌株,将其接种于YPD培养基中进行种子活化,在30℃、200 r/min下培养24 h,然后以10%接种体积分数转接到基本发酵培养基BMGY中,并在30℃、200 r/min下培养24 h。然在BMGY培养基中培养到OD600为1.6~1.7时转入50 mL(500 mL三角瓶)液体诱导培养基BMMY中,置于30℃、200 r/min摇床培养,每24小时补加体积分数1%的甲醇,诱导产酶,每隔12小时取样,即为粗酶液。以表达野生型,即未经突变的产重组 GOD的 P.pastoris GS115为对照菌株。
1.4.4 葡萄糖氧化酶的纯化 将酶液于4 000 r/min离心5 min,收集发酵上清液,置于10 000的透析袋中,在1 L A液(20 mmol/L磷酸二氢钠溶液)中进行透析除盐,以保证阴离子交换柱的吸附性质。收集透析后的发酵液,12 000 r/min离心30 min,收集上清液。蛋白质的纯化采用HitrapTM Q FF(1 mL)阴离子交换层析柱。使用B液(20 mmol/L磷酸二氢钠-1M氯化钠溶液)梯度洗脱,流速1 mL/min,分步收集洗脱峰中的样品,经过酶活测定,确定目的样品所在的收集管,得到电泳纯的目标蛋白质。
1.5 分析方法
1.5.1 葡萄糖氧化酶酶活测定 酶活力单位定义:在35℃、pH 6.0的条件下,1 min从1 μmol的β-D-葡萄糖氧化成D-葡萄糖酸和H2O2所需的酶量为一个葡萄糖氧化酶酶活力单位,以U/mL表示。葡萄糖氧化酶酶活测定方法见文献[16]。
1.5.2 蛋白质质量浓度的测定 用Bio-Rad公司生产的Brandford蛋白质质量浓度测定试剂盒测定,以BSA作标准曲线。
1.5.3 米氏常数(Km),催化效率(kcat/Km)的测定 在35°C、pH 6.0的条件下,以β-D-葡萄糖和苯醌为催化反应底物,改变葡萄糖浓度(2~100 mmol/L)和苯醌浓度(0.5~10 mmol/L)。分别测定GOD酶活力随时间变化曲线,获得GOD酶动力学常数Km和Vmax,同时计算 kcat。酶液统一蛋白质质量浓度至100 μg/mL。
1.5.4 酶的耐氧化性测定 用Brandford试剂盒将野生型葡萄糖氧化酶和突变酶的酶液统一到同一蛋白质质量浓度,采用无载体交联技术固定化野生型葡萄糖氧化酶与突变酶。取100 μL酶液,加入通用过氧化物酶,缓慢滴加聚乙二醇2 000,之后加入25%戊二醛,将混合物放入摇床(30℃,100 r/min)培养,用10 mmol/L丙二酸钠缓冲液(pH 5.0)充分悬浮混合液,8 000 r/min离心30 min),收集上清液,并重复上述操作,直到上清液中无法检测到酶活。
将固定化后的野生型葡萄糖氧化酶和突变酶放在不同浓度H2O2(10、20、50、100、500 mmol/L)中处理,处理温度为35℃,处理时间为2 h,缓冲液为丙二酸钠缓冲液(pH 5.0,10 mmol/L)。处理后离心,倒掉上清液,并用缓冲液洗沉淀直到上清液中无法检测到过氧化氢。将沉淀用等体积的缓冲液溶解,离心并充分重悬后测定剩余酶活。
1.5.5 最适pH值和酸碱稳定性的分析 测定不同pH条件对葡萄糖氧化酶酶活力和稳定性影响时,pH范围为2.0~9.0,所需不同pH的缓冲液包括:pH为2.0~8.0时20 mmol/L柠檬酸-磷酸氢二钠缓冲液;pH为9.0时采用20 mmol/L Tris-盐酸缓冲液。pH对葡萄糖氧化酶稳定性测定时,处理条件为将高浓度纯化后的葡萄糖氧化酶用不同pH的缓冲液溶解,35℃处理1 h,测定相应残留酶活力。相对酶活力(100%)的定义为不同pH处理条件下,最高酶活力为100%。
1.5.6 最适温度和热稳定性的分析 测定葡萄糖氧化酶最适反应温度时,温度变化范围为10~70℃,缓冲液为柠檬酸-磷酸氢二钠缓冲液(pH 5.5,20 mmol/L)和柠檬酸-磷酸氢二钠缓冲液 (pH 6.0,20 mmol/L)。葡萄糖氧化酶的温度稳定性测得的条件为55、60、65℃处理30 min,缓冲液为柠檬酸-磷酸氢二钠缓冲液(pH 5.5,20 mmol/L)和柠檬酸-磷酸氢二钠缓冲液 (pH 6.0,20 mmol/L)。相对酶活力(100%)的定义为不同反应温度条件下,测得的最高酶活活力为100%。
2 结果与讨论
2.1 突变位点的确定
据报道,多种酶在应用过程中氧化失活的主要原因是甲硫氨酸(Met)残基在强氧化环境下会被氧化成其含硫衍生物[17]。位于活性位点周围的甲硫氨酸,氧化后生成的含硫衍生物支链形状较大。较大的含硫衍生物会导致酶活性位点立体阻碍,致使酶与底物不能完美结合,酶活力会降低甚至失活。为了提高葡萄糖氧化酶耐氧化特性,可以采用不易被氧化且体积较小氨基酸进行突变,例如亮氨酸(Leu)、丝氨酸(Ser)、异亮氨酸(Ile)、丙氨酸(Ala)、苏氨酸(Thr)[18]。理论上来说,甲硫氨酸突变为亮氨酸,提高蛋白质的疏水性,减少空间位置阻力,增强酶和底物的相互作用,在酶促反应中,底物过渡态的电荷与酶蛋白活性中心附近的电荷有相互作用,蛋白质细微结构的变化也会影响到基态和过渡态之间的能量差,而影响反应的活化能。葡萄糖氧化酶反应包括氧化半反应和还原半反应,有多个证据指明His516是主要催化基团。His516,His559和Glu412是参与酶反应的关键氨基酸残基。通过对GOD酶分子3-D结构分析发现,M305,M524,M556和M582是位于活性位点周围的4个Met位点,见图1。对这4个Met残基的分子改造可能对葡萄糖氧化酶耐氧化提高具有关键性的作用。
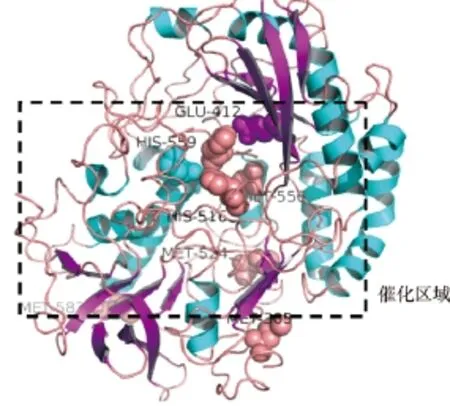
图1 葡萄糖氧化酶蛋白质结构分析Fig.1 Model structure of glucose oxidase
2.2 重组葡萄糖氧化酶菌株的构建、筛选表达和重组葡萄糖氧化酶的纯化
以含有野生型葡萄糖氧化酶基因的重组质粒pPIC9K-GOD为模板,利用互补PCR引物扩增,得到含有突变的双链环,转化E.coli JM109中。通过氨苄抗性筛选和测序分析,确定突变位点与目标设计的突变位点一致。
将测序正确的 4个突变体转化到 P.pastoris GS115中进行表达。通过利用不同浓度梯度的遗传霉素的平板筛选方法,筛选到具有高拷贝数的阳性转化子,并通过摇瓶发酵使得突变酶分泌表达。
突变体粗酶液经过阴离子柱纯化后,收集的酶蛋白质的SDS-PAGE电泳结果显示单一条带,说明已经纯化到相对分子质量约为66 000的均一目的蛋白质条带,从而可以进行下一步的酶学性质研究,见图2。
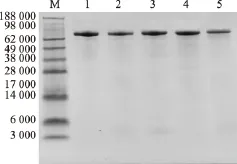
图2 GOD纯化后的SDS-PAGE图谱Fig.2 SDS-PAGE analysis of glucose oxidase
2.3 突变酶与野生型葡萄糖氧化酶耐氧化性比较
对于确定酶的耐氧化性的方法,目前较常用的是比较其在不同浓度过氧化氢条件下的稳定性。葡萄糖氧化酶在反应过程中会产生过氧化氢,酶活测定原理一般是通过测定所产生的过氧化氢的量来计算酶活,如果直接用液体酶液,在测定剩余酶活时会产生误差。因此,首先通过无载体交联固定化的方法将葡萄糖氧化酶固定,把固定化酶放入不同浓度的过氧化氢中一段时间后,将固定化酶离心,用缓冲液洗涤,重悬,然后测定固定化酶的剩余酶活,比较分子改造后的酶与野生型葡萄糖氧化酶的氧化稳定性。
对不同浓度H2O2条件下葡萄糖氧化酶稳定性变化见图3。随着H2O2浓度逐渐升高,葡萄糖氧化酶酶活残留逐渐降低。同时相比于野生型葡萄糖氧化酶,突变酶的耐氧化性均有不同程度的提高。其中突变酶M556L在100 mmol/L和500 mmol/L过氧化氢存在下是对照酶的两倍。
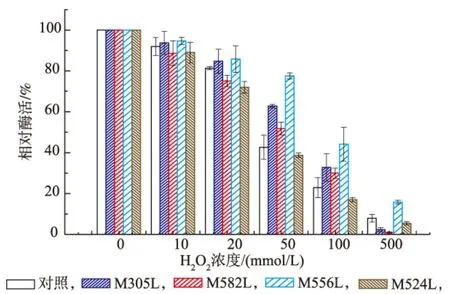
图3 野生型葡萄糖氧化酶与突变酶的耐氧化性比较Fig.3 Oxidative stability of the wild-type and glucose oxidase mutants
结果表明,Met残基在酶氧化敏感性方面的关键性。当Met 556被Leu替代时,突变体酶的耐氧化性提高幅度最大。由此可以推断,Met 556应该是GOD耐氧化性提高的关键位点。Met残基被氧化后氧化衍生物侧链体积增大,导致活性位点空间位阻,由此可以致使酶活力降低甚至失活。Met 305位点虽然不位于酶催化区域中心,但其在酶催化中心附近,该位点被替代后突变体耐氧化性也获得较大提高。
2.4 突变酶与野生型葡萄糖氧化酶的反应动力学比较
表1显示,M556L和M305L的比酶活与野生型葡萄糖氧化酶相比都有所提高,其中突变酶M556L和M305L比酶活分别提高至野生型葡萄糖氧化酶的1.5倍和1.25倍;与野生型葡萄糖氧化酶相比,4个突变体的Km均降低,酶的Km值与酶底物结合能力相关。一般来说,Leu是小分子氨基酸,利用小分子氨基酸对其他大分子氨基酸进行突变会导致酶的底物结合能力增加,其原因可能是由于突变后酶催化位点周围静电作用导致的。
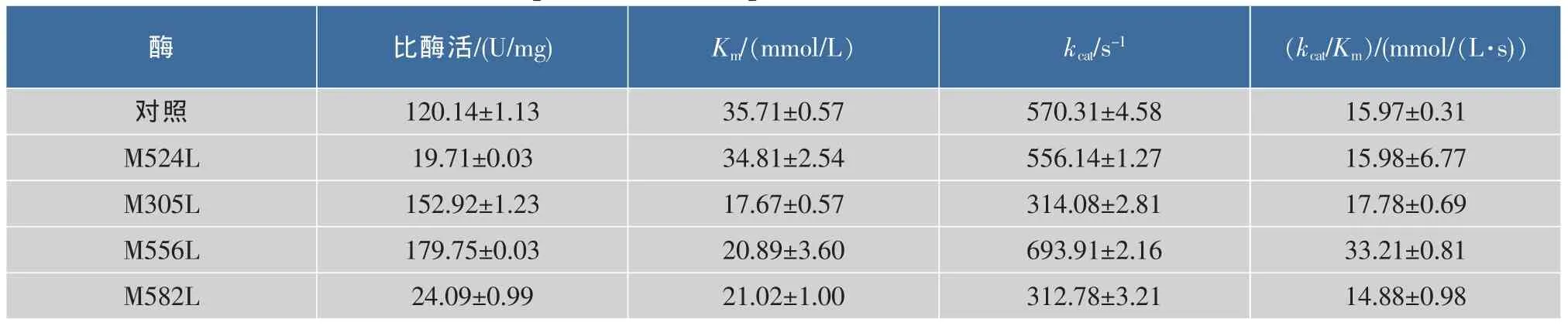
表1 野生型葡萄糖氧化酶和突变酶的比酶活及动力学常数Table 1 Kinetic parameters and specific activities of GOD and its mutants
多数情况下,耐氧化性定点突变会可能会导致酶的转化数降低,突变体底物结合能力增强,从而导致酶kcat/Km增大。突变酶M556L和M305L的催化效率均有所提高,其中,M556L是对照菌株所产酶的2.08倍,M524L基本不变,而M582L略微降低。其中M556L在亲和力提高了41.5%的情况下,转化数也稍有提高,为21.7%。这可能是由于M556L比较靠近活性中心的关键催化氨基酸。类似的例子有Holland等通过对黑曲霉GOD基因进行饱和突变发现,当132位的苏氨酸突变成丝氨酸时,特异性常数kcat/Km从8.39 mmol/(L·s)提高为23.8 mmol/(L·s),同时对底物亲和力降低了3%[19]。本研究中突变酶M556L在未损失对底物亲和力的同时,催化效率有所提高,具有较好的效果。
2.5 突变酶与野生型葡萄糖氧化酶酶学性质比较2.5.1 最适pH值和酸碱稳定性的分析 在35℃下测定野生型葡萄糖氧化酶和突变酶在pH 2.0~9.0时的酶活性,确定GOD的最适pH值,结果见图4。葡萄糖氧化酶GOD耐氧化性分子改造前后,与野生型葡萄糖氧化酶相比,M524L和M556L最适pH无明显变化,突变酶M305L、M582L的略有降低。
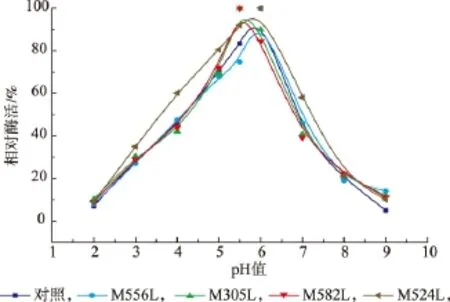
图4 不同pH对GOD和突变体酶活性的影响Fig.4 Optimum pH value of the wild-type and glucose oxidase mutants
酸碱稳定性结果见图5。分子改造后突变体M305L、M582L稳定pH范围与野生型葡萄糖氧化酶相比较,没有发生显著变化。突变体M524L的稳定pH范围由5.0~6.0变宽至4.0~7.0。同时突变体M524L在pH 4.0或7.0条件下稳定性也增强显著。在pH 4.0条件下处理后,酶活残留由野生型葡萄糖氧化酶的45.0%提高至60.1%;在pH 7.0条件下处理后,酶活残留由野生型葡萄糖氧化酶的40.2%提高至58%。通常来说,大部分酶的pH作用范围都比较窄,黑曲霉来源的葡萄糖氧化酶的pH作用范围一般是5~6,偏酸性。pH稳定性的提高对葡萄糖氧化酶实际应用有重要作用。
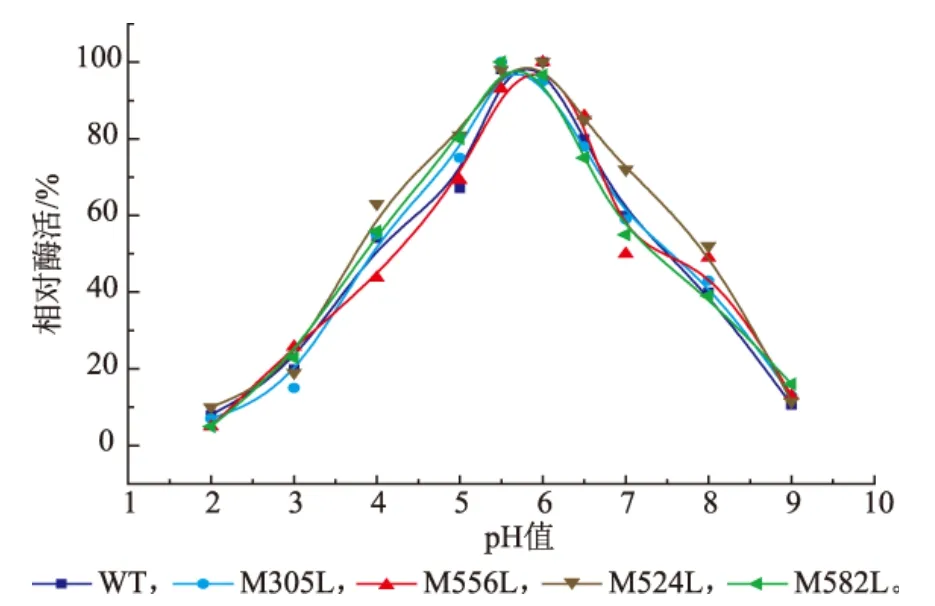
图5 不同pH对GOD和突变体稳定性的影响Fig.5 pH stability of the wild-type and glucose oxidase mutants
2.5.2 最适温度和热稳定性的分析 酶对温度的改变非常敏感,酶活与温度的变化一般是呈指数变化的。测定10、20、30、40、50、60、70℃的突变酶的酶活力,确定突变酶的最适反应温度。温度对突变酶酶活的影响见图6。突变酶的最适温度是35℃,与野生型葡萄糖氧化酶相比基本不变。
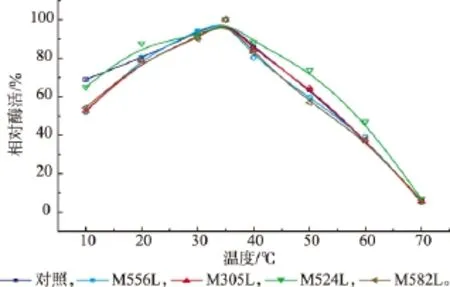
图6 野生型葡萄糖氧化酶与突变酶的最适反应温度比较Fig.6 Optimum temperature of the wild-type and glucose oxidase mutants
将野生型和突变株酶液分别放置于不同温度中保温30 min后,迅速放置冰上,并测定野生型葡萄糖氧化酶与突变酶的剩余酶活,评价酶的热稳定性。如图7所示,野生型葡萄糖氧化酶与突变酶的酶活均有所降低,与野生型葡萄糖氧化酶相比,突变M524L的热稳定性更高,在60℃的条件下能够保持52%的酶活力,同时M556L的热稳定性与野生型葡萄糖氧化酶相比也有所提高,在60℃,剩余酶活由40%提高到50%。

图7 野生型葡萄糖氧化酶与突变酶热稳定性比较Fig.7 Thermostability of the wild-type and glucose oxidase mutants
3 结语
Met 305、Met 556、Met 524和Met 582氨基酸残基分别通过单点突变替代成Leu后,突变体耐氧化性均有所提高。这进一步证明位于活性位点周围的4个Met位点对该酶的耐氧化性提高具有重要影响。活性中心附近的氨基酸残基的氧化是酶活受到抑制的原因之一,氨基酸替换可以增强酶的耐氧化性,提高酶的稳定性。
多数情况下,耐氧化性定点突变会导致突变体底物结合能力增强,从而引起酶kcat/Km增大,提高酶的催化能力。这一观点在本研究中得到了进一步的验证。突变株M556L在未损失酶与底物亲和力的情况下产酶的催化效率是野生型葡萄糖氧化酶的2.08倍,这使得该突变株非常具有应用前景。底物结合能力增加可能是由于突变后酶催化位点周围静电作用导致的。
葡萄糖氧化酶在实际应用中易被氧化、稳定性差的报道较多,但并未提到具体的解决方法以提高该酶的耐氧化性。作者参考了其它酶的研究方法,通过一定的改进,对葡萄糖氧化酶的定向改造进行探讨,提高了该酶对过氧化氢的耐受力,获得了稳定性好、催化效率高的突变体,为其工业化应用奠定了的基础,也为今后对该酶的研究提供了新的线索和方向。
[1]BANKAR SB,BULE MV,SINGHALR S,etal.Glucose oxidase-an overview[J].Biotechnology Advances,2009,27:489-501.
[2]CAVALCANTI A,SHIRINZADEH B,KRETLY L C.Medical nanorobotics for diabetes control[J].Nanomedicine:Nanotechnology,Biology and Medicine,2008,4:127-138.
[3]LIU Q,XU X,REN G,et al.Enzymatic biofuel cells[J].Prog Chem,2006,18:1530-1537.
[4]WONG C M,WONG K H,CHEN X D.Glucose oxidase:natural occurrence,function,properties and industrial applications[J]. Applied Microbiology and Biotechnology,2008,78:927-938.
[5]BHATTI H N,SALEEM N.Characterization of glucose oxidase from Penicillium notatum[J].Food Technology and Biotechnology,2009,47:331.
[6]BAO J,KOUMATSU K,FURUMOTO K.Deactivation kinetics of immobilized glucose oxidase for production of calcium gluconate in an external loop airlift bioreactor[J].Biochemical Engineering Journal,2004,22:33-41.
[7]YANG H,LIU L,WANG M,et al.Structure-based engineering of methionine residues in the catalytic cores of alkaline amylase from Alkalimonas amylolytica for improved oxidative stability[J].Applied and Environmental Microbiology,2012,78:7519-7526.
[8]KHEMAKHEM B,ALI M B,AGHAJARI N,et al.Engineering of the α-amylase from Geobacillus stearothermophilus US100 for detergent incorporation[J].Biotechnology and Bioengineering,2009,102:380-389.
[9]PENG I,LO K Y,HSU C H,et al.Increasing the storage and oxidation stabilities of N-acyl-D-amino acid amidohydrolase bysite-directed mutagenesis of critical methionine residues[J].Process Biochemistry,2012,47:1785-1790.
[10]ZHU Z,WANG M,GAUTAM A,etal.Directed evolution ofglucose oxidase from Aspergillus nigerfor ferrocenemethanol-mediated electron transfer[J].Biotechnology Journal,2007,2:241-248.
[11]PRODANOVIC R,OSTAFE R,SCACIOC A,et al.Ultrahigh throughput screening system for directed glucose oxidase evolution in yeast cells[J].Combinatorial Chemistry&High Throughput Screening,2011,14:55-60.
[12]HORAGUCHI Y,SAITO S,KOJIMA K,et al.Construction of mutant glucose oxidases with increased dye-mediated dehydrogenase activity[J].International Journal of Molecular Sciences,2012,13:14149-14157.
[13]Leskovac V,Trivic S,Wohlfahrt G,et al.Glucose oxidase from Aspergillus niger:the mechanism of action with molecular oxygen,quinones,andone-electronacceptors[J].The International Journal of Biochemistry&Cell Biology,2005,37:731-750.
[14]HECHT H,KALISZ H,HENDLE J,et al.Crystal structure of glucose oxidase from Aspergillus niger Refined at 2.3 Å reslution [J].Journal of Molecular Biology,1993,229:153-172.
[15]CREGG J M,HIGGINS D R.Pichia Protocols[M].New Jersey:Humana Press,2007.
[16]SANDIP B.BANKAR,Mahesh V.Bule,Rekha S.Singhal.Optimization of Aspergillus niger fermentation for the production of glucose oxidase[J].Food Bioprocess Technology,2009,2:344-352.
[17]VOGTW.Oxidationofmethionylresiduesinproteins:tools,targets,andreversal[J].Free Radical Biology and Medicine,1995,18:93-105.
[18]LIN L L,LO H F,CHIANG W Y,et al.Replacement of methionine 208 in a truncated Bacillus sp.TS-23 α-amylase with oxidation-resistant leucine enhances its resistance to hydrogen peroxide[J].Current Microbiology,2003,46:211-216.
[19]刘瑜,李丕武.黑曲霉葡萄糖氧化酶高产基因工程菌研究进展[J].生物技术通报,2013,7:4. LIU Yu,LI Peiwu.Review on high-level Aspergillus niger glucose oxidase production engineering strains[J].Biotechology Bulletin,2013,7:4.(in Chinese)
Enhancing Oxidative Stability of Glucose Oxidase from Aspergillus niger by Site-Directed Mutagenesis
WEN Yifan1,2, GU Lei1,2, ZHANG Juan1,2, DU Guocheng*1,2
(1.SchoolofBiotechnology,Jiangnan University,Wuxi214122,China;2. Key Laboratory ofIndustrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China)
Aiming to improve the catalytic activity and oxidative stability of glucose oxidase from Aspergillus niger.This work conducted site-directed mutagenesis based on an analysis of the protein structure.Four methionines(M582L,M524L,M556L and M305L)were selected as the mutation sites and individually replaced with leucine.The native GOD and the mutated GOD were separately expressed in P.pastoris GS115.In the presence of H2O2(10 mM,20 mM,50 mM,100 mM,and 500 mM)at 35℃for 2 h,the oxidative stability of the mutants increased compared to the wild-type under most of the circumstances.Meanwhile,M556L showed a higher(2 folds than the wild-type)oxidative stability of all in the presence of both 100 mM and 500 mM H2O2for 2 h.Compared to the wild-type enzyme,the kcat/Kmvalue of M556L increased(2.08 folds than the wild-type).The thermol stability of the mutants remained unchanged while the stable pH range of M524L was extended from4.0-6.0 to 3.0-7.0 compared to the wild-type.It is a fact that a more stable enzyme with higher oxidative stability is an ideal choice in most of the industrial application of GOD.
recombinant,glucose oxidase,site-directed mutagenesis,Aspergillus niger,Pichia pastoris
Q 939.97
A
1673—1689(2016)12—1260—08
2014-09-27
国家863计划项目(2011AA100905);国家自然科学基金项目(31470160)。
*通信作者:堵国成(1965—),男,江苏常州人,工学博士,教授,博士研究生导师,主要从事发酵过程优化与控制、酶工程与技术、代谢工程技术方面的研究。E-mail:gcdu@jiangnan.edu.cn

