中华蜜蜂乙酰胆碱酯酶基因的克隆及其在毕赤酵母中的表达鉴定
曹 雪, 陈占宽, 白仲虎, 杨艳坤*, 陈继峰
(1.郑州大学 生命科学学院,河南 郑州 450001;2.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡214122;3.河南天茂生物有限公司,河南 郑州450001)
中华蜜蜂乙酰胆碱酯酶基因的克隆及其在毕赤酵母中的表达鉴定
曹 雪1,2, 陈占宽3, 白仲虎2, 杨艳坤*2, 陈继峰1
(1.郑州大学 生命科学学院,河南 郑州 450001;2.粮食发酵工艺与技术国家工程实验室,江南大学,江苏 无锡214122;3.河南天茂生物有限公司,河南 郑州450001)
有机磷污染是食品安全的重大隐患,乙酰胆碱酯酶(Acetyl cholinesterase,AChE)可用于有机磷农药残留的检测。中华蜜蜂是我国独有的蜜蜂当家品种,蜜蜂对农药的敏感性很高,中华蜜蜂来源的乙酰胆碱酯酶基因尚未被克隆并应用于食品安全监测。以中华蜜蜂头部组织总RNA为模板,经RACE方法获得了AChE基因cDNA全序列,全长约1.8 kb。构建重组表达载体pPIC3.5K-AChE,将目的基因表达盒整合入毕赤酵母GS115的基因组中获得重组菌株,0.5%甲醇诱导重组菌株表达AChE蛋白,经SDS-PAGE、酶活性分析表明,中华蜜蜂AChE基因首次克隆成功并首次在毕赤酵母中获得成功表达,筛选出一株酶活性较高的菌株,纯化的重组乙酰胆碱酯酶其活性为10 568 U/mg,可以用于有机磷农药残留的检测。
食品安全;有机磷检测;中华蜜蜂乙酰胆碱酯酶;巴斯德毕赤酵母;克隆表达
近年来,随着经济的发展,人们生活水平逐渐提高,越来越多的消费者对食品的安全、营养等方面的要求的不断提高。重视食品安全,已经成为衡量人民生活质量、社会管理水平和国家法制建设的一个重要方面[1]。为食品安全定义一个切实有效的标准是当前食品安全工作的重中之重,而食品中农药残留的检测是判断食品安全与否的一个重要指标。
农药能够防治病虫害、去除杂草、控制人畜传染病、提高农产品的产量和质量,其发明和使用大大提高了农作物的产量,但农药的大量及不合理使用使食品中的农药残留对人类健康造成的负面影响也日益显露出来[2-4]。农药残留对食品安全构成的威胁就是农残超标[5]。近年来,由于农产品中高毒农药残量超标造成的中毒事故屡有发生[6],研究证实,农药对人体有致畸致癌的作用,因此做好农药残留检测的工作就成了重中之重。
快速检测技术是目前的农药残留检测的主要方法之一,原理是有机磷和氨基甲酸酯类农药能抑制昆虫神经系统中乙酰胆碱酯酶的活性,造成神经传导介质乙酰胆碱积累,影响正常传导,使昆虫中毒致死。这一毒理学原理也用于农药残留的检测中[7]。近年来,已有公司研制出农药残留检测仪器和试纸,但这些产品使用的酶原料主要来自生物体的蛋白质提取液,存在很多杂蛋白质,很大程度上影响了检测结果的准确性和重复性且酶原料的量受限于生物体的数量,这些问题极大地限制了这些产品的大量推广应用。
中华蜜蜂是我国独有的蜜蜂当家品种,近年来因农药中毒导致蜜蜂死亡的现象遍及全球,中华蜜蜂对农药的灵敏度很强[8]。自20世纪以来我国虽已开展了中华蜜蜂乙酰胆碱酯酶对农药敏感度的研究工作[8-9],但至今未见关于中华蜜蜂AChE用于农药残留检测的报道,也未发现任何有关于利用基因工程技术在外源蛋白质表达系统中表达中华蜜蜂AChE的文献与专利的报道。当前虽已开展了多种生物来源的乙酰胆碱酯酶的研究[10-13],但其在农药残留检测方面的应用并不是最优的,有必要研究出一种更有效更灵敏的酶源。
作者根据中华蜜蜂的独有特征鉴定得到中华蜜蜂。并在研究前期通过RACE方法获得了中华蜜蜂AChE基因的cDNA全序列,与GeneBank中查到的中华蜜蜂乙酰胆碱酯酶部分基因序列片段同源对比相似性达到99%,与意大利蜜蜂的相似性达到了94%。取中华蜜蜂头部组织总RNA经RT-PCR技术获得AChE基因cDNA全序列并构建毕赤酵母表达载体pPIC3.5K-AChE,转化入毕赤酵母GS115进行表达,探索分析重组AChE的性质,为其在农药残留检测方面的应用奠定基础。
1 材料与方法
1.1 主要仪器
电击杯与电转仪:BIO-RAD公司;PCR仪:美国应用生物公司;超净工作台:苏州净化设备有限公司;摇床:上海智城分析仪器制造有限公司;台式高速离心机:HITCHI;电子分析天平:梅特勒-托利多仪器;凝胶成像系统:BIO-RAD;蛋白质电泳仪:北京六一仪器厂;G560E型振荡仪:Scientific Industries。
1.2 主要试剂和培养基
1.2.1 主 要 试 剂 逆 转 录 酶 (Reverse Transcriptase),PCR高保真酶 (LA Taq):TaKaRa公司;SnaBⅠ、NotⅠ和SalⅠ:Thermo公司;胶回收试剂盒、质粒提取试剂盒:Axygen公司;山梨糖醇(sorbitol)、遗传霉素(G418):北京索来宝公司;3-吲哚乙酰酯(3-indoxyl acetate):TCI公司;海狸磁珠纯化试剂盒:海狸生物科技有限公司;ZYD-NYM-500型农药检测试剂盒:北京智云达科技有限公司。
1.2.2 主要培养基的配制
1)LB培养基(g/dL):酵母膏0.5,胰蛋白胨1,NaCl 1;调节pH至7.0。
2)YPD培养基(g/dL):酵母膏1,蛋白胨2,葡萄糖2。
3)MD培养基(g/dL):酵母无氨基酸氮源(YNB)1.34,葡萄糖2,生物素4×10-5。
4)BMGY液体培养基(g/dL):酵母膏1,蛋白胨2,YNB 1.34,生物素4×10-5,1 mol/L磷酸钾缓冲液(pH 6.0)1,甘油1。
5)BMMY液体培养基 (g/dL):将BMGY中的1%甘油换成0.5%甲醇。
6)固体培养基是在液体培养基的基础上添加1.5 g/dL琼脂。
1.2.3 主要试剂的配制
1)100 mg/mL Amp:称取0.5 g氨苄青霉素加入10 mL蒸馏水溶解,过滤除菌分装后存于-20℃。
2)50 mg/mL G418:称取1 g G418溶于20 mL蒸馏水中,0.22 μm滤器过滤除菌分装(1 mL)后存于-20℃。
3)0.1 mol/L 3-吲哚乙酰酯:称取17.519 mg的3-吲哚乙酰酯溶解于1 mL的二甲基亚砜中,避光室温保存。
4)磷酸盐缓冲液:按照分子克隆实验指南配制。
1.3 宿主菌和质粒
大肠杆菌 DH5α:由作者所在实验室保存;pMD20-T Vector:TaKaRa公司,巴斯德毕赤酵母(P.pastoris)GS115及其胞内表达载体pPIC3.5K:作者所在实验室提供。
1.4 引物设计与合成
依据实验需要,参考实验前期获得的中华蜜蜂AChE基因序列,设计合成两对引物。用于AChE cDNA RT-PCR的一对引物ACF和ACR,在ACF的5’端引入SnaBⅠ限制性内切酶位点,在ACR的5’端引入NotⅠ限制性内切酶位点、6×His标签和终止密码子TAA。乙醇氧化酶基因通用引物AOX5P和AOX3P是针对pPIC3.5K载体上的AOX基因而设计的引物。对于重组酵母转化子的筛选和鉴定设计了重组子的特异性引物OACF/AOX3P,引物ACF/ ACR与AOX5P/AOX3P也可用于重组子的鉴定。所有引物均由苏州金唯智生物科技有限公司合成,见表1。

表1 实验中用到的引物Table 1 Primers used in this study
1.5 RT-PCR与克隆基因的序列分析
提取中华蜜蜂 (AC)脑部组织Total RNA,以Total RNA为模板,经RT-PCR扩增出AChE cDNA全长,使用特异性引物ACF/ACR扩增出目的片段,将 PCR产物进行胶回收后连接到 pMD20-T Vector,转化大肠杆菌感受态细胞DH5α,在含100 ng/mL Amp的LB平板上过夜培养。挑取单菌落进行菌落PCR鉴定,鉴定正确的菌株送苏州金唯智生物科技有限公司进行DNA序列测定。所涉及的PCR扩增、胶回收、连接转化及酶切方法均为分子克隆常规方法。
1.6 重组表达质粒的构建、转化及鉴定
将测序正确的AChE基因克隆到pPIC3.5K载体上,利用电转化法转化毕赤酵母GS115,将重组表达盒整合入酵母基因组中,涂布于MD平板培养至出现单菌落。根据重组子在MD平板上的生长状况及其遗传霉素(G418)抗性初步筛选菌株,使用引物ACF和AOX3P通过菌落PCR反应进一步验证重组菌株。
1.7 摇瓶诱导表达
培养基装瓶体积分数10%,30℃、230 r/min振荡培养。先用BMGY培养基种培养至OD600为4,离心收集菌体,用两倍体积的BMMY培养基重悬细胞,转移至新的三角瓶中诱导培养144 h,每24小时添加甲醇,保持终浓度为0.5%。为确定最佳诱导时间,在诱导后每24小时取样500 μL,冻存于-70℃冰箱备用。
1.8 重组AChE的检测
1.8.1 蛋白质表达水平测定 离心收集菌体,用预冷的pH 7.5的50 mmol/L Tris HCl(含2 mmol/L EDTA)缓冲液在振荡仪作用下破碎细胞,离心,收集上清液,上清液即为胞内总蛋白质。将蛋白质样品变性处理后进行SDS-PAGE电泳(浓缩胶4 g/dL,分离胶12 g/dL),使用考马斯亮蓝R250染色,分析目的蛋白质表达水平和相对分子质量。
1.8.2 蛋白质质量浓度测定 利用Bradford考马斯亮蓝G-250法[14]测定胞内总蛋白质的质量浓度。首先在96孔板中按1∶5比例加入不同浓度的牛血清白蛋白(BSA)与考马斯亮蓝液,混合均匀后反应15 min,测A595,制定出蛋白质质量浓度标准曲线,接着测定样品与考马斯亮蓝混合反应后的A595值,根据其A595值从标准曲线上查得样品的蛋白质质量浓度。
1.8.3 酶活性检测 以同时诱导过的转化空载体的重组菌作为对照,利用微量羟胺比色法[15]在96孔板上对胞内总蛋白质进行显色反应。在96孔板上加入200 μL的蛋白质样品与4 μL、0.1 mol/L 3-吲哚乙酰酯混匀,室温放置30 min,肉眼观察颜色变化。在初步筛选出有活性的AChE的基础上测定AChE的比酶活。
1.9 重组AChE的纯化
诱导高活性的毕赤酵母重组菌株表达AChE 120 h后提取酵母胞内总蛋白质。按照海狸磁珠组氨酸标签蛋白纯化试剂盒用户手册纯化蛋白质,并对纯化过程中收集到的产物进行SDS-PAGE分析。实验中用于纯化的缓冲溶液:
1)Buffer A(Binding Buffer):20 mmol/L磷酸钠缓冲液(pH 7.4),500 mmol/L NaCl,50 mmol/L咪唑。
2)Buffer B(Washing Buffer):20 mmol/L磷酸钠缓冲液(pH 7.4),500 mmol/L NaCl,100 mmol/L咪唑。
3)Buffer C(Elution Buffer):20 mmol/L磷酸钠缓冲液(pH 7.4),500 mmol/L NaCl,500 mmol/L咪唑。
1.10 纯化的中华蜜蜂乙酰胆碱酯酶用于有机磷残留的检测
购买的市售有机磷农药检测试剂盒是采用Ellman法[16]测定AChE的活性。采用纯化的乙酰胆碱酯酶替换试剂盒中的乙酰胆碱酯酶粗酶液,利用试剂盒中已有的显色剂和底物,在96孔板上按比例加入磷酸缓冲液、酶液、显色剂(105∶10∶10),混匀,37℃放置5 min,加入与显色剂等体积的底物,立即置于酶标仪中,测定405 nm波长下前3分钟吸光度的变化值(ΔOD/min)。同时测定试剂盒中酶液的活性。
采用有机磷农药氯吡硫磷作为抑制剂,利用上述方法测定405 nm波长下前3分钟吸光度的变化值,计算抑制率(Ri)。
酶活性的计算公式=(ΔOD/min)/(1.36×104L/(mol·cm)×0.61cm)×103。
抑制率的计算公式:Ri(%)=(ΔA0-ΔA)/ΔA0
其中,ΔA0为不加抑制剂的酶活性反应吸光度变化值,ΔA为加入抑制剂的酶活性反应吸光度变化值。
2 结果与讨论
2.1 AChE基因片段的克隆
采用特异性引物ACF/ACR,以中华蜜蜂头部组织所提取的总RNA为模板,经RT-PCR扩增后,扩出1条约1.8 kb的条带,与预期大小相一致,见图1。
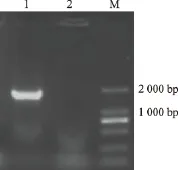
图1 AChE cDNA的PCR扩增结果Fig.1 Result of PCR amplification of cDNA of AChE
2.2 重组AChE酵母表达载体的构建
克隆于pMD20-T上的AChE基因经测序鉴定正确后,用SnaBⅠ和NotⅠ双酶切并回收,与经相同的酶双酶切后的毕赤酵母胞内表达空载体pPIC3.5K连接,转化大肠杆菌感受态细胞DH5α,得到的阳性菌经菌液PCR及双酶切鉴定后,获得重组表达质粒pPIC3.5K-AChE。重组表达质粒由苏州金唯智科技公司测序,测序结果与预期的pPIC3.5KAChE相一致。整个质粒构建流程图见图2。
2.3 重组子的筛选鉴定
重组表达质粒经SalⅠ酶切线性化后即可电转化毕赤酵母GS115。pPIC3.5K为酵母胞内表达载体,整个重组基因表达盒受上游的乙醇氧化酶(AOX1)启动子的调控表达,pPIC3.5K的Kan基因赋予大肠杆菌卡那基因抗性,赋予毕赤酵母遗传霉素抗性。以遗传霉素基因(Kan)与组氨酸脱氢酶基因(His4)为筛选标志,用SalⅠ酶切的线性化表达载体pPIC3.5K-AChE约10.8 kb的表达单位,在山梨糖醇的介导下,于电击杯中以750 V/mm的电压作用,穿透酵母细胞壁及核膜,与毕赤酵母GS115的基因组发生同源重组。采用不同方法对转化子进行筛选鉴定,利用MD平板进行表型筛选。获得45个阳性转化子,接着在含0.25 mg/mL G418的YPD平板上培养重组菌,利用pPIC3.5K-AChE基因上的特异性序列射击类引物OACF和AOX3P,对阳性转化子进行菌落PCR鉴定,由于该对引物只有含pPIC3.5K-AChE片段的载体才能扩增出,避免了毕赤酵母GS115中的AOX1基因与非特异性片段的干扰,扩增出与预期大小相一致的片段,约1 740 bp,PCR结果见图3。
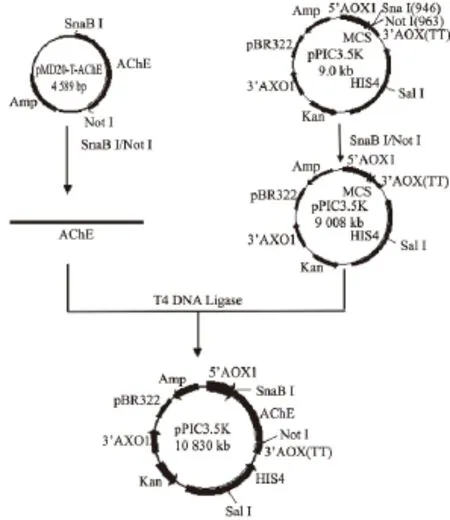
图2 质粒构建流程Fig.2 Construction of plasmid pPIC3.5K-AChE

图3 利用特异性引物对酵母转化子的PCR鉴定Fig.3 PCR analysis of Pichia integrants with specific primer
2.4 摇瓶培养初筛高表达菌株
在对阳性转化子进行多重鉴定的基础上,对经PCR鉴定出的菌株进行小规模的诱导表达。由于蛋白质表达量有限,SDS-PAGE分析发现,在57 000处有一条与预期目的蛋白质大小一致的条带(箭头所指位置),但条带并不是特别明显,见图4。作者所在实验室在设计AChE基因插入pPIC3.5K时,方案为将基因插入到不含ATG的pPIC3.5K中,利用基因自身携带的337 bp处的ATG作为起始密码子,其最终翻译形成的蛋白质相对分子质量应为57 000。

图4 诱导表达120 h后重组AChE的SDS-PAGE分析Fig.4 SDS-PAGE analysis of recombinant AChE after induced 120 h
用3-酰基吲哚显色法检测表达蛋白质的相对活性,发现含重组菌株在摇瓶10%培养120 h时,表达的AChE比活性最高。而与市场上购买的AChE相比,本实验的重组AChE的活性略高于购买的AChE,显色结果见图5。

图5 不同重组酵母表达的AChE与3-酰基吲哚的显色反应Fig.5 Chromogenic reaction with 3-indoxyl acetate due to AChE of different strains
2.5 重组蛋白质纯化
挑取比活性最高的重组菌株进行诱导表达,使用组氨酸标签蛋白纯化试剂盒纯化蛋白质,SDS-PAGE结果显示,在经过两次洗脱后,在57 000处有一条明显的条带,与预期大小相符,结果见图5。
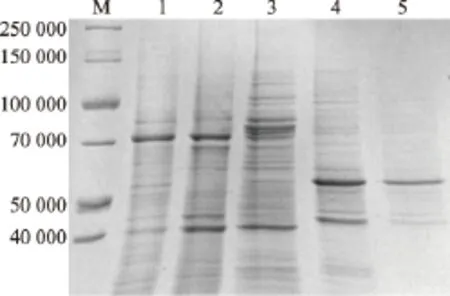
图6 重组AChE纯化过程的SDS-PAGE分析Fig.6 SDS-PAGE analysis of recombinant AChE at various stage of purification
2.6 纯化的中华蜜蜂乙酰胆碱酯酶用于有机磷残留的检测
购买的市场上现有销售的有机磷农药残留检测试剂盒是可直接用于农药检测工作的,并未标明酶的来源及活性水平。因此用农药残留检测试剂盒中的显色剂与底物同时与纯化的1.64×10-3mg中华蜜蜂乙酰胆碱酯酶和1.64×10-3mg原试剂盒中的酶液反应,在96孔板上同时测定两种酶液引起的405 nm处吸光度的变化值,计算出酶的比活性,发现试剂盒的酶液比活性为9 948 U/mg,而纯化的中华蜜蜂AChE比活性为10 568 U/mg。使用浓度为1×10-7mol/L的氯吡硫磷作为抑制剂测定酶受氯吡硫磷抑制的抑制率,发现1×10-7mol/L的氯吡硫磷对重组乙酰胆碱酯酶和试剂盒中乙酰胆碱酯酶的抑制率分别为79%和75%,可以看出氯吡硫磷对本实验纯化得到的中华蜜蜂乙酰胆碱酯酶的抑制效果要高于市场上现有农残检测试剂盒中的酶。
可见纯化的中华蜜蜂乙酰胆碱酯酶可以用于有机磷农药残留的检测工作,且灵敏度更高。
3 结语
我国是世界第一养蜂大国,养蜂历史悠久,约有2 000多年的历史,目前我国饲养的蜜蜂主要是意大利蜜蜂、中华蜜蜂和东北黑蜂。其中,中蜂是我国独有的蜜蜂当家品种。蜜蜂作为一类重要的经济动物,不仅为人类提供了营养丰富功能多样的蜂产品,而且在农业授粉促进植物繁衍和维持生态平衡中发挥着重要的作用[17]。2006年中华蜜蜂被列入农业部国家级畜禽遗传资源保护品种,所以研究中蜂的生物学特性对我国本地蜂种的利用以及我国养蜂业的保护都有一定的促进意义,目前国内已开展了很多关于中华蜜蜂的研究[18-19]。据统计,我国每年使用农药制剂100万t左右[20],而蜜蜂对有机磷和氨基甲酸酯类杀虫剂极为敏感[21]。1990年至今,因农药中毒导致蜜蜂死亡、蜂群数量骤减的现象遍及北美、欧洲、亚洲等许多国家和地区,已成为全球普遍关注的环境污染与生物安全问题[22]。研究中华蜜蜂AChE不仅可以用于食品安全中农药残留检测工作,还可作为判断中蜂是否接触杀虫剂的生化指标,为我国的养蜂事业做出巨大贡献。
目前已有多种AChE利用毕赤酵母表达系统得到了很好的表达,例如,Ayman S.Hussein等[23]利用该系统表达了巴西日圆线虫(Nippostrongylus brasiliensis)乙酰胆碱酯酶,Mendslson I等[24]利用该系统大量表达了电鳐(Torpedo californica)乙酰胆碱酯酶。在本研究中,作者构建了一系列含有中华蜜蜂乙酰胆碱酯酶基因的毕赤酵母重组表达质粒,选择了不同的线性化酶切位点,用于挑选出一组表达效果及酶活性水平较好的组合。在实验中,我们依据前人的经验,采用了多种方法来筛选和鉴定重组菌株,包括在MD和MM平板上进行Mut+和Muts表型筛选、遗传霉素抗性筛选、特异性引物的菌落PCR。本实验使用Ellman法来定义AChE的活力单位(1 U=1 μmolACh/min,即AChE在37℃、pH 7.2的条件下,每分钟水解1 μmol的ACh定义为1个活力单位)。与市场上购买的农药残留检测试剂盒中的AChE相比,本实验得到的酶的比活力高于试剂盒中的AChE。而本实验中酵母表达的胞内蛋白质由于培养条件、蛋白质提取方法和酶活测定方法均未经过优化,得到的酶活并不一定是其最佳活力。因此要得到更高的活力以及更灵敏地应用到农药残留检测工作中,还需要进一步优化整个诱导表达工艺。
参考文献:
[1]黄华飞.控制农药残留加强食品安全[J].农家之友,2008,12:75-76. HUANG Huafei.Control the pesticide residue to nhance food safety[J].Friends of the Farm,2008,12:75-76.(in Chinese)
[2]吴兰团,陈国代.果蔬残余农药对人体危害刍议[J].南平师专学报,2001,20(4):106-108. WU Lantuan,CHEN Guodai.A discussion of the harm to human health of pesticide residues in fruit and vegetable[J].Nanping Teachers Journal,2001,20(4):106-108.(in Chinese)
[3]高桂枝,王圣巍,王俏,等.残留农药污染危害及其防治[J].延安大学学报:自然科学版,2002,21(1):52-53. GAO Guizhi,WANG Shengwei,WANG Qiao,et al.The pollution hazard and prevention of pesticide residues[J].Yan'an University Journal:Natural Sciences,2002,21(1):52-53.(in Chinese)
[4]于徊萍,王彩梅.食品农药残留分析的现代进展[J].吉林粮食高等专科学校学报,2001,16(1):15-17. YU Huiping,WANG Caimei.Modern advances of pesticide residue analysis in food[J].Jilin Grain College Journal,2001,16(1):15-17.(in Chinese)
[5]吕建华,安红周,郭天松.农药残留对我国食品安全的影响及相应对策[J].食品科技,2006,11:16-20. LU Jianhua,AN Hongzhou,GUO Tiansong.The impact of pesticides on food safety and appropriate countermeasures[J].Food Science and Technology,2006,11:16-20.(in Chinese)
[6]伍小红,李建科,惠伟.农药残留对食品安全的影响及对策[J].食品与发酵工业,2005,31(6):80-84. WU Xiaohong,LI Jianke,HUI Wei.The influence of pesticide residues on food safety and countermeasure[J].Food and Fermentation Industries,2005,31(6):80-84.(in Chinese)
[7]高晓辉.蔬菜上农药残留快速检测势在必行[J].农药科学与管理,2000,21(1):16-17. GAO Xiaohui.Rapid detection of pesticide residues on vegetables is imperative to implement[J].Pesticide Science and Administration,2000,21(1):16-17.(in Chinese)
[8]王瀛寰,张艳峰,张旭,等.五种农药对中华蜜蜂和意大利蜜蜂工蜂的经口毒性比较[J].农药学学报,2012,14(4):453-456. WANG Yinghuan,ZHANG Yanfeng,ZHANG Xu,et al.Oral toxicity comparison of five kind of pesticides to drones of Apiscerana cerana and Apis mellifera[J].Pesticide Science Journal,2012,14(4):453-456.(in Chinese)
[9]张莹,黄建,高希武.两种蜜蜂头部乙酰胆碱酯酶对杀虫药剂敏感度比较[J].农药学学报,2005,7(3):221-226. ZHANG Ying,HUANG Jian,GAO Xiwu.Sensitive comparison of acetylcholinesterase to insecticides in two bees head[J]. Pesticide Science Journal,2005,7(3):221-226.(in Chinese)
[10]MA Xingyuan,TAN Jianhua,WEI Dongzhi,et al.High-level secretion and purification of recombinant acetylcholinesterase from human cerebral tissue in P.pastoris and identification by chromogenicreaction[J].Appl Microbiol Biotechnol,2006,72:316-322.
[11]TAN Furong,WANG Ligang,WANG Jinbin,et al.Enhanced pesticide sensitivity of novel housefly acetylcholinesterases:a new tool for the detection of residual pesticide contamination[J].Bioprocess Biosyst Eng,2011,34(3):305-314.
[12]LI Jingquan,BA Qian,YIN Jun,et al.Surface display of recombinant Drosophila melanogaster acetylcholinesterase for detection of organic phosphorus and carbamate pesticides[J].PLoS One,2013,8(9):e72986.
[13]SATO R,MATSUMOTO T,HIDAKA N,et al.Cloning and expression of carp acetylcholinesterase gene in Pichia pastoris and characterization of the recombinant enzyme[J].Protein Expr Purif,2009,64(2):205-312.
[14]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72:248-254.
[15]VILLATTE F,BACHMAN T T,HUSSEIN A S,et al.Acetylcholinesterase assay for rapid expression screening in liquid and solid media[J].Bio Techniques,2001,30:81-86.
[16]ELLMAN G L,COURTNEY K D,ANDRES V,et al.A new and rapid colorimetric determination of acetylcholinesterase activity [J].Biochem Pharmacol,1961,7:88-95
[17]孔常兴.蜜蜂及其作用[J].西藏科技,2010,8:15-19. KONG Changxing.The bees and their effect[J].Tibet Science and Technology,2010,8:15-19.(in Chinese)
[18]刘俊峰,刘亭亭,王欢,等.中华蜜蜂铜锌超氧化物歧化酶基因的克隆-序列分析及表达特征[J].动物营养学报,2012,24(8):1512-1519.LIU Junfeng,LIU Tingting,WANG Huan,et al.Cloning of Apiscerana cerana copper/zinc superoxide dismutase gene-sequence analysis and expression characteristics[J].Chinese Journal of Animal Nutrition,2012,24(8):1512-1519.(in Chinese)
[19]倪翠侠,张林雅,李红亮,等.中华蜜蜂化学感受蛋白基因家族克隆及表达分析[J].中国农业科学,2013,46(8):1706-1715. NI Cuixia,ZHANG Linya,LI Hongliang,et al.Molecular cloning and expression profiles analysis of chemosensory protein genes family in the Chinese honeybee(Apis cerana cerana)[J].Scientia Agricultura Sinica,2013,46(8):1706-1715.(in Chinese)
[20]王献忠.我国农药生产和使用现状及其展望[J].科技信息(农林论坛),2011,13:777-816. WANG Xianzhong.The present situation and outlook of pesticides’production and usage in China[J].Science and Technology Information(Agriculture,Forestry Forum),2011,13:777-816.(in Chinese)
[21]RAHMAN M F,SIDDIQUI M K,ANJUM F,et al.Acute toxicity and anti acetylcholinesterase potential of some biphenyl derivatives to non target species[J].Indian J Exp Biol,1989,27(2):138-140.
[22]卜元卿,单正军,周军英.农药对蜜蜂生物毒性及安全性评价研究回顾[J].农药,2009,48(6):399-401. BO Yuanqing,SHAN Zhengjun,ZHOU Junying.A reviewof pesticides biological toxicity and safety evaluation to bees[J]. Agrochemicals,2009,48(6):399-401.(in Chinese)
[23]HUSSEIN A S,CHACON M R,SMITH A M,et al.Cloning,expression,and properties of a nonneuronal secreted acetylcholinesterase from theparasitic nematode Nippostrongylus brasiliensis[J].J Biol Chem,1999,274:9312-9319.
[24]MENDELSON I,KRONMAN C,ARIEL N,et al.Bovine acetylcholinesterase:cloning,expression and characterization[J].J Biochem,1998,334:251-259.
Cloning,Expression and Identification of Apiscerana cerana Acetylcholinesterase Gene in Pichia pastoris
CAO Xue1,2, CHEN Zhankuan3, BAI Zhonghu2, YANG Yankun*2, CHEN Jifeng1
(1.School of Life Science,Zhengzhou University,Zhengzhou 450001,China;2.National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China;3.Henan Tianmao Biological Co. Ltd.,Zhengzhou 450001,China)
Organophosphate (OP) pollution is amajorhidden dangerto food safety,acetylcholinesterase can be used to detect the residual OP pesticide.Apiscerana cerana is a unique kind of Apoidea which has not been found in other countries except for China,and it has a high sensitivity to pesticides.On the other hand,acetylcholinesterase gene from Apiscerana cerana has not been cloned and applied in food safety detection.In this study,using the total RNA from Apiscerana cerana head tissue as a template,a 1.8kb AChE cDNA sequence was obtained by RACE method,then the target sequence was cloned into the yeast expression vector pPIC3.5K.AChE was expressed and located in Pichia pastoris GS115 after induced with 0.5%methanol.The SDS-PAGE and activityanalysis showed that Apiscerana cerana AChE gene was successfully cloned and expressed in Pichia pastoris for the first time.A strain with higher activity AChE was selected to express AChE,and its AChE activity was 10 568 U/mg,which could be used to detect the residual OP pesticide.
food safety,organophosphate detection,Apiscerana cerana acetylcholinesterase,Pichia pastoris,cloning and expression
Q 78
A
1673—1689(2016)12—1336—08
2015-01-30
中央高校基本科研业务费专项资金项目(JUSRP51401A)。
*通信作者:杨艳坤(1978—)男,河北石家庄人,理学博士,副教授,硕士研究生导师,主要从事微生物学、基因工程、分子遗传、蛋白质的分离纯化及特性等方面的研究。E-mail:yangyankun@jiangnan.edu.cn

