阻断Sonic Hedgehog信号对不同人肝癌细胞生长的影响*
刘爱梅, 余功旺, 黄莉霞, 孙 艳△, 迟作华
(广东药学院1生命科学与生物制药学院,2临床医学院,广东 广州 510006)
阻断Sonic Hedgehog信号对不同人肝癌细胞生长的影响*
刘爱梅1,余功旺1,黄莉霞1,孙艳1△,迟作华2△
(广东药学院1生命科学与生物制药学院,2临床医学院,广东 广州 510006)
[摘要]目的: 研究阻断Sonic Hedgehog (Shh)信号对不同人肝癌细胞生长的影响,探讨阻断Shh信号抑制肝癌细胞生长的机制。方法: RT-PCR法检测Shh信号分子在3株人肝癌细胞(BEL-7402、Huh7和HepG2)中的表达,并检测Shh阻断抗体作用后BEL-7402细胞Shh信号效应分子表达变化;MTT法检测人肝癌细胞增殖活性;流式细胞术检测人肝癌细胞凋亡;Western blot 检测凋亡相关蛋白表达。结果: Shh信号分子在3株人肝癌细胞中均有表达,Shh阻断抗体可以下调Shh信号效应分子patched (Ptch)、Gli1和Gli2的表达;Shh阻断抗体可以抑制3株肝癌细胞生长,增加G0/G1期细胞,并诱导细胞凋亡;Shh阻断抗体作用后,BEL-7402细胞pro-caspase-3、pro-caspase-8和pro-caspase-9蛋白表达水平下降,cleaved caspase-3、cleaved caspase-8和cleaved caspase-9蛋白表达水平升高。结论: 阻断Shh信号可抑制Shh高表达的人肝癌细胞生长,阻滞细胞周期于G0/G1期,并诱导肝癌细胞凋亡。
[关键词]肝癌细胞; Sonic Hedgehog; 细胞凋亡
肝癌以肝细胞癌(hepatocellular carcinoma, HCC)为主要类型,是全世界范围内最常见的恶性肿瘤之一。在中国,肝癌发病率和死亡率逐年上升,已高居恶性肿瘤相关死亡原因第2位[1]。目前虽然发展了多种肝癌治疗手段,但其总体生存率仍然较低。研究表明,肝癌与其它癌症一样是复杂多样的疾病,即使具有相同的病理改变,却可能由完全不同的基因变化(p53、PTEN等)和信号异常(Hedgehog、Wnt/β-catenin等)造成[2-4]。这也是病理类型相同的肝癌患者对常规放化疗反应不同的重要原因[5]。因此,针对患者个体的肿瘤相关基因或异常信号分子开展精准治疗成为提高肝癌治疗效果的重要策略[6]。
Hedgehog信号通路是早期胚胎发育时影响极性形成的关键信号通路[7]。大量研究显示,Hedgehog家族成员Sonic Hedgehog (Shh)异常激活Hedgehog信号参与了包括肝癌在内多种肿瘤的恶性生长和转移[8-9]。Huang等[10]研究显示,50%左右HCCs中存在Shh信号异常激活。然而,研究也显示,Shh信号异常激活水平在不同HCCs中存在差异,以Shh信号为靶点治疗时,肝癌患者受益水平和反应可能不同[11]。此外,阻断Shh信号抑制肝癌生长的机制目前还未阐明。
因此,本研究选取3株HCCs细胞,应用Shh阻断抗体从源头靶向阻断Shh信号通路,观察其对不同肝癌细胞生长的影响,并通过检测细胞周期、细胞凋亡以及凋亡相关蛋白初步探讨阻断Shh信号抑制HCCs生长的作用及机制,为临床开展以Shh信号为靶点的精准治疗提供实验依据。
材料和方法
1材料与试剂
人肝癌细胞株BEL-7402、Huh7和HepG2由广东药学院生物制药研究所提供。RPMI-1640购自Gibco;胎牛血清(fetal bovine serum,FBS)购自杭州四季青公司;抗人Shh阻断抗体和兔抗人IgG购自Santa Cruz;抗人pro-caspase-3、pro-caspase-8、pro-caspase-9、cleaved caspase-3、cleaved caspase-8和cleaved caspase-9抗体购自CST;MTT、二甲亚砜和PI购自Sigma;RT-PCR试剂盒购自TaKaRa;Westen blot相关生化试剂和ECL化学发光液购自Milipore。
2细胞培养
人肝癌细胞株BEL-7402、Huh7和HepG2以含10%胎牛血清的RPMI-1640培养基,放置于37 ℃、饱和湿度、5% CO2的温箱中孵育,细胞融合度达到80%~90%时以1∶3或1∶4的比例传代。取对数生长期的细胞进行实验。
3实验方法
3.1RT-PCR检测Shh信号分子的表达收集对数生长期细胞,用完全培养基(含10%FBS的RPMI-1640培养基)重悬,按每孔4×105接种于6孔板。37 ℃、5% CO2培养过夜,加入Shh阻断抗体,使其终浓度为1、2 mg/L。设置对照组,加入2 mg/L IgG。培养24 h,TRIzol法提取总RNA,逆转录生成cDNA。PCR扩增细胞跨膜蛋白Patched (Ptch)、Smoothened (Smo)及锌指家族转录因子Gli1、Gli2。扩增条件为:95 ℃ 5 min;95 ℃ 30 s,57 ℃ 30 s,72 ℃ 45 s,循环30次; 72 ℃ 2 min。所用的引物序列见表1。

表1 引物序列
3.2MTT法检测HCC细胞的存活率收集对数生长期细胞,用完全培养基重悬,按每孔8×103接种于96孔板。37℃、5% CO2培养过夜,实验组加入Shh阻断抗体,使其终浓度为1、2 mg/L。设置空白对照组与阴性对照组,阴性对照组加入2 mg/L IgG。培养24 h,每孔加入10 μL MTT溶液(10 g/L),孵育4 h,酶标仪测定450 nm波长处的吸光度(A)值。计算存活率:阴性对照组存活率(%)=A(阴性对照组)/A(空白对照组)×100%;实验组存活率(%)=A(实验组)/A(阴性对照组)×100%。
3.3流式细胞术检测细胞周期与细胞凋亡收集对数生长期细胞,用完全培养基重悬,按每孔4×105接种于6孔板。分组(同3.1)处理后,37 ℃、5% CO2培养24 h或48 h后胰酶消化,收集细胞。75%乙醇固定12 h以上。PBS洗2次,PI染液避光染色10 min。流式细胞术检测。应用ModFit软件进行细胞周期分析。
3.4Western blot检测凋亡蛋白收集对数生长期细胞,用完全培养基(含10% FBS的1640培养基)重悬,按每孔4×105/孔接种于6孔板。分组(同3.1)处理后,37 ℃、5% CO2培养24 h,收集细胞,PBS漂洗后加入预冷的蛋白裂解液中,冰上裂解30 min,4 ℃ 10 000×g离心15 min,去除细胞碎片,吸取上清液,提取总蛋白用Bradford法定量,进行Westen blot实验。取20 μL总蛋白行聚丙烯酰胺凝胶电泳(4%浓缩胶,12%分离胶)。随后将蛋白质转印至PVDF膜上,用含10%脱脂奶粉的TBST缓冲液于4 ℃封闭1 h,分别加入1∶1 000稀释的pro-caspase-3、pro-caspase-8、pro-caspase-9、cleaved caspase-3、cleaved caspase-8、cleaved caspase-9多克隆抗体和GADPH抗体于摇床中孵育1 h,TBST洗膜4次,每次10 min,然后加入1∶4 000稀释的辣根过氧化酶标记的Ⅱ抗于摇床中孵育1 h,TBST 洗膜5次后经ECL化学发光,显影、定影后分析。
4统计学处理
各项指标结果用均数±标准差(mean±SD)表示,采用SPSS 17.0软件进行t检验或单因素方差分析。以P<0.05为差异有统计学意义。
结果
1Shh信号分子在3株HCCs细胞中的表达
配体Shh、受体Ptch、Smo以及转录因子Gli1、Gli2在BEL-7402、Huh7和HepG2细胞中均有表达,但表达水平不同。其中配体Shh、Shh信号通路活化靶基因Ptch、Gli1以及激活型转录因子Gli2在BEL-7402细胞中表达水平最高,在HepG2细胞中表达水平最低,见图1。
2Shh阻断抗体抑制HCCs细胞中Shh信号活化
为了解Shh阻断抗体对HCCs细胞中Shh信号活化的影响,我们以Shh信号激活程度最高的HCC细胞株BEL-7402细胞为例,采用RT-PCR方法检测Shh阻断抗体作用后Ptch、Gli1和Gli2表达水平变化,结果发现1 mg/L Shh阻断抗体作用24 h,BEL-7402细胞Ptch、Gli1和Gli2表达水平降低,与对照IgG组相比差异有统计学意义(P<0.05),见图2。

Figure 1.Expression of Shh signaling molecules in HCCs cells.
图1Shh信号分子在3株HCCs细胞中的表达

Figure 2.Shh antibody (Shh Ab) inhibited activation of Shh signaling pathway in BEL-7402 cells.Mean±SD.n=3.*P<0.05,**P<0.01vsIgG.
图2Shh阻断抗体抑制肝癌细胞BEL-7402中Shh信号通路活化
3阻断Shh信号抑制人肝癌细胞生长
为研究阻断Shh信号通路对不同HCC细胞生长的影响,采用MTT法检测了Shh阻断抗体作用后3株HCC细胞存活率。结果发现,1 mg/L Shh阻断抗体作用24 h,BEL-7402和Huh7细胞存活率下降,与对照组相比差异有统计学意义(P<0.05);2 mg/L Shh阻断抗体作用24 h,BEL-7402和Huh7细胞存活率下降更明显,存活率分别为(19.5±2.1)%、(29.6±2.9)%。HepG2细胞在2 mg/L Shh阻断抗体作用下存活率才下降至(89.3±0.9)%,见图3。

Figure 3.Blockade of Shh signaling pathway inhibits growth of HCC cells.Mean±SD.n=3.*P<0.05,**P<0.01vsIgG.
图3阻断Shh信号抑制HCC细胞生长
4阻断Shh信号通路对人肝癌细胞周期和细胞凋亡的影响
1 mg/L Shh阻断抗体作用24 h,BEL-7402和Huh7 G0/G1期细胞增多,与对照组相比差异有统计学意义(P<0.05),HepG2 G0/G1期细胞百分数随抗体浓度增加而增加,在Shh阻断抗体浓度为2 mg/L时,与对照组相比有统计学意义(P<0.05)。BEL-7402和Huh7 G0/G1期细胞百分数跟Shh阻断抗体水平没有明显的量效关系。此外,1 mg/L Shh阻断抗体作用24 h,BEL-7402、Huh7细胞发生凋亡,与对照组相比差异有统计学意义(P<0.05),而HepG2细胞没有发生显著的凋亡;2 mg/L Shh阻断抗体作用24 h,BEL-7402、Huh7细胞凋亡水平显著上升,分别为(58.7±3.4)%和(41.7±2.9)%,HepG2细胞开始出现凋亡,凋亡水平为(6.8±1.4)%,见图4。
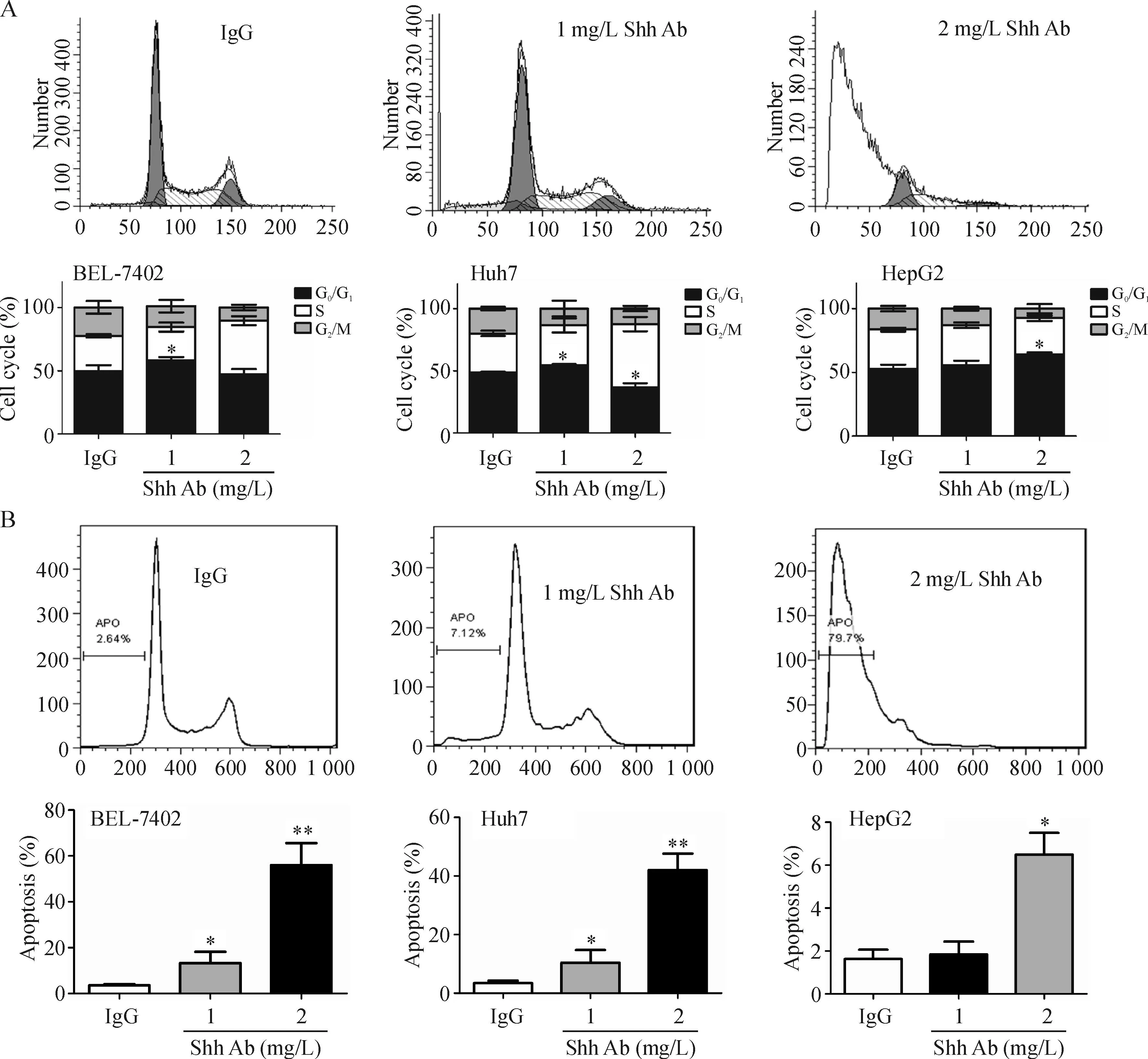
Figure 4.The effects of Shh signaling blockade on cell cycle (A) and apoptosis (B) of HCC cells. Mean±SD.n=3.*P<0.05,**P<0.01vsIgG.
图4阻断Shh信号对HCC细胞细胞周期及凋亡的影响
5阻断Shh信号通路调控肝癌细胞凋亡相关蛋白表达
1、2 mg/L Shh阻断抗体作用于BEL-7402细胞24 h,pro-caspase-3和pro-caspase-9蛋白表达降低,其活化形式cleaved caspase-3和cleaved caspase-9蛋白表达升高,与对照组相比差异有统计学意义(P<0.05);2 mg/L Shh阻断抗体作用后,pro-caspase-8蛋白表达水平降低,其活化形式cleaved caspase-8表达升高,与对照组相比差异有统计学意义(P<0.05),见图5。

Figure 5.The effects of Shh signaling blockade on the expression of caspase proteins in HCC cells. Mean±SD.n=3.*P<0.05,**P<0.01vsIgG.
图5阻断Shh信号对HCC细胞中caspase蛋白表达的影响
讨论
Hedgehog家族在高等动物中有3个同源因子Sonic Hedgehog(Shh)、Desert Hedgehog(Dhh)和In-dian Hedgehog(Ihh),均通过结合细胞膜受体Ptch后释放Smo并解除Ptch对Smo的抑制,Smo进而活化Gli,活化的Gli转录因子家族成员(Gli1、Gli2和Gli3)调控下游基因表达,参与早期胚胎发育时机体对称性和极性形成[7]。 Hedgehog信号在大部分正常人体组织中处于静息状态[12],但在多种恶性肿瘤中会有Shh分子异常激活[11-13]。因此,Shh信号已成为肝癌等多种肿瘤精准治疗的重要靶点[13-14]。然而,研究虽已充分证实了Shh信号在肝癌恶性生长、侵袭和转移中的重要作用[4,10,15],但已有的研究均未能显示在以Shh信号为靶点时不同肝癌细胞的反应性如何,也未能阐明其作用机制。因此本研究探讨了从源头阻断Shh信号对3株不同的人肝癌细胞株生长的影响,并初步探讨了以Shh信号为靶点调控肝癌生长的作用和分子机制。
首先通过检测信号分子表达情况了解Shh信号在BEL-7402、Huh7和HepG2细胞中的活化水平。结果发现Hh信号配体Shh及受体Ptch、Smo、Gli1和Gli2在3株HCC细胞中均有表达,说明HCCs细胞均表达Shh分子,并可结合自身细胞膜受体Ptch激活Shh信号通路。然而,Ptch、Gli1和Gli2在3株HCC细胞中表达水平不一致,以BEL-7402细胞中表达水平最高,HepG2细胞中表达水平最低。鉴于Ptch和Gli1本身即Shh信号调控的靶基因,表达水平可以反映该信号通路激活情况,Gli2又是该通路的激活型转录因子[16],本研究结果说明Shh信号通路在BEL-7402细胞中激活水平最高,而在HepG2细胞中最低。这与Huang等[10]检测Huh7细胞表达Shh信号分子水平高于HepG2细胞的结果类似。
Shh信号与肿瘤恶性增殖的关系最为密切。应用Smo特异性阻断剂Cyclopamin、Shh阻断抗体可以有效地抑制胰腺癌、神经母细胞瘤、胃癌细胞生长[13]。本研究应用不同浓度的Shh阻断抗体作用于Shh信号通路激活水平最高的BEL-7402细胞,结果发现1 mg/L Shh阻断抗体即可显著下调Ptch与Gli1表达水平,说明Shh阻断抗体可有效阻断HCC细胞中Shh信号通路的激活,而且阻断效应随抗体浓度增加而增强。进一步检测Shh阻断抗体对3株HCC细胞生长的影响,结果发现Shh阻断抗体可以显著抑制BEL-7402和Huh7细胞生长,Shh阻断抗体为2 mg/L时上述两种细胞存活率仅为20%~30%;而HepG2细胞在低浓度Shh阻断抗体作用下未出现生长抑制,仅在高浓度抗体作用下存活率下降10%左右。这提示Shh信号在HCC细胞中激活的基础水平决定了以Shh为靶点抑制肝癌细胞生长的水平。
研究显示,阻断Shh信号可以通过上调基因p21诱导卵巢癌细胞凋亡[17],还可激活JNK/P38 MAPK信号通路诱导胃癌细胞凋亡[18]。应用Hh信号小分子抑制剂vismodegib还可阻滞细胞周期从而抑制神经母细胞瘤分裂[19]。本研究结果显示应用Shh阻断抗体阻断Shh信号可以使3株HCCs细胞周期阻滞于G0/G1期,而且诱导肝癌细胞凋亡。其中,Shh信号活化水平较高的BEL-7402和Huh7细胞凋亡显著。而基础Shh信号激活水平较低的HepG2细胞在阻断Shh信号后出现浓度依赖的G0/G1细胞周期阻滞,但仅有少数细胞在高浓度阻断抗体作用下发生凋亡。进一步以BEL-7402细胞为代表初步探讨阻断Shh信号诱导HCC细胞凋亡的分子机制,结果发现不同浓度Shh阻断抗体下调pro-caspase-3、pro-caspase-8和pro-caspase-9蛋白水平,并上调其活化形式cleaved caspase-3、cleaved caspase-8和cleaved caspase-9的蛋白水平。报道显示,caspase-8是Fas等死亡受体活化的下游分子,caspase-9则参与死亡受体与线粒体凋亡两条信号途径,二者活化后均能激活caspase-3,最终引起细胞凋亡[20]。结果提示阻断Shh信号可通过外源性和内源性凋亡途径诱导肝癌细胞凋亡。
综上所述,Shh信号通路在不同HCC细胞中均存在差异性的异常激活,阻断Shh信号通路可以通过阻滞细胞周期和诱导细胞凋亡抑制HCC细胞生长。但信号通路基础激活水平的差异是决定肿瘤细胞对以Shh信号为靶点的治疗手段反应性的重要因素。此外,HCC细胞的分子病理学研究显示,多个基因异常或信号通路异常可共同导致肝癌的发生。不同基因或信号之间的相互作用对HCC细胞反应性的影响也有待阐明。
[参考文献]
[1]Yang L, Xie G, Fan Q, et al. Activation of the hedgehog-signaling pathway in human cancer and the clinical implications[J]. Oncogene, 2010, 29(4):469-481.
[2]Severi T, van Malenstein H, Verslype C, et al. Tumor initiation and progression in hepatocellular carcinoma:risk factors,classification, and therapeutic targets[J]. Acta Pharmacol Sin, 2010, 31(11):1409-1420.
[3]Li J, Dai W, Xia Y, et al. Astaxanthin inhibits proliferation and induces apoptosis of human hepatocellular carcinoma cells via inhibition of NF-κB p65 and Wnt/β-catenininvitro[J]. Mar Drugs, 2015, 13(10):6064-6081.
[4]Giakoustidis A, Giakoustidis D, Mudan S, et al. Molecular signalling in hepatocellular carcinoma: Role of and crosstalk among WNT/β-catenin, Sonic Hedgehog, Notch and Dickkopf-1[J]. Can J Gastroenterol Hepatol, 2015, 29(4):209-217.
[5]Zhang Y, Zheng L, Ding Y, et al. MiR-20a induces cell radioresistance by activating the PTEN/PI3K/Akt signaling pathway in hepatocellular carcinoma[J]. Int J Radiat Oncol Biol Phys, 2015, 92(5):1132-1140.
[6]杭渤, 束永前, 刘平, 等. 肿瘤的精准医疗:概念、技术和展望[J]. 科技导报, 2015, 33(15):14-21.
[7]周昱男, 胡波.Shh基因在胚胎发育过程中的调控作用[J]. 中国病理生理杂志, 2008, 24(6):1240-1243.
[8]Liu H, Gu D, Xie J, et al. Clinical implications of hedgehog signaling pathway inhibitors[J]. Chin J Cancer, 2011, 30(1):13-26.
[9]孙晓东, 刘杏娥. 姜黄素通过抑制Ras-ERK和Shh-GLI1信号诱导胰腺癌细胞凋亡[J]. 中国病理生理杂志, 2012, 28(6):996-1000.
[10]Huang S, He J, Zhang X, et al. Activation of the hedgehog pathway in human hepatocellular carcinomas[J]. Carcinogenesis, 2006, 27(7):1334-1340.
[11]Al-Bahrani R, Nagamori S, Leng R, et al. Differential expression of Sonic Hedgehog protein in human hepatocellular carcinoma and intrahepatic cholangiocarcinoma[J]. Pathol Oncol Res, 2015, 21(4):901-908.
[12]Laukkanen MO, Castellone MD. Hijacking the Hedgehog pathway in cancer therapy[J]. Anticancer Agents Med Chem, 2015 Oct 7.[Epub ahead of print]
[13]Onishi H, Katano M. Hedgehog signaling pathway as a therapeutic target in various types of cancer[J]. Cancer Sci, 2011, 102(10):1756-1760.
[14]Kieran MW. Targeted treatment for sonic hedgehog-dependent medulloblastoma[J]. Neuro Oncol, 2014, 16(8):1037-1047.
[15]Lu J, Zhao W, He W, et al. Hedgehog signaling pathway mediates invasion and metastasis of hepatocellular carcinoma via ERK pathway[J]. Acta Pharmacol Sin, 2012, 33(5):691-700.
[16]Aza-Blanc P, Lin H, Ruizi Altaba A, et al. Expression of the vertebrate Gliproteins in Drosophila reveals a distribution of activator and repressor activities[J]. Development, 2000, 127(19):4293- 4301.
[17]Chen X, Horiuchi A, Kikuchi N, et al. Hedgehog signal pathway is activated in ovarian carcinomas, correlating with cell proliferation: it’s inhibition leads to growth suppression and apoptosis[J]. Cancer Sci, 2007, 98(1):68-76.
[18]Yan R, Peng X, Yuan X, et al. Suppression of growth and migration by blocking the Hedgehog signaling pathway in gastric cancer cells[J]. Cell Oncol(Dordr), 2013, 36(5):421-435.
[19]Chandra V, Das T, Gulati P, et al. Hedgehog signaling pathway is active in GBM with GLI1 mRNA expression showing a single continuous distribution rather than discrete high/low clusters[J]. PLoS One, 2015, 10(3):e0116390.
[20]李震东, 马清涌, 罗羽宏. Fas/FasL介导的caspase-3活化与急性胰腺炎腺泡细胞凋亡的关系[J]. 中国病理生理杂志, 2009, 25(6):1197-1201.
(责任编辑: 林白霜, 余小慧)
外周组织对Aβ的生理性清除及其对阿尔茨海默病的治疗潜力
淀粉样蛋白(amyloid-beta, Aβ)在阿尔茨海默病(Alzheimer disease, AD)的发病机制中扮演关键的角色。为了说明外周组织和器官中对脑源性Aβ的清除作用及治疗AD的潜力,中美科学家测量了人和鼠在循环系统的不同部位血中Aβ的浓度,并建立了联体动物模型来研究外周Aβ的分解代谢对AD发病机制中的影响。他们发现无论在人还是鼠体内,其次级腔静脉血中的Aβ浓度比上腔静脉血中的浓度低。另外,把125I标记的Aβ40注射到实验对象体内后,在肝、肾、消化道和皮肤中检测到大部分的放射性标记物,而在脑中却很少,提示脑组织产生的Aβ可以在外周被清除。在Aβ沉积前后进行联体动物实验(parabiosis),在没有改变淀粉样前体蛋白、Aβ合成及代谢酶类和Aβ转运受体的表达水平、也没有改变脑组织AD样病理变化(包括tau高度磷酸化、神经炎症以及神经元变性和丢失)的情况下,联体AD小鼠的脑组织Aβ负荷均明显降低。以上结果表明外周系统能有效清除脑源性Aβ,提示清除外周Aβ对治疗AD有价值,推测外周组织对Aβ清除不足可能与AD的发生有关。
Acta Neuropathol, 2015, 130(4):487-499(徐卉)
Effect of Sonic Hedgehog signaling blockade on growth of hepatocarcinoma cellsLIU Ai-mei1, YU Gong-wang1, HUANG Li-xia1, SUN Yan1, CHI Zuo-hua2
(1SchoolofBiosciencesandBiopharmaceutics,2MedicalCollege,GuangdongPharmaceuticalUniversity,Guangzhou510006,China.E-mail:sxmshw77@163.com;E-mail:zhchi33@126.com)
[ABSTRACT]AIM: To investigate the effect of Sonic Hedgehog (Shh) signaling blockade on the growth of hematocarcinoma cells and underlying mechanisms. METHODS: The expression of Shh signaling molecules in hematocarcinoma cell lines BEL-7402, Huh7 and HepG2 was detected by RT-PCR. The cell viability was detected by MTT assay. The cell cycle and apoptosis were analyzed by flow cytometry. The expression of apoptosis-related proteins was determined by Western blot. RESULTS: Shh signaling molecules were all expressed in BEL-7402, Huh7 and HepG2 cells. The mRNA expression of Patched (Ptch), Gli1 and Gli2 was down-regulated by anti-Shh antibody. Blockade of Shh signaling pathway inhibited the proliferation of hepatocarcinoma cells with increasing cells in G0/G1phase and induced the apoptosis of hepatocarcinoma cells. Treatment with anti-Shh antibody down-regulated the protein expression of pro-caspase-3, pro-caspase-8 and pro-caspase-9, while up-regulated the protein levels of cleaved caspase-3, cleaved caspase-8 and cleaved caspase-9 in BEL-7402 cells. CONCLUSION: Blockade of Shh signaling pathway inhibits the growth of hepatocarcinoma at different levels by cell cycle arrest and inducing apoptosis of hematocarcinoma cells.
[KEY WORDS]Hepatocarcinoma cells; Sonic Hedgehog; Apoptosis
doi:10.3969/j.issn.1000- 4718.2016.02.003
[中图分类号]R730.23
[文献标志码]A
通讯作者△孙艳 Tel: 020-39352150; E-mail: sxmshw77@163.com; 迟作华 Tel: 020-34055880; E-mail: zhchi33@126.com
*[基金项目]国家自然科学基金资助项目(No.81000923); 广东省科技计划(No.2013B021800089)
[收稿日期]2015- 10- 31[修回日期] 2015- 11- 16
[文章编号]1000- 4718(2016)02- 0208- 07

