细胞外钾对HERG基因无义突变L539fs/47表达的调控*
吕 颖, 张军波, 刘仲伟, 张爱峰, 潘军强, 王军奎, 潘 硕, 韩稳琦, 孙超峰△
(1陕西省人民医院心内一科,陕西 西安 710068;2西安交通大学第一附属医院心内科,陕西 西安 710061;3西安交通大学第二附属医院心内科,陕西 西安 710004)
细胞外钾对HERG基因无义突变L539fs/47表达的调控*
吕颖1,张军波2,刘仲伟1,张爱峰3,潘军强1,王军奎1,潘硕1,韩稳琦2,孙超峰2△
(1陕西省人民医院心内一科,陕西 西安 710068;2西安交通大学第一附属医院心内科,陕西 西安 710061;3西安交通大学第二附属医院心内科,陕西 西安 710004)
[摘要]目的: 研究持续细胞外钾对野生型HERG与其突变体L539fs/47蛋白表达的影响。方法: 用脂质体转染法将野生型HERG(WT)及其突变体HERG-L539fs/47(MT)分别转染HEK293细胞36 h后,0.8、4.3及10 mmol/L的钾干预6 h,流式细胞术检测HERG蛋白表达量;干预12 h用激光共聚焦成像和免疫印迹法进行HERG蛋白定位及表达量检测。结果: 用激光共聚焦成像检测发现野生型HERG蛋白主要分布在细胞膜上;而HERG突变体L539fs/47蛋白大部分滞留胞浆;并且HERG蛋白的表达均随细胞外钾浓度升高而增多。流式细胞术结果显示细胞外高钾组荧光增多(P<0.01),WT组荧光阳性细胞百分比和荧光强度均高于MT组(P< 0.05)。免疫印迹显示,不同于野生型 HERG 135 kD及155 kD 2个条带,突变体仅60 kD 1个条带,3个条带均受细胞外钾影响(P< 0.05)。结论: 细胞外高钾增强细胞膜上野生型和突变型HERG通道蛋白的稳定性,持续低钾干预时间依赖性地减少HERG通道蛋白的表达。
[关键词]HERG基因; 无义突变; 细胞外钾; HEK293细胞
心脏离子通道病先天性长QT综合征(long QT syndrome,LQTS)是一种由于编码心肌离子通道蛋白的基因突变导致心肌细胞复极异常而引起的临床综合征,常见年轻人的家族性恶性室性心律失常,表现为尖端扭转型室性心动过速(torsades de pointes,TdP)、晕厥和猝死。受关注药物引起的LQTS其发生亦具有遗传背景[1]。LQTS的患病率为1/2 500至1/2 000,分为LQT1~LQT13亚型。我国以LQT2为主,占已知LQTS的45 %[2]。
快速激活延迟整流钾通道(rapid delayed rectifier potassium channel, IKr)在心脏动作电位复极化过程中发挥重要作用,其突变导致LQT2。HERG基因编码IKr的α亚基形成四聚体后,与β亚基共同组成IKr。HERG蛋白在粗面内质网中核心糖基化成135 kD大小,再经过高尔基体进一步复合糖基化为155 kD成熟蛋白,组装成四聚体后转运到细胞膜,发挥生理功能;每个α亚基有6个跨膜片段、1个孔区以及氨基和羧基末端[1]。2007年[3]从一个LQTS家系中发现了父系遗传的HERG第7外显子cDNA第1 619~1 637核苷酸位点存在缺失突变,导致位于第586位氨基酸提前出现终止密码子,产生大片段丢失的截短蛋白质,肽链终止于S4区域前,命名为L539fs/47。
在病理状态下,心肌细胞外以低钾为主的慢性电解质紊乱很常见。既往对钾离子与LQT2的研究多集中在快速增加细胞外K+以减少HERG通道的失活,造成功能降低方面,以及近年来还发现生理浓度范围内提高细胞内K+浓度能稳定HERG通道蛋白从内质网输出。这2种机制的差异提出了一个重要的问题[4],即目前多研究急性低钾是否直接引起HERG功能抑制,而忽略了抑制HERG蛋白转运的因素,对使已经成功转运到膜上的HERG蛋白向细胞内逆向转运、降解的环境及药物因素鲜有研究。另外,对细胞外钾浓度持续变化时HERG离子通道蛋白表达时间相关的调控研究甚少,对钾浓度持续改变下HERG突变体蛋白表达和转运的研究值得关注。
材料和方法
1试剂和仪器
质粒野生型pcDNA3-HERG (WT) 和突变体pcDNA3-L539fs/47(MT)由本实验室张爱峰博士提供;pEGFP-C2-WT(本实验室霍建华博士提供);pEGFP-C2-MT(本实验室前期自行构建[5]);pDsRed2-ER(Clontech);HEK293细胞(本实验室提供);含4.3 mmol/L钾离子的高糖型DMEM培养基及胎牛血清(HyClone);X-tremeGENE HP DNA转染试剂(Roche);兔抗人HERG-N端单克隆抗体(Sigma);HRP标记的山羊抗兔IgG II 抗(Thermo);其它均为国产分析纯试剂。低钾(0.8 mmol/L)DMEM培养基采用高糖型DMEM培养基,选用国产分析纯试剂配制:添加氯化钾74.42 mg,溶解于1 L去离子水中,补加3.7 g NaHCO3,混匀后分别加入0.1 U/L青霉素和100 mg/L链霉素,将pH值调至7.2,经双层0.22 μm滤膜过滤除菌后,分装后-20 ℃冰箱保存。配制高钾(10 mmol/L)DMEM培养基:正常钾浓度的DMEM 100 mL加入10% KCl 435 μL。
TCS SP2型激光扫描共聚焦显微镜(Leica);FASCalibur流式细胞仪;2000型凝胶成像系统(Bio-Rad)。
2方法
2.1细胞培养用DMEM高糖型培养基加10%胎牛血清在37 ℃、5% CO2条件下培养HEK293细胞。
2.2细胞转染6孔板中HEK293细胞密度调整至40%~50%后,FuGENE® HD转染剂(质粒总量选取4 μL∶2 μg比例转染)。
2.3激光共聚焦成像在96孔板中,将pEGFP-C2-MT(绿色)或pEGFP-C2-WT(绿色)0.75 μg、内质网指示质粒pDsRed2-ER(红色)0.25 μg、无血清DMEM 50 μL和转染剂1 μL室温预混孵育15 min,加入HEK293细胞的24孔板中。转染36 h后,分为3组,分别换成含10%胎牛血清的低钾(0.8 mmol/L)、正常钾(4.3 mmol/L)和高钾(10 mol/L)DMEM培养基孵育12 h后,4%的多聚甲醛固定;碳酸甘油缓冲液封片后,分别用波长488 nm和633 nm激光分别激发绿色和红色荧光,在激光共聚焦显微镜下观察。
2.4流式细胞计数35 mol/L培养皿中HEK293细胞贴壁生长至60%~70%时,转染pEGFP-C2-WT或pEGFP-C2-MT后36 h,3组不同钾浓度(0.8、4.3和10 mmol/L)DMEM培养基孵育6 h,消化后用PBS悬浮细胞,调整浓度1×105~1×107/L,流式细胞术检测EGFP-WT或EGFP-MT融合蛋白的表达量。
2.5免疫印迹实验将pcDNA3-WT或pcDNA3-WT+pcDNA3-MT转染进野生组及杂合组HEK293细胞36 h后,3种浓度钾干预12 h,提取蛋白变性后保存。浓缩胶80 V,20~30 min,8 %分离胶120 V,60~90 min,兔抗人 I 抗(1∶200稀释),4 ℃过夜,TBST稀释HRP标记的 II 抗(山羊抗兔 II 抗1∶3 000稀释),室温2 h,HRP化学发光法显影。
3统计学处理
使用SPSS 15.0软件进行统计学分析,GraphPad Prism 5软件进行作图。计量资料采用均数±标准差(mean±SD)表示, WT组和WT+MT组间比较采用t检验;各浓度亚组间采用单因素方差分析,各亚组之间两两比较用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1激光共聚焦成像检测野生型及突变HERG蛋白的定位
pEGFP-C2-WT和pEGFP-C2-MT分别与特异性定位于内质网的pDsRed2-ER共转染HEK293细胞(图1),HERG-WT和HERG-MT分别与EGFP形成融合蛋白后,经蓝光模式激发显示细胞膜呈绿色光滑线型荧光图像,分别与pDsRed2-ER质粒(红色,仅在胞浆的内质网中表达)重叠后,可见“绿包红”(绿色荧光包绕在红色荧光外周)。EGFP-WT融合蛋白绿色荧光主要位于细胞膜上;表达的EGFP-MT截短突变蛋白荧光部分位于胞浆中,部分位于细胞膜上。突变通道蛋白膜分布减少,胞质内蛋白增加,且与内质网共定位,说明突变通道蛋白由于转运障碍而部分被滞留在内质网内。

Figure 1.Localization of WT and MT EGFP-HERG fusion channel proteins by laser scanning confocal microscopy.
图1激光共聚焦显微镜定位野生型及突变型EGFP-HERG融合通道蛋白
2激光共聚焦成像检测不同细胞外钾浓度干预后野生型及突变HERG蛋白的表达
低、中、高3组细胞外钾干预12 h后,高钾组EGFP-WT蛋白在细胞膜上分布最多;高钾组EGFP-MT截短突变蛋白表达亦最多,见图2。

Figure 2.The expression of EGFP-MT and EGFP-WT under different concentrations of extracellular potassium detected by green fluorescence.
图2绿色荧光显示不同细胞外钾浓度下EGFP-WT及EGFP-MT的表达
3流式细胞术结果
pEGFP-C2-WT及pEGFP-C2-MT转染HEK293细胞36 h,再经0.8、4.3和10 mmol/L 3个浓度钾干预6 h后,流式细胞术检测结果表明EGFP-WT的阳性细胞百分比和荧光强度均高于EGFP-MT的阳性细胞。通道右侧信号的荧光强度明显高于左侧,越靠右侧荧光强度越高。WT组与MT组间比较,WT组EGFP荧光阳性细胞百分比和荧光强度均高于MT组(P<0.05)。WT组和MT组EGFP荧光阳性细胞百分比均随细胞外钾浓度升高而增多(P<0.01);WT组和MT组GFP荧光强度也随钾浓度升高而增多(P< 0.01)。此外,各不同浓度钾处理组间差异均有统计学意义(P<0.01),见图3、4。
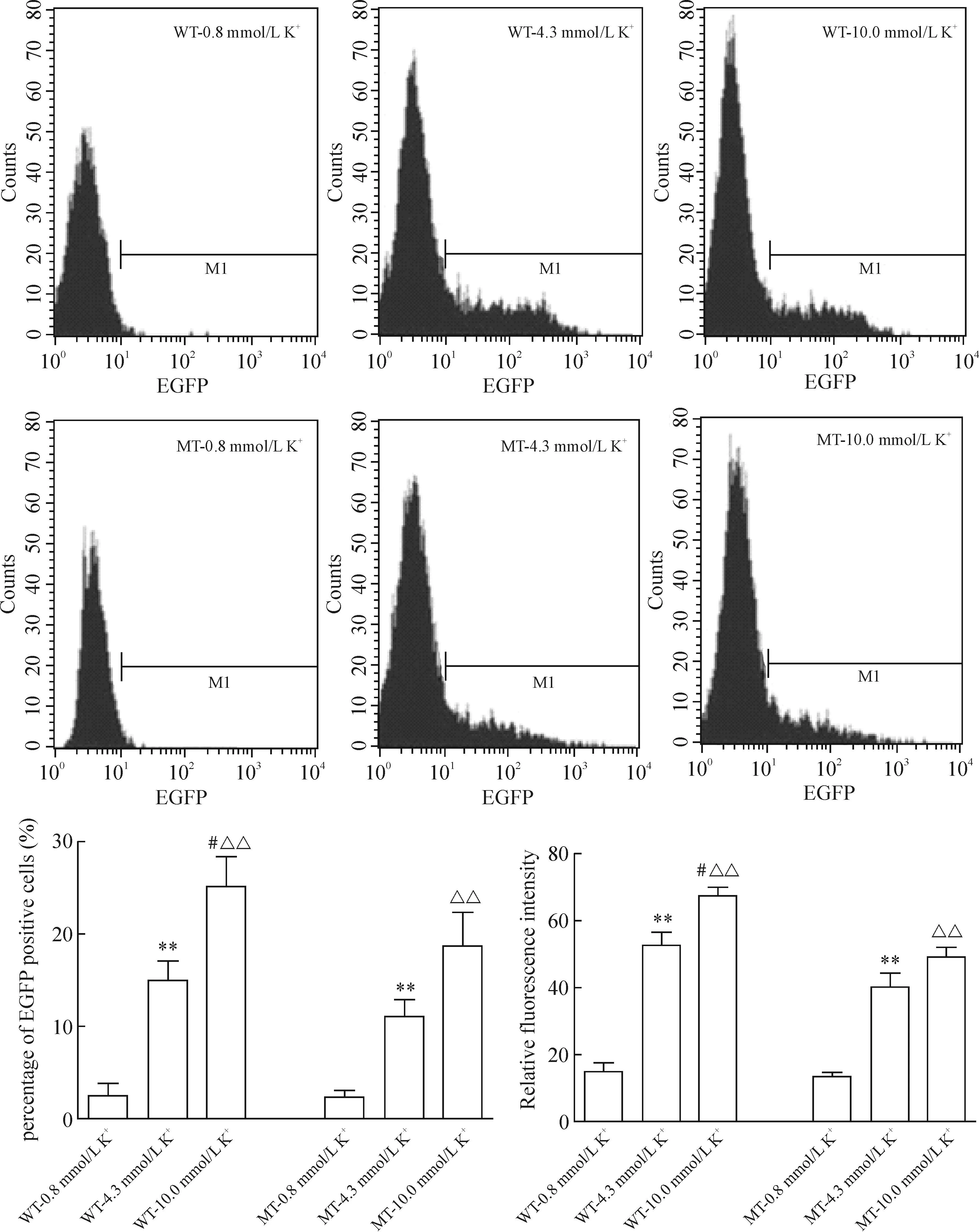
Figure 3.The percentage of positive cells and fluorescence intensity of EGFP-HERG under different concentrations of extracellular potassium detected by flow cytometry. Mean±SD.n=6.#P<0.05vsMT;**P<0.01vs0.8 mmol/L K+;△△P<0.01vs4.3 mmol/L K+.
图3不同细胞外钾浓度下EGFP-HERG阳性细胞百分比和荧光强度的变化
4Western blot实验结果
代表野生型HERG 2次糖基化的155 kD和135 kD条带及代表突变体L539fs/47的60 kD条带在高钾组表达最多。低钾组155 kD及60 kD条带几乎消失,见图4。

Figure 4.HERG protein bands of WT and WT+MT groups under different concentrations of extracellular potassium detected by Western blot. Mean±SD.n=6.*P<0.05vs0.8 mmol/L K+.
图4不同细胞外钾浓度下WT和WT+MT组HERG蛋白的表达
讨论
自从Fisch于1973年首次提出了电解质和心律失常的相关性以来,大量研究发现细胞外低钾与LQT相关。早前发现低钾可诱发85%小鼠产生心肌早期后除极。林加锋等[6]对64例发生室性早搏诱发的恶性快速性室性心律失常患者研究,发现43.8%是由低钾低镁血症伴LQTS诱发;严重低钾血症时,温和的LQTS突变可能表现出临床症状。
ACC、AHA和ESC 2006室性心律失常治疗与心脏猝死预防指南对于药物引起的心律失常建议补钾治疗,将血钾维持4 mmol/L以上(推荐等级Ⅱa、证据等级C)[7]。2010年进一步建议将血钾维持在4.5~5.0 mmol/L左右[8]。补钾提高血清钾水平可能对LQTS患者治疗有益,尤其是在LQT2患者[9]。通过短期及长期[9]补充外源性钾可改善受损的IKr功能,增加外向钾电流和缩短复极,纠正LQT2患者复极时间、QT离散度等心电图异常表现。补钾治疗也可能是对一些获得性LQTS的治疗有效[10]。
既往细胞层面对钾离子与LQT2的研究多集中在快速增加细胞外K+以减少HERG通道的失活,促使可用性通道的数目增加,从而增大电流,近年来还发现生理浓度范围内提高细胞内K+浓度可稳定HERG通道蛋白从内质网输出[11]。而慢性细胞外钾浓度与HERG离子通道蛋白表达时间相关的调控研究甚少。
与Zhang等[12]的研究一致,L539fs/47蛋白可表达于细胞膜,部分滞留于胞浆。与既往研究不同的是,Guo等[13]近年来证实细胞外K+浓度对通道失活的调节作用有限;急性细胞外低钾时,HERG通道进入了一种新的“不导电状态”,不同于电压依赖失活状态及药物阻滞状态。此外,这种不导电状态继而触发细胞表面的钾通道快速向细胞内转运及降解。由于门控状态与HERG通道细胞膜稳定性之间的直接联系,他们首次提出细胞表面的HERG蛋白密度是由细胞外钾调控。进一步研究更为重要的持续低钾对HERG通道的影响揭示,在家兔心脏和人类HEK293细胞系中,0 mol/L的细胞外钾浓度负性控制细胞表面HERG蛋白表达量。共聚焦成像分析表明在向细胞内转运过程中,细胞外低钾促进泛素过度表达,通道蛋白被聚集到溶酶体,HERG蛋白发生降解。恢复细胞外的钾浓度至5 mmol/L,HERG通道的“不导电状态”及向细胞内转运状态均可逆,可以重新获得细胞膜上的功能性通道;而已进入降解程序的通道蛋白无法恢复。
本研究中激光共聚焦成像、流式细胞术及免疫印迹结果均支持细胞外钾浓度是HERG通道功能和膜稳定性的先决条件,细胞外相对高钾可以防止HERG通道进入不导电状态,从而保持蛋白停留在细胞膜。低钾时野生及突变的3个条带表达均较正常钾组明显减少,同慢性低钾促使通道蛋白向细胞内逆向转移及继发降解有关。而高钾时3个条带表达均较正常钾组明显增多,除抑制逆向转运及继发降解外,还可能与高钾稳定HERG蛋白结构并促进前向转运至膜上,避免被降解相关。此外,低钾介导HERG通道蛋白的构像缺陷,阻断HERG转运至细胞膜。如Wang等[11]发现强心甙过夜孵育,通过直接抑制Na+-K+-ATP酶,耗尽细胞内K+,诱发LQTS,而通过渗透作用增加细胞内的K+或 Rb+,可以恢复HERG转运。
细胞外持续低钾促使通道蛋白时间依赖性向细胞内转运,0 mol/L 细胞外钾培养下可在3 h内使HERG完全内化,在4 h内开始降解,12 h降解达峰,使转染野生型HERG的HEK细胞IKr密度降低,电流减少[14]。与此一致,本研究中免疫印迹发现低钾干预12 h后155 kD和60 kD蛋白从细胞膜上向胞浆中转运后充分降解,而低钾干预6 h后流式细胞术显示蛋白部分降解,未达到峰值[14]。
简言之,细胞膜上的通道密度是全细胞电流大小的一个关键性决定因素。本研究通过激光共聚焦成像观察证实HERG大片段无义突变体L539fs/47部分滞留胞浆,部分糖基化后可能与HERG-WT形成异源四聚体,定位于细胞膜上;再通过激光共聚焦成像、流式细胞术和免疫印迹证实,同HERG-WT一样,细胞外相对高钾增强HERG-L539fs/47稳定性,使其在细胞膜分布增多;而慢性低钾干预时间依赖性地减少HERG通道蛋白表达。研究细胞外钾离子相对慢性的调节过程中突变HERG通道的蛋白表达、转运及功能的改变,可能为临床低钾诱发LQT2恶性心律失常的机制研究及治疗提供分子生物学证据。
[参考文献]
[1]Perrin MJ, Subbiah RN, Vandenberg JI, et al. Human ether-a-go-go related gene (hERG) K+channels: function and dysfunction[J]. Prog Biophys Mol Biol, 2008, 98(2-3):137-148.
[2]李翠兰,胡大一,仇晓亮. 遗传性心律失常心肌病:2007研究进展与专家共识[J]. 心血管病学进展, 2008, 29(2):190-197.
[3]李宇,廉姜芳,崔长琮,等. 先天性长QT综合征HERG基因L539fs/47及A561V突变的功能研究[J]. 中华心律失常杂志, 2007, 11(5):383-387.
[4]van der Heyden MA, Smits ME, Vos MA. Drugs and trafficking of ion channels: a new pro-arrhythmic threat on the horizon?[J]. Br J Pharmacol, 2008, 153(3):406-409.
[5]Lü Y, Zhang A, Han W, et al. Construction of recombinant plasmid pEGFP-C2-L539fs/47 and its expression in HEK293 cells[J]. J Med Coll PLA, 2012, 27(3):125-133.
[6]林加锋,陈晓曙,张建华,等. 恶性快速性室性心律失常的发作方式及其临床意义[J]. 中国心脏起搏与心电生理杂志, 2005, 19(2):110-113.
[7]Zipes DP, Camm AJ, Borggrefe M, et al. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: executive summary[J]. Eur Heart J, 2006, 27(17): 2099-2140.
[8]Drew BJ, Ackerman MJ, Funk M, et al. Prevention of torsade de pointes in hospital settings: a scientific statement from the American Heart Association and the American College of Cardiology Foundation endorsed by the American Association of Critical-Care Nurses and the International Society for Computerized Electrocardiology[J]. J Am Coll Cardiol, 2010, 55(9): 934-947.
[9]Etheridge SP, Compton SJ, Tristani-Firouzi M, et al. A new oral therapy for long QT syndrome: long-term oral potassium improves repolarization in patients withHERGmutations[J]. J Am Coll Cardiol, 2003, 42(10):1777-1782.
[10]Choy AM, Lang CC, Chomsky DM, et al. Normalization of acquired QT prolongation in humans by intravenous potassium[J]. Circulation, 1997, 96(7): 2149-2154.
[11]Wang L, Dennis AT, Trieu P, et al. Intracellular potassium stabilizes human ether-a-go-go-related gene channels for export from endoplasmic reticulum[J]. Mol Pharmacol, 2009, 75 (4): 927-937.
[12]Zhang A, Sun C, Zhang L, et al. L539 fs/47, a truncated mutation of human ether-a-go-go-related gene (hERG), decreases hERG ion channel currents in HEK 293 cells[J]. Clin Exp Pharmacol Physiol, 2013, 40(1):28-36.
[13]Guo J, Massaeli H, Xu JM, et al. Extracellular K+concentration controls cell surface density of IKrin rabbit hearts and of the HERG channel in human cell lines[J]. J Clin Invest, 2009, 119(9):2745-2757.
[14]Massaeli H, Guo J, Xu JM, et al. Extracellular K+is a prerequisite for the function and plasma membrane stability of HERG channels[J]. Circ Res, 2010, 106 (6):1072-1082.
(责任编辑: 林白霜, 罗森)
Effects of extracellular potassium on expression ofHERGgene nonsense mutant L539fs/47LÜ Ying1, ZHANG Jun-bo2, LIU Zhong-wei1, ZHANG Aai-feng3, PAN Jun-qiang1, WANG Jun-kui1, PAN Shuo1, HAN Wen-qi2, SUN Chao-feng2
(1TheFirstDepartmentofCardiovascularMedicine,ShanxiProvincialPeople’sHospital,Xi’an710068,China;2DepartmentofCardiovascularMedicine,TheFirstAffiliatedHospital,MedicalCollegeofXi’anJiaotongUniversity,Xi’an710061,China;3DepartmentofCardiovascularMedicine,TheSecondAffiliatedHospital,MedicalCollegeofXi’anJiaotongUniversity,Xi’an710004,China.E-mail:csun1@163.com)
[ABSTRACT]AIM: To study the effects of extracellular potassium on the protein expression of wild- type HERG and its mutant L539fs/47. METHODS: Wild-type HERG (WT) or its mutant HERG-L539fs/47 (MT) were transfected into HEK293 cells for 36 h. The cells were incubated in different media containing 0.8, 4.3 or 10 mmol/L potassium. After 6 h of incubation, the protein expression of HERG was detected by flow cytometry.After 12 h of incubation, the localization and quantity of the proteins were detected by laser confocal imaging and Western blot. RESULTS: Different from the retention of mutant protein in cytoplasm, wild-type HERG protein was mainly distributed in the cell membrane. The 2 proteins both increased with the changes of extracellular potassium. Flow cytometry showed that the fluorescence in the 2 groups both increased with the changes of extracellular potassium (P<0.01). The fluorescence in WT group was significantly higher than that in MT group (P<0.01). Western blot showed that mutant HERG protein included only one 60 kD band, different from the 135 kD and 155 kD bands in wild-type HERG, which were affected by the changes of extracellular potassium (P<0.05). CONCLUSION: The retention of HERG mutant L539fs/47 protein in the cytoplasm is more than wild-type HERG. Chronic high extracellular potassium keeps the stability of wild-type and mutant HERG proteins on the cell membrane. Chronic low potassium reduces the expression of HERG channel proteins in a time-dependent manner.
[KEY WORDS]HERGgene; Nonsense mutation; Extracellular potassium; HEK293 cells
doi:10.3969/j.issn.1000- 4718.2016.02.006
[中图分类号]R541.7; R363
[文献标志码]A
通讯作者△Tel: 029-85323809; E-mail: csun1@163.com
*[基金项目]国家自然科学基金资助项目(No. 30800473)
[收稿日期]2015- 06- 03[修回日期] 2015- 12- 24
[文章编号]1000- 4718(2016)02- 0228- 06

