姜黄素衍生物B06对2型糖尿病大鼠睾酮合成的影响*
林中民, 王 芳, 张泉波, 陈 霖, 陈三妹, 陈国荣△
(1温州医科大学附属第一医院病理科,浙江 温州 325015;2绍兴文理学院医学院,浙江 绍兴 312000)
姜黄素衍生物B06对2型糖尿病大鼠睾酮合成的影响*
林中民1,王芳1,张泉波1,陈霖1,陈三妹2,陈国荣1△
(1温州医科大学附属第一医院病理科,浙江 温州 325015;2绍兴文理学院医学院,浙江 绍兴 312000)
[摘要]目的: 研究姜黄素衍生物B06对2型糖尿病大鼠睾酮合成的影响。方法: 雄性SD大鼠35只,随机均分为正常对照组(C组)、高脂组(H组)、高脂治疗组(HT组)、糖尿病组(D组)和糖尿病治疗组(DT组),后4组高脂喂养4周后,D组及DT组用低剂量链脲佐菌素诱导糖尿病,HT组和DT组用0.2 mg·kg-1·d-1的B06灌胃8周。微量血糖仪测定大鼠血糖浓度;ELISA法测定血胰岛素水平,并计算胰岛素抵抗指数;光镜和电镜观察睾丸形态;放射免疫法测定血睾酮、雌二醇水平;免疫组化检测Leydig细胞的类固醇激素合成急性调节蛋白(StAR)表达;RT-PCR检测睾丸Leydig细胞StAR、胆固醇侧链裂解酶(P450scc)、细胞色素P450 17A1(P450c17)、细胞色素P450芳香化酶(P450arom)、3β-羟基类固醇脱氢酶(HSD)及17β-HSD的mRNA表达水平。结果: H组及D组血糖、胰岛素抵抗指数升高,血清睾酮水平降低,经B06治疗后好转;H组及D组睾丸曲细精管变形,生精细胞脱落,Leydig细胞内线粒体肿胀,内质网减少且扩张,胞核皱缩,染色质稀疏,经B06治疗后病变减轻;D组的StAR蛋白表达减弱,经B06治疗后表达增强;H组及D组Leydig细胞StAR、P450scc mRNA表达降低,经B06治疗后升高,P450c17、P450arom、3β-HSD及17β-HSD mRNA表达未见明显差异。结论: B06可缓解2型糖尿病大鼠睾丸病变,提高血清睾酮水平,这可能与B06改善机体代谢紊乱并上调Leydig细胞StAR及P450scc mRNA表达水平相关。
[关键词]糖尿病; 姜黄素衍生物B06; Leydig细胞; 睾酮; 类固醇激素合成急性调节蛋白
研究指出,男性糖尿病患者常引起性腺机能减退[1],其睾酮分泌水平降低,而雄性体内95%的睾酮由睾丸Leydig细胞合成,故糖尿病患者睾酮水平的降低可能跟睾酮合成过程中的-系列酶密切相关。姜黄素已被证实具有降血糖、降血脂、抗氧化、抗炎等[2]广泛的药理活性,而姜黄素衍生物B06(以下简称B06)去除了不稳定的基团,其是否影响糖尿病睾酮的合成鲜有报道。本研究通过观察B06对高脂饮食及2型糖尿病大鼠睾丸病理形态学及性激素水平变化的影响,检测睾酮合成和信号转导过程中的关键酶基因的表达水平,探讨B06对高脂饮食及糖尿病机体睾酮合成的影响及机制。
材料和方法
1动物
SPF级Sprague-Dawley(SD)雄性大鼠35只,体重160~200 g,由温州医科大学实验动物中心提供。
2主要试剂
姜黄素衍生物B06由温州医科大学药学院梁广教授惠赠;链脲佐菌素购自厦门星隆达化学试剂有限公司;大鼠胰岛素ELISA试剂盒购自上海西唐生物科技有限公司;类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)兔抗多克隆抗体购自Santa Cruz;广谱 II 抗购自北京中杉金桥生物试剂公司;RT试剂盒购自Promega;2×PCR Master Mix购自天根生化科技有限公司;DNA Marker(100 bp-I ladder)购自上海捷瑞生物工程有限公司;Biowest Agarose购自Gene Tech;GoldView I型购自Solarbio;其它生化试剂均为进口分装或国产分析纯。所用引物由上海生工生物工程股份有限公司根据设计合成,见表1。

表1 PCR引物及扩增条件
F: forwad; R: reverse; P450scc: cholesterol side-chain cleavage enzyme; P450c17: cytochrome P450 17A1; P450arom: cytochrome P450 aromatizing enzyme; HSD: hydroxysteroid dehydrogenase.
3主要方法
3.1动物分组及处理雄性SD大鼠35只,随机均分为5组(n=7):正常对照(control, C)组、高脂(high fat, H)组、高脂治疗(high fat treatment, HT)组、糖尿病(diabetes mellitus, D)组和糖尿病治疗(diabetes treatment, DT)组,C组以基础饲料喂养,后4组以高脂饲料喂养。高脂喂养4周后,D组及DT组在禁食12 h后按30 mg/kg的剂量腹腔注射链脲佐菌素(溶于0.1 mmol/L的枸橼酸缓冲液内,配成浓度为6 g/L的溶液,pH 4.0),72 h后尾静脉测血糖,血糖>16.7 mmol/L者视为为糖尿病造模成功,C组、H组及HT组腹腔注射等容积枸橼酸缓冲液。成模后,后4组均继续高脂饲料喂养,HT组及DT组按0.2 mg·kg-1·d-1的剂量灌胃B06(B06溶于1%羧甲基纤维素钠),其余组灌胃等量的1%羧甲基纤维素钠,持续8周。实验第12周末,禁食12 h后用10%水合氯醛麻醉大鼠,股动脉放血处死大鼠,收集血清和睾丸。
3.2血清指标的检测用微量血糖仪测血糖,ELISA法测血胰岛素水平,并计算胰岛素抵抗指数(insulin resistance index,IRI), IRI = glucose×insulin/22.5;放射免疫方法测血清睾酮(testosterone,T)、雌二醇(estradiol,E2)水平。
3.3光镜标本的制备取睾丸组织于Bouin液中固定,常规脱水并石蜡包埋,制成3 μm厚的切片,HE染色后光镜下观察睾丸组织结构。
3.4电镜标本的制备具体步骤见参考文献[3]。
3.5免疫组织化学制成3 μm厚的切片,经脱蜡、水化,3%过氧化氢溶液阻断内源性过氧化物酶10 min,置于0.1 mol/L的枸橼酸缓冲液中高压抗原修复3 min,PBS漂洗3次后用StAR抗体(1∶300)37 ℃孵育1 h,PBS漂洗3次后用 II 抗37 ℃孵育30 min,再次PBS漂洗后DAB显色,苏木素复染封片,光镜下观察并拍照。
3.6RT-PCR采用TRIzol法提取组织总RNA,用NanoDrop 2000超微量分光光度计测定RNA纯度和浓度。参照Promega 逆转录试剂盒实验说明进行逆转录,扩增20 μL的cDNA。采用Tiangen的PCR试剂,反应体系为20 μL,其中cDNA 1 μL,2×PCR Master Mix 10 μL,上游引物1 μL(10 μmol/L),下游引物1 μL(10 μmol/L),ddH2O 7 μL。扩增条件为:94 ℃ 3 min;94 ℃ 30 s;退火30 s(不同引物退火温度及循环数见表1);72 ℃ 60 s;72 ℃ 10 min。然后,取目的基因扩增产物及Marker各5 μL,在2%琼脂糖凝胶上电泳,稳压100 V,30 min后采用化学发光成像系统摄影保存结果,用图像分析软件GelPro32分析各目的基因与内参照S16基因的条带积分光密度(IA)之比。
4统计学处理
用SPSS 19.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD法,方差不齐采用K-W秩和检验,两两比较采用Nemenyi法。以P<0.05为差异有统计学意义。
结果
1B06对血糖、血胰岛素、IRI、T及E2水平的影响
高脂组血糖、血胰岛素及IRI显著高于对照组(P<0.05),血清T显著低于对照组(P<0.01),经B06治疗后,高脂治疗组血糖、血胰岛素及IRI较高脂组显著下降(P<0.01),血清T无明显差异;糖尿病组血糖、IRI及血清E2显著高于对照组(P<0.01),血清T显著低于对照组,经B06治疗后,糖尿病治疗组血糖、血胰岛素、IRI及血清E2较糖尿病组显著下降(P<0.01),血清T显著升高(P<0.01),见表2。
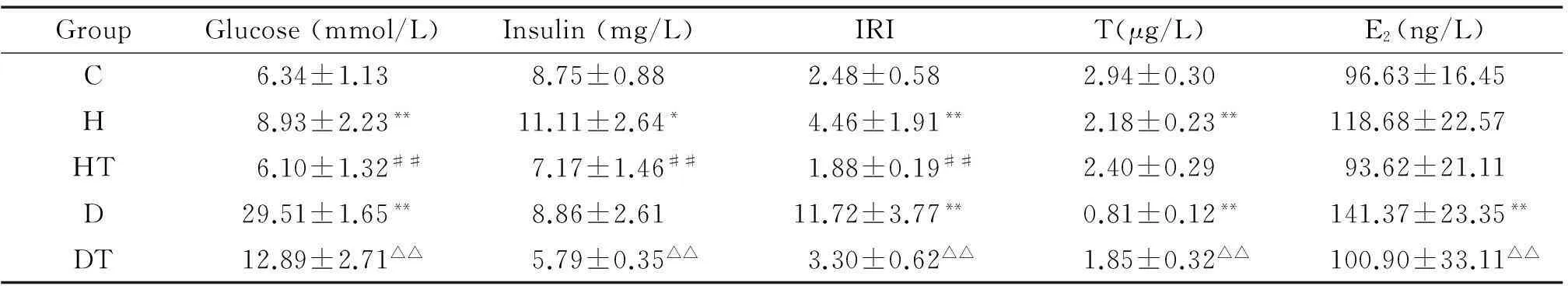
表2 各组大鼠血糖、血胰岛素、IRI、T及E2比较
*P<0.05,**P<0.01vsC group;##P<0.01vsH group;△△P<0.01vsD group.
2光镜观察
睾丸HE染色显示,对照组睾丸曲细精管内各级生精细胞排列规则、紧密。Leydig细胞呈簇状分布在曲细精管间及血管周围,胞质嗜酸性,核仁明显。高脂组睾丸曲细精管变形,生精细胞脱落,排列紊乱。Leydig细胞未见明显变化。高脂治疗组睾丸较高脂组结构改善,生精细胞排列清晰,有序。Leydig细胞分布均匀,未见明显差异。糖尿病组睾丸曲细精管严重萎缩、变形,生精细胞明显减少、空泡变性,甚至脱落阻塞管腔,精子少。间质稀疏,Leydig细胞数量未见明显差异,但细胞缩小,胞核皱缩、淡染。糖尿病治疗组睾丸曲细精管较糖尿病组明显改善,生精细胞增多,排列规则,层次增多,但仍有部分生精细胞排列紊乱,空泡变性。Leydig细胞分布均匀,形态明显改善,见图1。

Figure 1.The structures of rat testes and leyding cells observed under light microscope cells (HE staining) and transmission electron microscope (TEM).
图1光镜下各组大鼠睾丸和电镜下各组大鼠睾丸Leydig细胞的形态结构观察
3透射电镜观察
睾丸Leydig细胞超微结构显示,对照组Leydig细胞胞浆内含丰富的内质网、高尔基复合体及含丰富嵴的线粒体;胞核多呈圆形或椭圆形,染色质分布均匀,核膜清晰,可见核仁。高脂组Leydig细胞主要表现为胞浆内线粒体肿胀,嵴结构模糊不清,内质网减少且扩张;胞核略缩小,核膜增厚,染色质稀疏,核仁不清。高脂治疗组Leydig细胞胞浆内线粒体较丰富,可见固缩,少见嵴模糊,内质网见轻度扩张;核膜微皱缩,染色质分布均匀,核仁清晰。糖尿病组Leydig细胞体积缩小,胞浆内线粒体明显肿胀,嵴模糊不清,内质网减少伴明显扩张;核固缩,核膜周隙变大,染色质严重变稀疏、边集。糖尿病治疗组Leydig细胞胞浆内线粒体丰富,其中有部分肿胀及嵴模糊,内质网轻度扩张;核膜清晰,染色质分布均匀,见图1。
4免疫组织化学法检测StAR蛋白的表达
大鼠睾丸Leydig细胞存在于曲细精管之间的间质中及血管周围,StAR蛋白在Leydig细胞均为胞浆表达阳性。与对照组相比,糖尿病组的StAR表达明显减弱,经B06治疗后,糖尿病治疗组StAR表达增加;对照组、高脂组和高脂治疗组间未见明显差异,见图2。
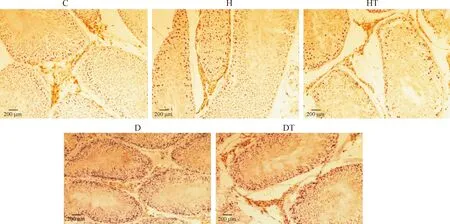
Figure 2.The protein expression of StAR in the Leydig cells(immunohistochemical method).
图2免疫组织化学法观察各组大鼠睾丸Leydig细胞StAR蛋白表达
5B06对Leydig细胞StAR、胆固醇侧链裂解酶(cholesterol side-chain cleavage enzyme, P450scc)、细胞色素P450c 17A1(cytochrome P450c 17A1,P450c17)、细胞色素P450芳香化酶(cytochrome P450 aromatizing enzyme,P450arom)、3β-羟基类固醇脱氢酶(hydroxysteroid dehydrogenase,HSD)及17β-HSD的mRNA表达水平的影响
与对照组相比,高脂组睾丸Leydig细胞StAR的mRNA表达显著降低(P<0.01),P450scc及17β-HSD的mRNA表达显著降低(P<0.05),P450c17、P450arom及3β-HSD的mRNA表达未见显著差异;糖尿病组Leydig细胞StAR、P450scc、3β-HSD及17β-HSD的mRNA表达显著降低(P<0.01),P450c17及P450arom的mRNA表达呈下降趋势,但无统计学显著性。经B06治疗后,高脂治疗组Leydig细胞StAR的mRNA表达较高脂组显著升高(P<0.01),其余基因表达未见明显差异;糖尿病治疗组Leydig细胞StAR和P450scc的mRNA表达较糖尿病组显著升高(P<0.01),3β-HSD及17β-HSD的mRNA表达呈升高趋势,但无统计学显著性,P450c17及P450arom的mRNA表达未见显著差异,见图3、表3。
讨论
2型糖尿病是一组以高血糖和胰岛素抵抗为特征的内分泌代谢性疾病,同时,高脂饮食被认为是诱导胰岛素抵抗及2型糖尿病独立的危险因素。大量研究表明,糖尿病机体生精能力减弱,性功能及生殖能力障碍[4-5],其直接原因与持续高血糖引起的细胞代谢异常、氧化应激及长期的代谢紊乱导致的微血管病变有关[6-7]。而睾酮在促进生精细胞的发生发育、维持性腺结构及功能的完整上起到关键性的作用。本研究中生殖系统损伤的表现主要为睾丸组织损伤,伴有血清睾酮水平的降低,与我们以往的研究结果一致[8]。其中,高脂及糖尿病状态下的睾丸电镜表现主要为Leydig细胞的线粒体肿胀,内质网减少伴扩张,以糖尿病更为严重。
体内95%的睾酮有睾丸Leydig细胞合成和分泌[9],睾酮分泌主要受下丘脑-垂体-睾丸轴调节。下丘脑和腺垂体依次分泌的促性腺激素释放激素和黄体生成素与相应的受体结合,进而激活Leydig细胞内的信号传导途径[10-11]。位于线粒体外膜的StAR是类固醇激素合成的关键调节因子,它将胆固醇从细胞质转运到位于线粒体内膜的P450scc上,同时StAR可加速胆固醇向P450scc的传递,在类固醇生成系列酶的上游发挥作用。而孕烯醇酮被转运出线粒体到滑面内质网后,在3β-HSD、P450c17、17β-HSD催化下,最终生成睾酮。睾酮合成后,可被P450arom部分转化为雌二醇。因此,类固醇生成中最关键的是线粒体内胆固醇向孕烯醇酮的转换[12]。我们的研究中表明了Leydig细胞内的信号转导在高脂及糖尿病机体睾酮合成的过程中可能起到关键作用。其中,高脂状态下主要表现为Leydig细胞StAR、P450scc及17β-HSD的mRNA表达降低,糖尿病状态下主要表现为Leydig细胞StAR、P450scc、3β-HSD及17β-HSD的mRNA表达降低,进而导致睾酮合成下降。

Figure 3.The mRNA expression of rat Leydig cells by RT-PCR.
图3大鼠睾丸Leydig细胞各mRNA的表达
表3各组大鼠睾丸Leydig细胞StAR、P450scc、P450c17、P450arom、3β-HSD和17β-HSD mRNA表达的比较
Table 3.The mRNA expression of StAR, P450scc, P450c17, P450arom, 3β-HSD and 17β-HSD in the rat Leydig cells with different treatments (Mean±SD.n=3)
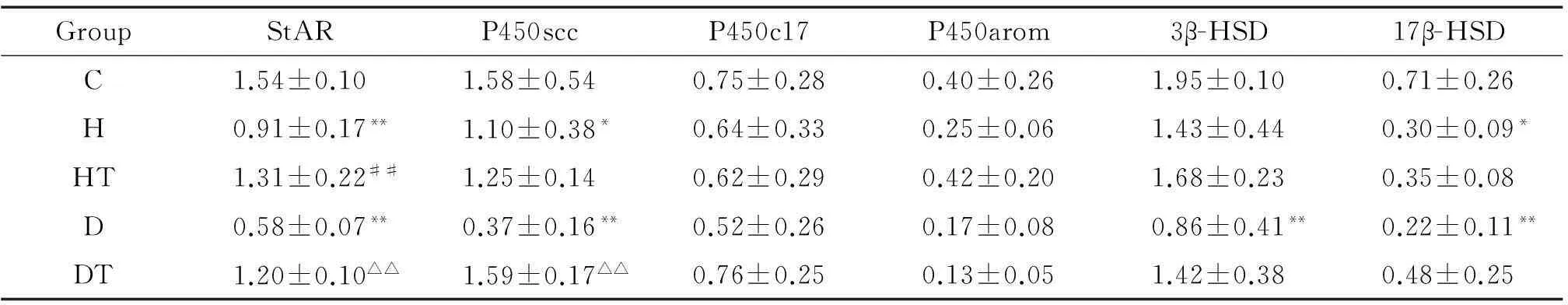
GroupStARP450sccP450c17P450arom3β-HSD17β-HSDC1.54±0.101.58±0.540.75±0.280.40±0.261.95±0.100.71±0.26H0.91±0.17**1.10±0.38*0.64±0.330.25±0.061.43±0.440.30±0.09*HT1.31±0.22##1.25±0.140.62±0.290.42±0.201.68±0.230.35±0.08D0.58±0.07**0.37±0.16**0.52±0.260.17±0.080.86±0.41**0.22±0.11**DT1.20±0.10△△1.59±0.17△△0.76±0.250.13±0.051.42±0.380.48±0.25
*P<0.05,**P<0.01vsC group;##P<0.01vsH group;△△P<0.01vsD group.
相关的资料显示,高脂饮食可引起大鼠营养性肥胖,进而影响大鼠的生精能力和雄激素水平[13]。Premalatha等[14]还指出,组织内睾酮的浓度可作为一个重要的指标来评估类固醇代谢酶的表达活性,而高血糖已被证实能抑制类固醇合成,这与我们的研究中高脂及糖尿病状态下睾酮合成相关基因的表达降低相符。另有丰富的生化、临床和遗传学的证据表明StAR是一个不稳定的蛋白中介[15],是睾酮合成过程中最关键的限速步骤之一,这同样在我们的研究中得到证实,表现为StAR蛋白的表达减弱。
我们以往的研究显示,姜黄素衍生物具有降血糖、降血脂、增加胰岛素敏感性及改善大鼠肝脏纤维化作用[16]。Sahoo等[17]指出姜黄素在睾丸组织的损伤中起增强抗氧化活性及减轻氧化应激的作用,从而保护睾丸结构和功能,并提高睾酮水平。我们的研究显示,姜黄素衍生物B06的治疗可以明显缓解高脂及糖尿病大鼠的代谢紊乱,并改善睾丸的病理病变。同时,B06还能提高Leydig细胞StAR和P450scc的mRNA表达水平,进而显著提高睾酮含量,这可能与B06改善Leydig细胞的线粒体病变相关,在类固醇生成的上游发挥作用。但是,是否由于刺激不足而没有引起3β-HSD、17β-HSD等其它酶的变化,各种酶之间的具体差异及机制,还需要进一步研究。
[参考文献]
[1]Arafa M, Zohdy W, Aboulsoud S, et al. Prevalence of late-onset hypogonadism in men with type 2 diabetes mellitus[J]. Andrologia, 2012, 44(Suppl 1):756-763.
[2]Aggarwal BB, Harikumar KB. Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary,metabolic, autoimmune and neoplastic diseases[J]. Int J Biochem Cell Biol,2009, 41(1):40-59.
[3]吴亮,吴晓烨,王环,等. 2型糖尿病大鼠脑内11-β HSD1和GR的表达与认知功能的关系及棉酚的干预作用[J]. 中国病理生理杂志,2009, 25(7):1336-1341.
[4]刘宏婧,马琳,余建强. 糖尿病所致雄性生殖损伤的研究进展[J]. 宁夏医学杂志,2013,35(1): 72-75.
[5]Janqir RN, Jain GC. Diabetes mellitus induced impairment of male reproductive functions: a review[J]. Curr Diabetes Rev,2014, 10(3):147-157.
[6]Celik O, Yucel S. Testosterone replacement therapy: should it be performed in erectile dysfunction[J]. Nephrourol Mon, 2013, 5(4):858-861.
[7]Jain GC, Jangir RN. Modulation of diabetes-mellitus-induced male reproductive dysfunctions in experimental animal models with medicinal plants[J]. Pharmacogn Rev, 2014, 8(16):113-121.
[8]王文艳,吴亮,牛三强,等. 银杏叶提取物对2型糖尿病大鼠睾酮水平、LHR和StAR mRNA表达的影响[J]. 中国病理生理杂志,2008, 24(5):867-872.
[9]Anbalagan M, Sriraman V, Jagannadha Rao A. Isolation and characterization of Leydig cells from adult bonnet monkeys (Macacaradiata): evidence for low steroidogenic capacity in monkey Leydig cells in contrast to rat Leydig cells[J]. J Endocrinol, 2003, 179(2):175-182.
[10]Payne AH, Hales DB. Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones[J]. Endocr Rev,2004, 25(6): 947-970.
[11]Lo HC, Yang JG, Liu BC, et al. The effects of Tremella aurantia on testosterone and corticosterone productions in normal and diabetic rats[J]. Arch Androl,2004, 50(6):395-404.
[12]Midzak AS, Chen H, Papadopoulos V, et al. Leydig cell aging and the mechanisms of reduced testosterone synthesis[J]. Mol Cell Endocrinol,2009, 299(1):23-31.
[13]Ghanayem BI, Bai R, Kissling GE, et al. Diet-induced obesity in male mice is associated with reduced fertility and potentiation of acrylamide-induced reproductive toxicity[J]. Biol Reprod, 2010, 82(1):96-104.
[14]Premalatha R, Jubendradass R, Rani SJ, et al. A phytooxysterol, 28-homobrassinolide modulates rat testicular steroidogenesis in normal and diabetic rats[J]. Reprod Sci, 2013, 20(5):589-596.
[15]Stocco DM, Wang X, Jo Y, et al. Multiple signaling pathways regulating steroidogenesis and steroidogenic acute regulatory protein expression: more complicated than we thought[J]. Mol Endocrinol, 2005, 19(11):2647-2659.
[16]王玲,徐梦菲,刘曦,等. 姜黄素衍生物B06对2型糖尿病大鼠肝脏的保护作用[J]. 中国病理生理杂志, 2014, 30(2): 328-332, 338.
[17]Sahoo DK, Roy A, Chainy GB. Protective effects of vitamin E and curcumin on L-thyroxine-induced rat testicular oxidative stress[J]. Chem Biol Interact, 2008, 176(2-3):121-128.
(责任编辑: 陈妙玲, 余小慧)
Effect of curcumin derivative B06 Bob on synthesis of testosterone from type 2 diabetic ratsLIN Zhong-min1, WANG Fang1, ZHANG Quan-bo1, CHEN Lin1, CHEN San-mei2, CHEN Guo-rong1
(1DepartmentofPathology,TheFirstAffiliatedHospital,WenzhouMedicalUniversity,Wenzhou325015,China;2MedicalCollege,ShaoxingUniversity,Shaoxing312000,China.E-mail:chengr1978@aliyun.com)
[ABSTRACT]AIM: To investigate the effect of curcumin derivatives B06(B06) on the synthesis of testosterone from type 2 diabetic rats. METHODS: Male Sprague-Dawley rats were evenly divided into 5 groups randomly: normal control group (C group), high fat group (H group), high fat treatment group (HT group), diabetes mellitus group (D group) and diabetes treatment group (DT group). The rats in the later 4 groups were fed with high fat diet, after 4 weeks of high fat diet feeding, the rats from D group and DT group were injected with low dose of streptozotocin intraperitoneally to induce diabetes mellitus, while the rats in HT group and DT group were gavaged with B06 at the dose of 0.2 mg·kg-1·d-1for 8 weeks. The blood glucose was detected by glucometer, blood insulin was assayed by ELISA and the insulin resistance index was calculated. The morphology of testes were observed by light and transmission electron microscopy. Serum testosterone and estradiol were measured by radioimmunoassay. The protein expression of steroidogenic acute regulatory protein (StAR) was detected by immunohistochemistry. The mRNA expression of StAR, cholesterol side-chain cleavage enzyme (P450scc), cytochrome P450 17A1 (P450c17), cytochrome P450 aromatizing enzyme (P450arom), 3β-hydroxysteroid dehydrogenase (HSD) and 17β-HSD was detected by RT-PCR. RESULTS: The levels of blood glucose and insulin resistance index were increased in H group and D group, and serum testosterone was decreased, all of which were reversed after the treatment of B06. Testicular seminiferous tubule was distorted, spermatogenic cells were dropped in H group and D group. In addition, leydig cells were found to have swelling mitochondria in H group and D group, endoplasmic reticulum was reduced, and there was karyopyknosis accompany with sparse chromatin, all of which were ameliorated by B06. The protein expression of StAR was decreased in D group. The mRNA expression of StAR and P450scc was decreased in H group and D group, all of which were increased in B06 treatment group. There was no significant difference in the mRNA expression of P450c17, P450arom, 3β-HSD and 17β-HSD. CONCLUSION: B06 may increase serum testosterone and relieve the damage of testes from type 2 diabetic rats. B06 improves metabolic disorder by up-regulating mRNA expression of StAR and P450scc.
[KEY WORDS]Diabetes mellitus; Curcumin derivative B06; Leydig cells; Testosterone; Steroidogenic acute re-gulatory protein
doi:10.3969/j.issn.1000- 4718.2016.02.027
[中图分类号]R587.1; R363
[文献标志码]A
通讯作者△Tel: 0577-55579795; E-mail: chengr1978@aliyun.com
*[基金项目]浙江省自然科学基金资助项目(No.LY12p6002);浙江省公益性技术应用研究计划项目(No.2011c23123)
[收稿日期]2015- 08- 10[修回日期] 2015- 10- 19
[文章编号]1000- 4718(2016)02- 0352- 07

