窗口技术鉴别纯磨玻璃样密度肺原位腺癌与微浸润腺癌
杨海,李欣,陈盈,郑海红,吴娟,吴海鸰,王官良,谢继承,樊树峰
(台州恩泽医疗中心(集团)恩泽医院,浙江 台州318000)
窗口技术鉴别纯磨玻璃样密度肺原位腺癌与微浸润腺癌
杨海,李欣,陈盈,郑海红,吴娟,吴海鸰,王官良,谢继承,樊树峰*
(台州恩泽医疗中心(集团)恩泽医院,浙江 台州318000)
目的 探讨窗宽调整对表现为纯磨玻璃样密度的肺原位腺癌(AIS)和微浸润腺癌(MIA)的诊断价值,为鉴别诊断提供指导。 方法 回顾性分析表现为纯磨玻璃样密度的肺原位腺癌32例、微浸润腺癌45例的术前资料。固定纵隔窗窗位(40Hu),调节窗宽值至病灶不可见,比较两组病例消失时的窗宽值,并通过ROC曲线确定两组病灶消失时窗宽值的最佳截断点。 结果 原位腺癌与微浸润腺癌的窗宽值不同(Z=-2.796,P<0.05),窗宽值对于原位腺癌与微浸润腺癌的诊断价值较好 (曲线下面积0.688,95%CI 0.571~0.805,P<0.05),967.5Hu为AIS与MIA的最佳窗宽截断点 (敏感度为96.9%,特异性为37.8%)。 结论 窗口技术对于肺原位腺癌和微浸润腺癌的鉴别诊断有一定指导意义。当窗宽值>967.5Hu病灶消失,磨玻璃密度结节为AIS的可能性大;当窗宽值<967.5Hu病灶消失,磨玻璃密度结节为MIA的可能性大。
肺肿瘤;原位腺癌;微浸润腺癌;X线计算机体层摄影术;窗宽值
2011年,美国联合欧洲对肺腺癌进行国际多学科病理分型,将肺腺癌分为∶浸润前病变、微浸润腺癌 (minimally invasive adenocarcinoma,MIA)及浸润性腺癌[1]。浸润前病变分为不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinoma in situ,AIS)。术前准确区分AIS和MIA有重要临床意义。为避免过度治疗,AIS可随访而不急于手术切除,以排除不典型腺瘤样增生或其他良性病变。 MIA需及时手术切除,以防止发展为浸润性癌及远处转移。随着高分辨率CT(HRCT)扫描的应用,以磨玻璃结节(ground-glass nodule,GGN)为主要影像学表现的肺腺癌检出率越来越高。国内外多位学者的研究已经揭示,当GGN病灶内出现实性成分,病灶为MIA或浸润性腺癌的可能性远大于AIS[2-8],而如何鉴别表现为纯磨玻璃样密度的AIS和MIA,则是临床工作中的一大难点。本研究通过观察表现为纯磨玻璃样密度的AIS与MIA病灶不可见时的窗宽值,探讨两者的区别点,为鉴别诊断提供指导。
1 资料与方法
1.1 一般资科 收集本院2014年5月~2016年2月所有经手术病理证实的AIS 36例和MIA 55例的临床和CT资料,排除含实性成分的4例AIS和10例MIA,最后入组表现为纯磨玻璃样密度AIS 32例、MIA 45例。两组在性别、年龄、大小、形态等方面差异均无统计学意义(P>0.05),详见表1。

表1 两组基本特征
1.2 方法
1.2.1 CT检查 所有受检者术前均行高分辨率CT(HRCT)检查,均在宝石能谱CT(High Definition Discovery CT750HD,GE Healthcare)上进行扫描;扫描参数∶螺距0.984,准直宽度32mm×1.25mm,扫描层厚5mm,管电压120kV,自动管电流,FOV 35cm,转速0.6s/r。且均在常规HRCT扫描基础上行靶扫描,螺距0.984,准直宽度32mm×1.25mm,扫描层厚0.625mm,管电压140kV,自动管电流,FOV 20cm,转速0.6s/r。所有结节均行三维重建,重建层厚0.625mm。肺窗窗宽为1500Hu,窗位为-450Hu,纵隔窗窗宽400Hu,窗位40Hu。所有图像均为平扫获得,未注射对比剂。
1.2.2 图像分析 由两位放射科副主任医师采用盲法独立阅片,在3兆像素医疗显示器上固定纵隔窗窗位为40Hu,调节纵隔窗窗宽,辅以多平面重建观察病灶消失时的窗宽值,取两位医师观察结果的平均值,对于结果出入较大的病例共同阅片,直至达成一致结果。
1.3 统计学处理 应用SPSS22.0统计学软件对所得数据进行分析。首先检验方差齐性及是否符合正态分布,若符合正态分布且方差齐则采用成组t检验分析;若方差不齐或非正态分布,则行两独立样本资料的秩和检验,根据结果绘制ROC曲线,通过不同截点曲线下的面积获得敏感性、特异性,选取曲线下面积最大时图中最左上方点所对应的值为最佳截断点。
2 结果
AIS与MIA癌消失时的窗宽值不同,32例AIS消失时的窗宽值最大1486.0Hu,最小851.0Hu,平均(1199.75±169.88)Hu(图1);45例MIA消失时的窗宽值最大 1441.0Hu,最小 637.0Hu,平均(1059.80±222.39)Hu(图2);两组数据不满足正态分布,故采用两独立样本资料比较的秩和检验,AIS与MIA的窗宽值不同(Z=-2.796,P<0.05)。ROC曲线(图3)提示窗宽值对于两者的鉴别诊断价值较好 (曲线下面积 0.688,95%CI 0.571~0.805,P< 0.05),967.5Hu为AIS与MIA的最佳窗宽截断点,此时的敏感度为96.9%,特异性为37.8%,即当窗宽>967.5Hu病灶消失为AIS的可能性大;当窗宽<967.5Hu病灶消失为MIA的可能性大。
3 讨论
支气管肺癌是人类癌症死亡的主要原因之一,发病率呈上升趋势,晚期5年生存率为12%~15%,而早期肺癌手术切除后的5年生存率达70%,因此早期发现小肺癌并作出明确诊断对肺癌的预后有重大意义。根据新的肺腺癌病理分类标准[1],不典型腺瘤样增生、原位腺癌、微浸润腺癌均可表现为磨玻璃样密度影。其中MIA相比AIS更容易出现实性成分[2-8],但对于表现为纯磨玻璃样密度的AIS与MIA却研究甚少,且临床鉴别较为困难。
探究两组同样表现为纯磨玻璃样密度病灶消失时窗宽值差异的原因,从组织病理表现来分析,AIS时期肿瘤细胞最初是沿着原有的肺泡壁架构生长的,肺泡结构未破坏,肿瘤组织内部的结构很均匀,肿瘤细胞的直径约15μm,呈靴钉状单层排列,肺泡间隔增厚非常接近,一般约25~40μm,加上相应的肺泡壁增厚至50~60μm,而肺泡腔的直径约200μm,所以整体上空气含量常在50%~60%,而正常肺组织的空气含量大约是90%,即形成了CT上的磨玻璃样密度,此时CT值会在-650~-500Hu范围;随着肿瘤生长进入MIA阶段,整体肿瘤细胞与肿瘤组织密集度上升,肿瘤性肺泡腔内脱落细胞积聚增多,局部出现空气含量较少的区域,使得肿瘤整体空气含量少于50%,整体CT值常在-500~-350Hu,但大部分不足以掩盖内部的血管,所以仍可表现为磨玻璃样密度;当肿瘤组织的生长超过血供的增加时,供养不足使得肿瘤细胞无法维持细胞结构和功能,从而转变为需氧量很少的纤维组织,在病理组织切片上,可以发现从上皮细胞到典型的纤维细胞完整的形态过渡谱系,即所谓的肿瘤细胞上皮间质转化,纤维组织的形成也会使得MIA整体病灶密度较AIS提高;Suzuki等[9]研究也提示,肺癌内的纤维化程度与病期成正比,而与预后成反比。窗技术是CT检查中不同密度的正常组织或病变的一种显示技术,在相同窗位条件下,调节窗宽大小,密度越大或CT值越高的病变消失时的窗宽越小,反之亦然,因此窗技术可以敏感地反应从AIS发展到MIA的差异。
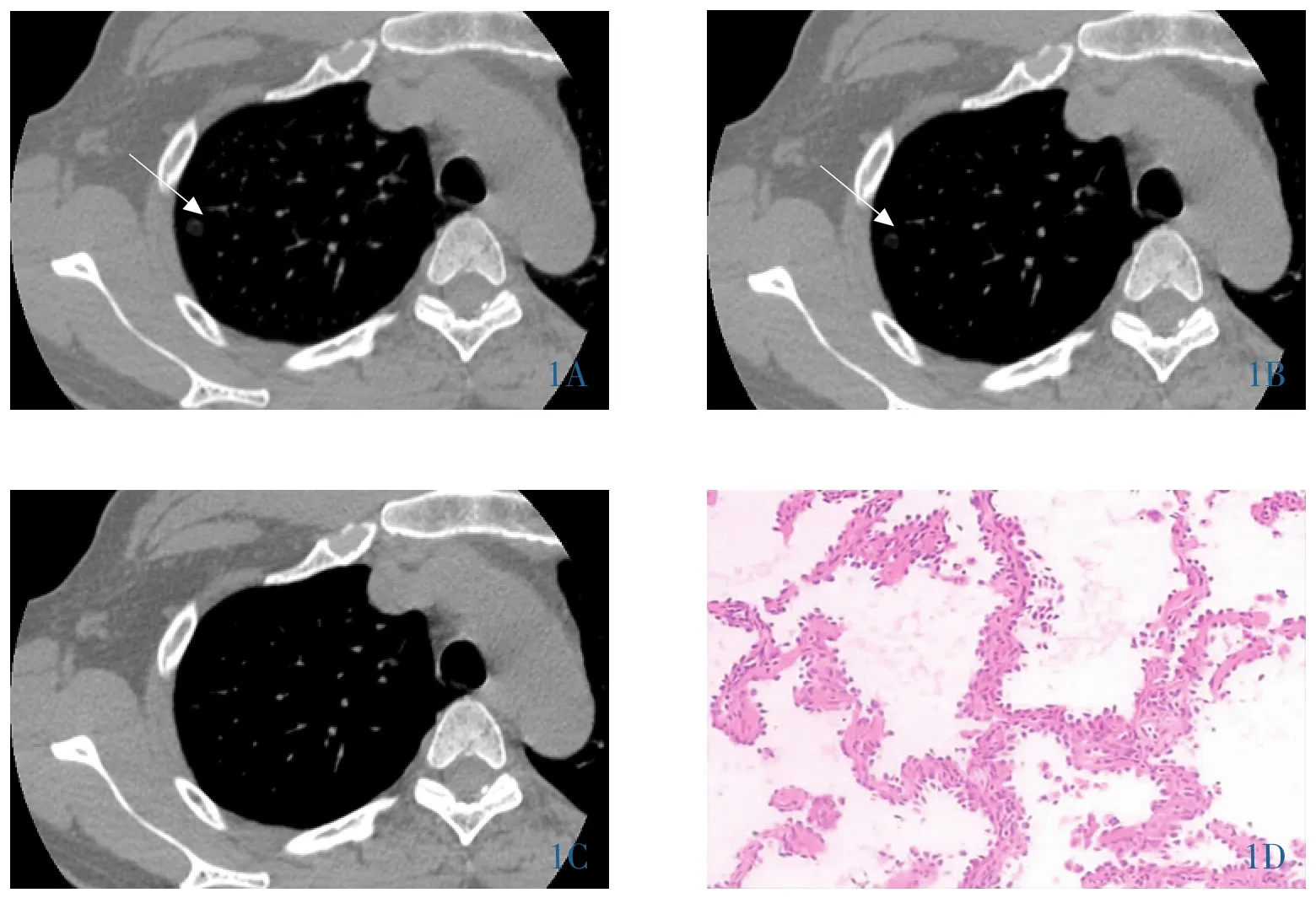
图1 女,51岁,肺原位腺癌。右肺上叶0.6cm纯磨玻璃样密度结节。1A~1C∶依次为肺窗及纵隔窗窗宽为1400Hu、1200Hu、996Hu,病灶逐渐缩小(箭,1A~1B),在纵隔窗窗宽996Hu病灶不可见(1C)。1D∶病理图片示肺泡上皮异型增生,沿肺泡壁生长,无间质浸润(HE,10×10)。
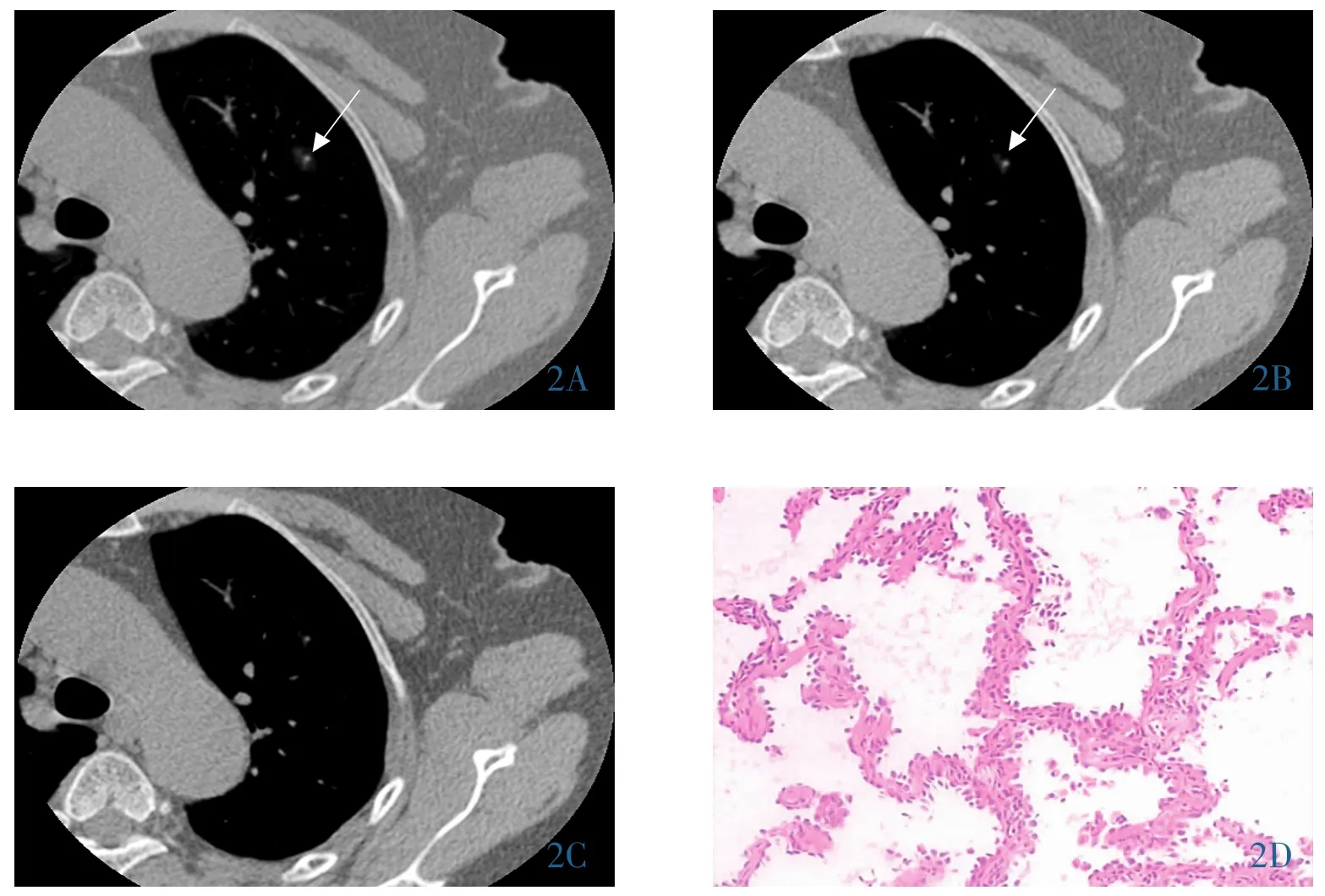
图2 女,69岁,肺微浸润腺癌。左肺上叶0.9cm纯磨玻璃样密度结节。2A~2C∶依次为肺窗及纵隔窗窗宽为1400Hu、1200Hu、928Hu,病灶逐渐缩小(箭,2A~2B),在纵隔窗窗宽928Hu病灶不可见(2C)。2D∶病理图片示肺泡上皮异型增生,沿肺泡壁生长,局灶浸润性生长,腺泡状排列,间质纤维组织增生(HE,10×10)。

图3 窗宽值对原位腺癌与微浸润腺癌诊断的ROC曲线
临床观察某一组织的结构细节时,应该以该组织的CT值为中心进行观察,即应选择合适的窗位。窗宽可以影响图像的对比度。故当用CT测量肺部结节大小时,选择合适的窗宽、窗位很重要,调节纵隔窗的窗宽时,肿瘤大小可以发生变化。为了鉴别同样表现为纯磨玻璃样密度的AIS和MIA,本研究固定纵隔窗窗位40Hu,然后调整窗宽大小,观察两组病灶消失时的窗宽值,在观察过程中所有病例均行多平面重建,尽量排除血管的影响,结果发现表现为纯磨玻璃样密度的AIS与MIA的窗宽值不同 (Z=-2.796,P<0.05);根据结果绘制ROC曲线,结果提示窗宽值对于两者的鉴别诊断价值较好(曲线下面积0.688,95%CI 0.571~0.805,P<0.05),967.5Hu为AIS与MIA的最佳窗宽截断点(敏感度为96.9%,特异性为37.8%),即当窗宽>967.5Hu,病灶消失为AIS的可能性大;当窗宽<967.5Hu,病灶消失为MIA的可能性大。这与毛海霞等[10]研究发现1303Hu为肺腺癌浸润性病变与浸润前病变病灶消失的最佳窗宽截断点有差别,究其原因,文献病例为肺腺癌浸润性病变与浸润前病变,而本研究更细化,探讨表现为纯磨玻璃样密度的原位腺癌和微浸润腺癌之间的区别。
综上所述,作者认为调整纵隔窗窗宽对鉴别纯磨玻璃样密度的AIS和MIA有一定价值,当窗宽>967.5Hu病灶消失,为AIS的可能性大;当窗宽<967.5Hu病灶消失,为MIA的可能性大。在临床工作中,鉴别纯磨玻璃样密度AIS和MIA尚需结合肿瘤边缘等特征综合判断。
[1] Travis WD,Brambilla E,Noguchi M,et al.Intemational association for the study of lung cancer/american thoracic society/european respiratory society international muhidisciplinary classification of lung adenocarcinoma.Thorac Oncol,2011,6(2)∶244
[2] 肖时满,张玉,强金伟,等.超高分辨率CT(UHRCT)鉴别肺原位腺癌(AIS)与微浸润腺癌(MIA).复旦学报,2014,41(3)∶285
[3] Lee KH,Goo JM,Park SJ,et al Correlation between the size of the solid component on thin-section CT and the invasive component on pathology in small lung adenocarcinomas manifesting as ground-glass nodules.J Thorac Oncol,2014,9∶74
[4] Tsutani Y,Miyata Y,Nakayama H,et al.Appropriate sublobar resection choice for ground glass opacity-dominant clinical stage IA lung adenocarcinoma∶ wedge resection or segmentectomy.Chest,2014,145∶66
[5] Lee SM,Park CM,Goo JM,et al.Invasive pulmonary adenocarcinomas versus preinvasive lesions appearing as ground-glass nodules∶differentiation by using CT features. Radiology,2013,268∶265
[6] Naidich DP,Bankier AA,MacMahon H,et al.Recommendations for the management of subsolid pulmonary nodules detected at CT∶a statement from the Fleischner Society.Radiology,2013,266∶304
[7] Lee SM,Park CM,Goo JM,et al.Transcient part-solid nodules at screening thin-section CT for lung cancer∶comparison with persistent part-solid nodules.Radiology,2012,255(1)∶242
[8] Borczuk AC.Assessment of invasion in lung adenocarcinoma classification,including adenocarcinoma in situ and minimally invasive adenocarcinoma.Mod Pathol,2012,25(Suppl 1)∶S1
[9] Suzuki K,Yokose T,Yoshida J,et al.Prognostic significance of the size of central fibrosis in peripheral adenocarcinoma of the lung.Ann Thorac Surg,2000,69(3)∶893
[10]毛海霞,朱慧媛,孙希文,等.窗口技术对肺腺癌磨玻璃影浸润性的诊断价值.中国医学影像学杂志,2015,23(6)∶466
浙江省自然科学基金(LY13H180010);浙江省医药卫生基金(2013KYA223);浙江省台州市科技局A类项目(14SF03)
*为通讯作者,E-mail:Shufeng fan@163.com

