欧前胡素逆转宫颈癌细胞对顺铂的抵抗性及机制研究
方芳,蔡军波,王萍
(台州市立医院,浙江 台州318000)
·实验研究·
欧前胡素逆转宫颈癌细胞对顺铂的抵抗性及机制研究
方芳,蔡军波,王萍
(台州市立医院,浙江 台州318000)
目的 探讨欧前胡素逆转宫颈癌细胞对顺铂抵抗性的机制。 方法 将顺铂耐药Hela细胞(Hela/R细胞)按对照组、欧前胡素组、顺铂组、欧前胡素+顺铂组及欧前胡素+顺铂+Bim siRNA组进行分组后,采用MTT法检测Hela/R的细胞活力,流式细胞术检测Hela/R细胞的凋亡,免疫共沉淀实验检测Hela/R细胞Bim蛋白与Bak及Bax蛋白的相互作用,Western blot实验检测Hela/R细胞色素c的释放和caspase-3的活化。 结果 Hela/R细胞对顺铂的IC50显著高于常规Hela细胞(P<0.05)。欧前胡素处理可诱导Hela/R细胞Bim蛋白的上调及其与Bak、Bax蛋白的相互作用。欧前胡素+顺铂组对Hela/R细胞活力的抑制率和凋亡诱导率显著高于顺铂组和欧前胡素+顺铂+Bim siRNA组。欧前胡素+顺铂组对Hela/R细胞色素c的释放和caspase-3的活化显著高于顺铂组和欧前胡素+顺铂+Bim siRNA组。 结论 欧前胡素通过上调Bim蛋白的表达提高顺铂耐药宫颈癌细胞对顺铂的敏感性。
宫颈癌;顺铂;欧前胡素;Bim;Bak;Bax
化疗是宫颈癌治疗中不可替代的方法,其疗效在很大程度上决定了宫颈癌患者的预后[1]。然而肿瘤细胞对化疗药物的获得性药物抵抗严重影响化疗的效果[2]。本研究的目的在于探讨欧前胡素是否能逆转宫颈癌细胞对顺铂的抵抗性并探讨其机制。
1 材料与方法
1.1 实验材料
1.1.1 试剂 顺铂、欧前胡素、噻唑蓝 [3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT],凋亡检测试剂盒购于美国Sigma-Aldrich。蛋白G免疫共沉淀琼脂糖珠购于美国Santa Cruz。Bim、Bak、Bax、细胞色素c、活化caspase-3和β-actin抗体购于美国Cell Signaling公司。ECL试剂盒购于美国Pierce公司。细胞线粒体分离试剂盒购于江苏碧云天生物科技有限公司。Bim siRNA购于广州锐博生物科技有限公司。Lipofectamine 2000购于美国Invitrogen公司。
1.1.2 细胞培养 本研究从2014年8月~2016年 6月完成于本院实验室。人宫颈癌细胞系Hela购于美国ATCC(美国模式菌种收集中心)。细胞培养在含10%胎牛血清的DMEM培养基中,37°C恒温培养箱中培养并通入5%CO2。细胞每2~3天传代1次,传代时用胰酶消化液使细胞进入悬浮状态并用DMEM培养基洗涤2次,将细胞悬液按1∶3稀释后传代。顺铂耐药Hela(Hela/R)细胞用顺铂梯度处理法进行诱导构建,简要步骤如下∶将常规Hela细胞用含0.5μmol/L顺铂的培养基培养3个月,之后每3周将顺铂浓度提高0.1μmol/L,最终使Hela细胞稳定培养在含1.5μmol/L顺铂的培养基中。
1.2 实验方法
1.2.1 顺铂半数有效浓度(IC50)测定 将常规Hela或Hela/R细胞按5×103/孔接种在96孔板上孵育过夜,分为常规Hela细胞组和Hela/R细胞组,将两组细胞用不同浓度的顺铂处理48小时后进行MTT实验并绘制细胞活力-顺铂浓度曲线,根据曲线计算顺铂对常规Hela细胞和Hela/R细胞的IC50。
1.2.2 MTT实验 将Hela/R细胞按5×103/孔接种在96孔板上孵育过夜,使细胞贴壁。实验分为对照组、欧前胡素组、顺铂组、欧前胡素+顺铂组及欧前胡素+顺铂+Bim siRNA组,分组培养方法详见表1,药物处理时间为48小时。药物处理完毕后进行MTT试验,步骤如下∶在经过药物处理的Hela/ R细胞培养体系中加入5mg/mL MTT 20μL培养4小时,弃上清,往孔中加入150μL二甲亚砜,在570nm波长下用酶标仪检测OD值,细胞活力抑制率用以下公式计算∶抑制率=(OD对照组-OD药物处理组)/OD对照组×100%。

表1 Hela/R细胞实验分组方法
1.2.3 细胞凋亡实验 将Hela/R细胞按上述要求分组处理,之后按照凋亡试剂盒说明书步骤将碘化丙啶 (PI)和Annexin-V加入细胞中孵育20分钟,采用流式细胞术检测肿瘤细胞的凋亡,凋亡率用Annexin-V阳性细胞数占总细胞数的百分比表示。
1.2.4 免疫共沉淀 各组细胞用细胞裂解液裂解,裂解产物在12000转/min下离心15分钟,取上清液,分成等量2份。1份上清液用于检测βactin的表达作为对照,另1份上清液在其中加入Bim抗体孵育过夜后加入蛋白G琼脂糖珠孵育2小时。将Bim抗体孵育后的产物在1200转/min低速下离心5分钟,小心吸去上清液留取琼脂糖珠。琼脂糖珠用细胞裂解液重悬后进行Western blot实验用于检测Bim与Bak及Bax蛋白的相互作用。
1.2.5 线粒体分离 将Hela/R细胞按上述要求分组处理,之后用细胞线粒体分离试剂盒将肿瘤细胞的线粒体分离出来,细胞质进行Western blot实验用于检测细胞色素c的释放。
1.2.6 Western blot实验 将Hela/R细胞按上述要求分组处理,之后将细胞用细胞裂解液进行裂解,裂解产物在12000转/min下离心15分钟,提取总蛋白质进行Western blot实验 (免疫共沉淀产物或线粒体分离试剂盒分离出的细胞质可直接进行后续实验)。将样品用12.5%SDS-PAGE进行电泳分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用Bim、Bak、Bax、细胞色素c、活化caspase-3和β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2小时,蛋白条带用ECL试剂盒显色发光。
2 结果
2.1 欧前胡素抑制Hela/R细胞对顺铂的抵抗性测定常规Hela细胞Hela/R细胞对顺铂的敏感性,结果显示顺铂对Hela/R细胞的IC50显著高于常规Hela细胞,分别为(43.6±3.2)μmol/L和(5.7±0.5)μmol/L(P<0.05)。另外,实验结果显示联合欧前胡素处理后,顺铂对Hela/R细胞的活力抑制率和凋亡诱导率都显著提高 (表2)。Western blot实验结果显示欧前胡素处理能显著上调Hela/R细胞Bim蛋白的表达水平,而顺铂处理对Bim无影响,详见图1。同时,当用Bim siRNA阻断Bim蛋白的上调后,欧前胡素对顺铂的协同抗肿瘤效应受到明显抑制(表2),表明欧前胡素提高耐药宫颈癌细胞对顺铂敏感性的机制和Bim蛋白的上调有关。
表2 欧前胡素提高顺铂对Hela/R细胞的抗肿瘤活性()

表2 欧前胡素提高顺铂对Hela/R细胞的抗肿瘤活性()
与对照组比较*P<0.05,与顺铂组比较△P<0.05,与欧前胡素+顺铂组比较▲P<0.05
组别 n/孔 细胞活力抑制率(%) 凋亡诱导率(%)对照组 3 0 1.8±0.2欧前胡素组 3 7.6±0.6 4.6±0.3顺铂组 3 13.2±1.1*9.4±0.5*欧前胡素+顺铂组 3 58.5±4.2△35.8±2.7△欧前胡素+顺铂+ Bim siRNA组 3 20.8±1.9▲12.6±1.2▲

图1 欧前胡素上调Hela/R细胞Bim蛋白的表达水平
2.2 欧前胡素促进Bim蛋白与Bak、Bax蛋白的相互作用 免疫共沉淀结果显示,Hela/R细胞在经过欧前胡素处理后,与Bim蛋白结合的Bak、Bax蛋白水平显著提高,详见图2。

图2 Bim蛋白免疫共沉淀
2.3 欧前胡素联合顺铂诱导Hela/R细胞色素c的释放和caspase-3的活化 Western blot结果显示欧前胡素联合顺铂处理后,Hela/R细胞色素c的释放和caspase-3的活化显著提高,详见图3。
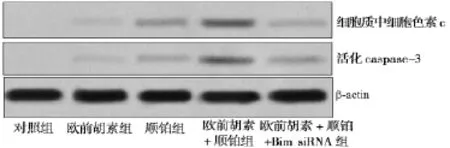
图3 Hela/R细胞色素c的释放和caspase-3的活化
3 讨论
顺铂是治疗宫颈癌的重要化疗药物,能与细胞中的DNA发生结合从而抑制肿瘤细胞DNA的合成,诱导细胞发生凋亡[3]。但重复给药可能造成宫颈癌细胞的获得性药物抵抗,从而降低化疗的效果。因此通过辅助治疗手段提高宫颈癌细胞对顺铂的敏感性,减弱获得性药物抵抗是提高顺铂疗效的途径。欧前胡素是从白芷根中提取的香豆素类天然活性物质,据报道有一定的抗肿瘤效应[4]。然而,欧前胡素是否对已产生获得性顺铂耐药的宫颈癌细胞有药物增敏效应至今还未见报道。本研究表明,已产生获得性顺铂耐药的宫颈癌细胞对顺铂高度耐药,然而在使用顺铂的同时联合应用欧前胡素后,顺铂耐药的宫颈癌细胞发生了显著的凋亡,表明欧前胡素能提高顺铂耐药宫颈癌细胞对顺铂的敏感性,是良好的辅助治疗药物。
Bim是一种Bcl-2促凋亡蛋白家族成员,主要分布在线粒体的外膜,参与线粒体膜孔道的调节[5]。文献报道[6]Bim的表达水平与肿瘤细胞对药物的敏感性高度相关,Bim基因的沉默可导致肿瘤细胞凋亡通路的失敏和药物疗效的下降。本研究证实欧前胡素能通过上调顺铂耐药宫颈癌细胞中Bim蛋白的表达而增强顺铂对该耐药肿瘤细胞的杀伤活性,这与文献报道[6]一致。当用小干扰RNA抑制Bim基因的表达后,欧前胡素的协同抗肿瘤效应明显减弱,表明欧前胡素发挥作用的机制可能和Bim蛋白的上调有关。
线粒体途径的凋亡是多种化疗药物发挥抗肿瘤效应的机制,主要由Bcl-2蛋白家族进行调节[7]。Bim蛋白在肿瘤细胞中能与Bak和Bax蛋白发生相互作用,从而发生活化并导致蛋白构象的变化。在DNA损伤等凋亡信号下,活化的Bak和Bax能在线粒体外膜表面形成通透性外膜孔道,使线粒体中的细胞色素c释放到细胞质中,从而激活caspase-3,使细胞最终发生凋亡性死亡[8-9]。本研究的实验结果表明,欧前胡素可以通过上调Bim蛋白的表达,促进其与Bak、Bax蛋白的相互作用, 发生活化,从而使顺铂耐药的宫颈癌细胞在顺铂作用下打开线粒体的通透性膜孔道,释放其中的细胞色素c,最终诱导caspases依赖的凋亡[10]。
综上所述,本研究证明了欧前胡素能显著提高耐药宫颈癌细胞对顺铂的敏感性并能通过Bim-Bak/Bax途径,诱导耐药宫颈癌细胞在顺铂作用下发生线粒体途径的凋亡,这些研究为逆转宫颈癌的化疗耐药提供了新的思路和理论依据。
[1] de Azevedo CR,Thuler LC,Ferreira CG,et al.Neoadjuvant Chemotherapy Followed by Chemoradiation in Cervical Carcinoma∶A Review.Int J Gynecol Cancer,2016,26(4)∶729
[2] Jin YZ, Pei CZ, Wen LY.FLNA is a predictor of chemoresistance and poor survivalin cervicalcancer. Biomark Med,2016,10(7)∶711
[3] Wang Y,Gao Y,Tan W,et al.Stanniocalcin 2 promotes cell proliferation and cisplatin resistance in cervical cancer. Biochem Biophys Res Commun,2015,466(3)∶362
[4] Thanh PN,Jin W,Song G,et al.Cytotoxic coumarins from the root of Angelica dahurica.Arch Pharm Res,2004,27(12)∶1211
[5] Wang X,He X,Lu C,et al.Involvement of Bim in Photofrin-mediated photodynamically induced apoptosis.Cell Physiol Biochem,2015,35(4)∶1527
[6] Wu D,Chen B,WangM,etal.Hypoxia-induced microRNA-301b regulates apoptosis by targeting Bim in lung cancer.Cell Prolif,2016,49(4)∶476
[7] De Graaff MA,De Rooij MA,Bovée JV,et al.Inhibition of Bcl-2 family members sensitises soft tissue leiomyosarcomas to chemotherapy.Br J Cancer,2016,114(11)∶1219
[8] Han CR,Jun do Y,Kim YH,et al.Prometaphase arrestdependent phosphorylation of Bcl-2 and Bim reduces the association of Bcl-2 with Bak or Bim,provoking Bak activation and mitochondrial apoptosis in nocodazole-treated Jurkat T cells.Apoptosis,2014,19(1)∶224
[9] Chen YT,Song XC,Liang M,et al.Expression of Bim,Bax and Bak in the process of gingipain-induced osteoblast apoptosis.Zhonghua Kou Qiang Yi Xue Za Zhi,2013,48(5)∶272
[10]Zhao J,Wang J,Wu J.Roles of cytochrome c,caspase-9,and caspase-3 inpentavalent vanadium-induced neuronal apoptosis. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi,2014,32(9)∶664

