血清miRNA-744检测在胃癌诊断中的意义
蒋晓婷,夏英捷
(浙江省人民医院,浙江 杭州310014)
·临床研究·
血清miRNA-744检测在胃癌诊断中的意义
蒋晓婷,夏英捷
(浙江省人民医院,浙江 杭州310014)
目的 探讨检测血清miR-744水平在胃癌诊治中的作用。 方法 以2008年1月至2010年12月在浙江省人民医院接受手术的胃癌患者219例为研究对象,另选取160例健康体检者作为对照组。采用qRT-PCR方法检测血清miR-744的表达量、电化学发光法测定血清CEA和CA19-9水平,比较胃癌患者与健康体检者血清miR-744、CEA和CA19-9水平差异,分析miR-744表达与胃癌临床病理及预后的关系,并就miR-744水平对胃癌的诊断意义行ROC曲线分析。 结果 胃癌患者血清miR-744表达量明显高于健康体检者(P<0.001),其表达与胃癌的肿瘤大小、浸润深度、分化程度、TNM分期以及预后相关。ROC曲线分析表明,miR-744以表达量3.5为临界值时,对胃癌的诊断敏感性为86.9%,特异性为64.0%,曲线下面积0.762。术后监测表明,胃癌根治性切除术后血清miR-744下降。结论 血清miR-744是一个潜在的胃癌血清标志物,对胃癌的诊断和随访具有临床意义。
miRNA-744;胃癌;诊断;随访
胃癌是全球范围内常见的恶性肿瘤之一,居各种恶性肿瘤死因的第二位。迄今为止,尚未找到对胃癌诊治灵敏度和特异性均较为理想的标志物。传统肿瘤标志物如CEA、CA19-9、CA125、CA72-4等在胃癌诊断中的灵敏度约为10%~40%,特异性也不高,而且各种肿瘤标志物在病程分析、治疗指导、监测复发或转移、判断预后等方面也不能满足临床需要。因此,寻找体液尤其是血液中胃癌特异性标志物是胃癌研究工作的重点之一。microRNA是一类长度约为22个核苷酸的内源性非编码小分子RNA,能通过与靶mRNA 3'端非编码区完全或部分互补结合引起靶mRNA降解或抑制其翻译,从而对靶基因进行转录后调控[1]。MicroRNA涉及一系列生物过程包括细胞增殖、分化和凋亡等[2]。microRNA作为癌基因或抑癌基因在肿瘤形成中扮演着重要作用[3-4]。本研究采用荧光定量PCR对胃癌患者及健康体检者的血清miR-744水平进行比较,分析血清miR-744对胃癌诊断、术后随访及预后评估的意义。
1 资料与方法
1.1 一般资料 选择2008年1月~2010年12月浙江省人民医院219例胃癌患者的临床资料。所有患者术前均未接受化疗和放疗,其中男144例,女75例,年龄35~82岁,平均(52.1±12.6)岁。依据组织分化程度分为高中分化癌97例,低分化及未分化癌122例;按照国际抗癌联盟(UICC)2010版关于TNM分期进行分期∶Ⅰ期29例,Ⅱ期53例,Ⅲ期91例,Ⅳ期46例;T1~T2期71例,T3~T4期148例;发生淋巴结转移150例,远处转移31例。同期采集160例体检健康者作为对照组,对照组均无肿瘤病史和肿瘤家族遗传史。
1.2 方法 采集研究对象静脉全血于抗凝管中,1小时内,4℃,离心(2000×g)10分钟后,取上清液分为2份∶1份至无RNA酶的试管中,4℃,再次离心(2000×g)10分钟,然后吸取上清液至无RNA酶的试管中,-80℃保存;1份当日行CEA和CA19-9测定。所有胃癌患者于术前采血,其中部分Ⅰ~Ⅲ期患者于术后1周、2周、1个月、3个月和6个月接受连续检测。
1.2.1 qRT-PCR检测血清miR-744水平 (1)RNA提取及质检。取300μL血浆,按照MirVana PARIS试剂盒(美国Ambion公司)说明提取总RNA,紫外分光光度仪测定RNA浓度和纯度,琼脂糖凝胶电泳分析提取质量。(2)逆转录反应。按照TaqMan microRNA Assays(美国Applied Biosystems公司)说明书操作,将样品RNA逆转录成cDNA(其中引物及探针序列由Applied Biosystems提供)。(3)PCR反应。以cDNA为模板,使用TaqMan microRNA Assays中的PCR引物探针混合液进行PCR扩增及荧光定量检测,反应体系包括TaqMan2×通用的PCR扩增预混试剂10μL、无核酸酶水7.67μL、PCR引物(20×)1.0μL及逆转录产物(1∶15)1.33μL,共40个循环,实验重复3次。RNU6B作为内参。2-△CT法计算miRNA相对表达水平。
1.2.2 CEA和CA19-9水平测定 采用生物素化的单克隆抗体与钌物质标记的特异性单克隆抗体双抗体夹心法进行检测,检测仪器为罗氏公司COBAS 8000-e602电化学发光免疫分析仪,具体操作按说明书进行。CEA正常值小于5.0μg/L,CA19-9正常值小于37 U/mL。
1.3 统计学处理 应用SPSS13.0统计软件进行分析。计量资料以()表示,采用独立样本t检验,采用χ2检验评估miR-744表达与胃癌临床病理及预后之间的关系,生存率比较采用Kaplan-Meier法并作log-rank检验。患者术后接受定期随访,随访截至2016年1月。
2 结果
2.1 血清miR-744的表达 胃癌患者血清中miR-744相对表达量为4.47±3.20,明显高于正常对照组的1.80±1.04(P<0.01)。采用(x±2s)确定160例对照组血清miR-744的相对表达量cut-off值为3.5,在219例胃癌中,有92例血清miR-744高于此cut-off值,阳性率为42.0%(92/129),而对照组阳性率为 13.1%(21/160),两组阳性率差异具有统计学意义(P<0.01)。对血清miR-744检测在胃癌组及对照组的ROC曲线分析显示,ROC曲线下面积为0.762,敏感性86.9%,特异性64.0%,提示血清miR-744测定能较准确地区别胃癌与正常对照者(图1)。
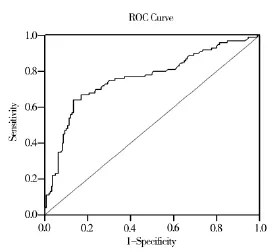
图1 胃癌组和对照组血清miR-744检测的ROC曲线
2.2 血清miR-744表达与临床病理特征的关系以正常人血清miR-744相对表达量cut-off值3.5为标准,将219例胃癌按血清miR-744相对表达量分为高表达组(≥3.5)和低表达组(<3.5),结果提示,血清miR-744表达水平与胃癌的肿瘤大小、分化程度、浸润深度及TNM分期有关系,详见表1。

表1 血清miR-744表达水平与胃癌临床病理特征之间的关系
2.3 血清miR-744相对表达量与胃癌预后的关系血清miR-744相对表达量≥3.5的胃癌患者5年生存率为20.7%(19/92),而miR-744相对表达量<3.5的患者5年生存率为43.3%(55/127),两组生存率差异有统计学意义(P<0.01),详见图3。

图3 血清miR-744高表达和低表达胃癌生存曲线
2.4 不同分期胃癌血清中miR-744、CEA与CA19-9以miR-744相对表达量≥3.5 (正常人cut-off为3.5)、CEA和CA19-9高于正常值 (CEA>5.0μg/L、CA19-9>37U/mL)为标准,对219例胃癌中miR-744、CEA和CA19-9升高的病例进行比较。结果提示,除Ⅰ期miR-744阳性率和CA19-9阳性率差异无统计学意义外,其余各期胃癌中miR-744阳性率均高于CEA和CA199,差异均有统计学意义(均P<0.01)。详见表2。

表2 血清miR-744、CEA、CA19-9与胃癌分期关系(%)
3 讨论
miR-744定位于染色体17p12。组织学水平研究已证明,miR-744在头颈部癌、前列腺癌和鼻咽癌中异常高表达[5-7],而在肝癌中低表达[8]。在血清学水平,Miyamae等[9]报道,血清miR-744可用于胰腺癌的早期筛查、术后复发监测、预期预后及是否对吉西他滨化疗抵抗等。miRNA在胃癌中异常表达,且体内、外多个研究已证明miRNA在胃癌的形成中有不可或缺的作用[10-11]。Song等[12]对胃癌患者血浆中上调的16种miRNAs研究发现,miR-221、miR-376c和miR-744具有潜在的诊断早期胃癌的价值,且它们在分化差的胃癌中表达水平更高。
本研究提示,miR-744在胃癌患者外周血中的表达量明显高于体检健康者;ROC曲线分析也表明,血清miR-744测定能较准确地诊断胃癌,结果与Song[12]报道一致,ROC曲线下面积为0.762,敏感性为86.9%,特异性为64.0%。另外,本组结果提示,血清miR-744表达水平与胃癌的肿瘤大小、分化程度、浸润深度及TNM分期有关系。作者还对血清miR-744、CEA和CA19-9在不同TNM分期胃癌中的阳性率进行了比较,发现胃癌患者中血清miR-744阳性率基本高于CEA和CA19-9,除Ⅰ期miR-744阳性率和CA19-9阳性率差异无统计学意义外。故miR-744对胃癌的发现要优于CEA和CA19-9。
为明确血清miR-744与胃癌预后的关系,本研究对胃癌患者的随访发现,血清miR-744高表达患者5年生存率明显低于miR-744低表达者(P<0.01),对手术切除后的胃癌患者血清miR-744连续监测显示,术前miR-744水平高的患者,肿瘤切除后其水平也随之降低;而术后miR-744水平再度升高时,则大多有肿瘤复发或转移发生,提示miR-744水平可能与肿瘤负荷相关,监测其变化可评估胃癌的病期及预后。
对miR-744分子功能的研究表明,在不同类型的肿瘤中,miR-744的作用并不相同。miR-744通过过表达cyclin-B1促进前列腺癌细胞增殖[7],通过与ARHGAP5的直接作用对鼻咽癌细胞发挥增殖效能[6]。而在乳腺癌中,miR-744则通过下调eEF1A2抑制肿瘤细胞增殖,发挥肿瘤抑制作用[13]。有关miR-744对胃癌细胞生物学行为影响及其机制有待进一步研究。
[1] Ma YY,Tao HQ.Microribonucleic acids and gastric cancer. Cancer Sci,2012,103(4)∶620
[2] Bartel DP.MicroRNAs∶genomics,biogenesis,mechanism,and function.Cell,2004,116(2)∶281
[3] Iorio MV,Croce CM.MicroRNAs in cancer∶small molecules with a huge impact.J Clin Oncol,2009,27(34)∶5848
[4] Iorio MV,Croce CM.MicroRNA dysregulation in cancer∶diagnostics,monitoring and therapeutics.A comprehensive review.EMBO Mol Med,2012,4(3)∶143
[5] Nurul-Syakima AM,Yoke Kqueen C,Sabariah AR,et al. DifferentialmicroRNA expression and identification of putative miRNA targets and pathways in head and neck cancers.Int J Mol Med,2011,28(3)∶327
[6] Fang Y,Zhu X,Wang J,et al.MiR-744 functions as a protooncogene in nasopharyngealcarcinoma progression and metastasis via transcriptional control of ARHGAP5. Oncotarget,2015,6(15)∶13164
[7] Huang V,Place RF,Portnoy V,et al.Upregulation of Cyclin B1 by miRNA and its implications in cancer.Nucleic Acids Res,2012,40(4)∶695
[8]Tan YL,Bai ZG,Zou WL,et al.miR-744 is a potential prognostic marker in patients with hepatocellular carcinoma. Clinics and Research in Hepatology and Gastroenterology,2015,39(3)∶359
[9] Miyamae M,Komatsu S,Ichikawa D.Plasma microRNA profiles∶identification of miR-744 as a novel diagnostic and prognostic biomarker in pancreatic cancer.Br J Cancer,2015,113(10)∶1467
[10]Tsai MM,Wang CS,Tsai CY,et al.Circulating microRNA-196a/b are novelbiomarkersassociated with metastatic gastric cancer.Eur J Cancer,2016,64∶137
[11]Tang R,Yang C,Ma X,et al.MiR-let-7a inhibits cell proliferation,migration,and invasion by down-regulating PKM2 ingastric cancer.Oncotarget,2016,7(5)∶5972
[12]SongMY,PanKF,SuHJ,etal.Identificationofserum microRNAs as novel non-invasive biomarkers for early detection of gastric cancer.PLoS One,2012,7(3)∶e33608
[13]Vislovukh A,Kratassiouk G,Porto E,et al.Proto-oncogenic isoform A2 of eukaryotic translation elongation factor eEF1 is a target of miR-663 and miR-744.Br J Cancer,2013,108(11)∶2304

