血液透析患者并发肺动脉高压时缺氧诱导因子-1α的水平
王启鹏 董 洪 刘建香 孟 琛 张丽红 贾国瑜
(天津市第四中心医院血透室,天津 300140)
血液透析患者并发肺动脉高压时缺氧诱导因子-1α的水平
王启鹏董洪刘建香孟琛张丽红贾国瑜1
(天津市第四中心医院血透室,天津300140)
摘要〔〕目的观察维持性血液透析(MHD)患者并发肺动脉高压(PAH)时的缺氧诱导因子(HIF)-1α的水平。方法筛选MHD患者138例,采用心脏超声方法检查患者的肺动脉压力、心脏结构和功能,根据肺动脉收缩压(PASP)分为PAH组和非PAH组,收集同期基本资料,检测血液生化指标及HIF-1α、内皮素(ET)-1、人不对称二甲基精氨酸(ADMA)等实验室检查结果。结果合并PAH患者共52例,患病率为37.68%。PAH组血红蛋白(Hb)低于非PAH组,HIF-1α、ET-1、ADMA等数值均大于非PAH组(P<0.05);PAH组左心房内径(LAD)、间隔舒张末期厚度(IVSTd)、左心室后壁厚度(LVPWTd)、左心室质量指数(LVMI)等指标大于非PAH组(P<0.05)。Logistic回归分析显示LAD、LVPWTd、LVMI、 HIF-1α、ET-1、ADMA与MHD患者并发PAH显著相关。结论MHD患者PAH患病率较高,心脏结构改变导致肺后性毛细血管压力增高可能是形成PAH的重要原因;HIF-1α、ET-1、ADMA等因子可能直接参与了MHD患者肺部血管病变,而导致PAH。
关键词〔〕血液透析;肺动脉高压;缺氧诱导因子-1
1天津市第三中心医院内分泌代谢病科
第一作者:王启鹏(1978-),男,硕士,主治医师,主要从事血液透析研究。
肺动脉高压(PAH)的发生机制和影响因素较多。研究发现维持性血液透析患者(MHD)并发PAH的比例较高,严重影响MHD患者生存率〔1〕。缺氧诱导因子(HIF)是缺氧性肺动脉高压(HPH)的重要因子。本研究分析MHD患者PAH的危险因素,并探讨HIF-1α与MHD患者PAH的相关性。
1对象与方法
1.1研究对象选取我院血液净化中心2010年1月至2012年6月MHD患者。入选标准:①MHD≥3个月;②以自体动静脉内瘘(AVF)和中心静脉导管(CVC)为血管通路;③临床上透析体重达到干体重,并且连续3个月体重平稳。排除标准:①慢性阻塞性肺疾病和能引起PAH的免疫系统疾病;②系统性结缔组织病;③严重冠脉病变行心脏介入或冠脉手术,透析前有风湿性心脏病及其他心肌病;④近3个月内发生急、慢性心功能不全;⑤感染未治愈。共筛选出患者138例,男78例,女60例,年龄27~83〔平均(56.72±10.65)〕岁。原发病为慢性肾小球肾炎46例,肾病综合征8例,高血压肾病12例,糖尿病肾病38例,多囊肾病11例,特发性间质性肾炎5例,类风湿性关节炎4例,狼疮性肾炎2例,病因不明12例。所有患者每周透析2~3次,每次4 h,透析机为Fresenius-4008S(德国),透析器为聚砜膜F-14(中国·山东威高),膜面积1.4 m2,透析液为碳酸氢盐透析液,透析用水为双级反渗水,血流量200~250 ml/min,透析液流量500 ml/min。
1.2研究方法
1.2.1基本资料记录患者的性别、年龄、透析龄、原发病、身高、体重、计算体重指数(BMI),收集患者连续3个月体重,透析前血压。138例MHD患者合并PAH 52例,患病率37.68%。两组患者性别、年龄、透析龄、透前血压、BMI等方面比较差异无统计学意义(P>0.05)。两组患者血管通路比较差异无统计学意义(P>0.05),见表1。
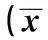
表1 两组患者一般情况的比较±s)
1.2.2血液生化等指标患者均于透析前空腹抽取肘部静脉血检测血红蛋白(Hb)、血清肌酐(Cr)、尿素氮(BUN)、血尿酸(UA)、二氧化碳结合力(CO2-CP)、总胆固醇(TC)、甘油三酯(TG)、血清钙(Ca)、血清磷(P)、血清白蛋白(ALB)、全段甲状旁腺激素(iPTH)、C反应蛋白(CRP)。
1.2.3心脏超声检查患者均在透析后2 h内于我院彩超室检查,采用西门子G60s彩色多普勒超声诊断仪,探头频率2~4 MHz,测量左心房内径(LAD)、间隔舒张末期厚度(IVSTd)、左心室后壁厚度(LVPWTd)、左心室舒张末期内径(LVIDd)、左心室收缩末期内径(LVIDs),并计算左心室射血分数(LVEF)、左心室质量指数(LVMI)。参照美国心脏超声协会右心检测指南,肺动脉收缩压(PASP)≥35mmHg为PAH的诊断标准〔1〕,根据心脏超声结果,将患者分为PAH组和非PAH组。
1.2.4HIF-1α、内皮素(ET)-1、人不对称二甲基精氨酸(ADMA)检测心脏彩超检测当日透析前空腹,抽取肘部静脉血,离心、吸取血清,采用ELISA方法检测血清HIF-1α和ET-1的水平,试剂盒由上海一研生物科技有限公司提供。应用双抗体夹心法测定标本中ADMA浓度,试剂盒由上海酶联生物科技有限公司提供。上述检测在我院检验科帮助下严格按照说明书的步骤完成。
1.3统计学处理采用SPSS17.0软件行t、χ2检验。相关性分析采用Logistic回归分析。
2结果
2.1两组患者血液生化指标比较PAH组Hb低于非PAH组(P<0.05)。肾功、血脂、血清ALB、Ca、P、iPTH、CRP等比较无差异(P>0.05),见表2。
2.2两组患者HIF-1α、ADMA、ET-1比较PAH组HIF-1、ADMA、ET-1水平均高于非PAH组(P<0.05),见表3。
2.3两组患者心脏超声指标比较PAH组LAD、IVSTd、LVPWTd 、LVMI等指标数值大于非PAH组(P<0.05)。LVEF、 LVIDd、LVIDs比较无差异(P>0.05),见表4。
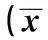
表2 两组患者血液生化指标比较±s)
与非PAH组比较:1)P<0.05,下表同

表3 两组患者HIF-1、ET-1、ADMA比较
2.4MHD患者并发PAH影响因素的多元回归分析将单变量统计分析得到的可能对PAH 发病有影响的因素进行Logistic回归分析后显示LAD、LVPWTd、LVMI、 HIF-1α、ET-1、ADMA与MHD患者并发PAH显著相关。见表5。
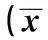
表4 两组患者心脏超声指标比较±s)

表5 MHD患者并发PAH影响因素的多元回归分析
3讨论
世界卫生组织(WHO)将引起PAH的重要因素分成4种,分别为肺动脉病变、左心疾病、慢性呼吸系统疾病以及慢性血栓栓塞性疾病〔2〕。近年研究发现MHD患者合并PAH的比例较高,约30%~66%〔3〕, MHD患者发生PAH后右心功能逐渐减退,最后可因右心功能衰竭而死亡,是终末期肾脏病(ESRD)患者死亡的独立预测因素〔4〕。但是,MHD患者并发PAH的机制尚不清楚。
本研究中MHD患者合并PAH患病率为37.68%,相对略低于国外报道〔2〕,分析与所有患者心脏超声均为透析后2 h内检查,减少了容量负荷对PASP数值的影响有关。本研究比较AVF与CVC患者发现并发PAH无显著差异,既往认为AVF可使MHD患者处于高动力循环状态,引起左房压力增加,加重肺循环瘀血,形成稳定的慢性PAH。相关研究表明内瘘的直径、血流量可能是PAH发生的相关因素〔5〕,不过Unal等〔6〕研究否定了这一观点,说明不能简单将AVF作为MHD患者PAH的影响因素。
但临床研究中MHD患者并发PAH时PTH水平或者发生肺动脉钙化的数量并无明显不同〔7〕,关于PTH与PAH的相关性,许多研究结果是不一致的〔5〕。Etemadi等〔8〕研究显示并发PAH的ERSD患者比未并发PAH的患者Hb更低。Yoo等〔9〕发现低白蛋白血症可增加MHD合并PAH患者的病死率。
本研究中,PAH组LAD、IVSTd、LVPWTd 、LVMI等指标数值大于非PAH组,回归分析显示LAD、LVPWTd、LVMI与PAH显著相关,分析与MHD患者长期容量负荷、高平均动脉压、高动力循环导致左心房压力升高,左室舒张功能障碍,舒张末压力增高,肺动脉楔压升高,形成毛细血管后性肺动高压〔10〕。Dagli等〔11〕研究发现并发PAH的MHD患者左心室射血分数明显降低。本研究中两组LVEF无显著差异,分析与我中心MHD患者平均透析龄短、左心代偿能力强和PAH以右心功能损伤为主等原因有关。
HIF参与机体对缺氧的反应,调控细胞氧平衡和诱导60多种下游基因表达,是机体生长发育、生理和病理反应过程中关键调控因素,在肿瘤的发生发展、心肺疾病以及胎儿的发育过程中起到了重要作用〔12〕,研究表明缺氧和HIF-1α活化参与了急性肾损伤(AKI)和慢性肾脏病(CKD)之间复杂的相互作用〔13〕,HIF-1α长期过度激活也是缺血/缺氧相关的慢性肾损伤的致病因素〔14〕。HIF是HPH的病理生理开关,HIF在缺氧时上调ET-1,血管内皮生长因子(VEGF)、诱导型一氧化氮合酶(iNOS)等目标基因的表达,促进机体和组织细胞对缺氧的适应,参与HPH的形成。目前研究发现非缺氧导致的PAH患者的细胞和组织的免疫组织化学检查提示HIF-1α的表达是增加的〔15〕,针对大鼠的研究也显示它在常氧状态下并发肺动脉高压的特征与人类PAH相似,并且HIF-1α明显升高〔16〕。MHD患者体内代谢产物的蓄积、酸碱失衡、电解质紊乱等一系列病理生理改变,可改变血管舒张因子的平衡,研究表明ESRD 患者ET-1 和血浆ADMA在明显升高,前列环素和一氧化氮(NO)减少,血管对NO的敏感性也降低, ADMA是内皮源性的NO合成酶抑制剂,ADMA在ESRD患者中有较高的浓度,ADMA是肾功能进展的独立预测因子,是ESRD患者心血管疾病的重要危险因素〔17〕,ET-1是强烈的血管收缩因子,ADMA 和ET-1可引起肺小动脉持续收缩,使肺血管直径缩小,增加肺血管阻力,导致PAH。本研究中MHD患者合并PAH组在无明显缺氧状下HIF-1α、ET-1、ADMA也明显升高,且与PAH明显相关,表明这三种因子可能参与MHD患者PAH的形成,HIF-1α可能参与了ET-1、ADMA的表达调控,但具体机制还需进一步研究。
综上所述,MHD患者合并PAH影响因素和机制繁杂,心脏结构的改变可能是导致MHD患者肺后性毛细血管压力增高形成PAH的相关因素,HIF-1α、ET-1、ADMA等因子可能直接参与了MHD患者肺部血管病变,而导致PAH。
参考文献4
1Rudski LG,Lai WW,Afilalo J,etal.Guidelines for the echocardiographic assessment of the right heart in adults:a report from the American Society of Echocardiography endorsed by the European Association of Echocardiography,a registered branch of the European Society of Cardiology and the Canadian Society of Echocardiography〔J〕.J Am Soc Echocadiogr,2010;23 (7):685-713.
2Simonneau G,Robbins IM,Beghetti M,etal.Updated clinical classification of pulmonary hypertension〔J〕.J Am Coll Cardiol,2009;54(Suppl):s43-s54.
3Fadaii A,Koohi-Kamali H,Bagheri B,etal.Prevalence of pulmonary hypertension in patients undergoing hemodialysis〔J〕.Iran J Kidney Dis,2013;7(1):60-3.
4Yigla M,Nakhoul F,Sabag A,etal.Pulmonary hypertension in patients with end-stage renal disease〔J〕.Chest,2003;123(5):1577-82.
5Havlucu Y,Kursat S,Ekmekci C,etal.Pulmonary hypertension in patients with chronic renal failure〔J〕.Respiration,2007;74(5):503-10.
6Unal A,Duran M,Tasdemir K,etal.Does arterio-venous fistula creation affects development of pulmonary hypertension in hemodialysis patients〔J〕?Ren Fail,2013;35(3):344-51.
7Amin M,Fawzy A,Hamid MA,etal.Pulmonary hypertension in patients with chronic renal failure:role of parathyroid hormone and pulmonary artery calcifications〔J〕.Chest,2003;124(6):2093-7.
8Etemadi J,Zolfaghari H,Firoozi R,etal.Unexplained pulmonary hypertension in peritoneal dialysis and hemodialysis Patients〔J〕.Rev Port Pneumol,2012;18(1):10-4.
9Yoo HH,Martin LC,Kochi AC,etal.Could albumin level explain the higher mortality in hemodialysis patients with pulmonary hypertension〔J〕?BMC Nephrol,2012;13(1):80.
10Pabst S,Hammerstingl C,Hundt F,etal.Pulmonary hypertension in patients with chronic kidney disease on dialysis and without dialysis:results of the PEPPER-study〔J〕.PLoS One,2012;7(4):e35310.
11Dagli CE,Sayarlioglu H,Dogan E,etal.Prevalence of and factors affecting pulmonary hypertension in hemodialysis patients〔J〕.Respiration,2009;78(4):411-5.
12Dunwoodie SL.The role of hypoxia in development of the mammalian embryo〔J〕.Dev Cell,2009;17(6):755-73.
13Nangaku M,Rosenberger C,Heyman SN,etal.Regulation of hypoxia-inducible factor in kidney disease〔J〕.Clin Exp Pharmacol Physiol,2013;40(2):148-57.
14Wang Z,Zhu Q,Li PL,etal.Silencing of hypoxia-inducible factor-1α gene attenuates chronic ischemic renal injury in two-kidney,one-clip rats〔J〕.Am J Physiol Renal Physiol,2014;306(10):F1236-42.
15Tuder RM,Chacon M,Alger L,etal.Expression of angiogenesis-related molecules in plexiform lesions in severe pulmonary hypertension:evidence for a process of disordered angiogenesis〔J〕.J Pathol,2001;195(3):367-74.
16Bonnet S,Michelakis ED,Porter CJ,etal.An abnormal mitochondrial-hypoxia inducible factor-1alpha-Kv channel pathway disrupts oxygen sensing and triggers pulmonary arterial hypertension in fawn hooded rats:similarities to human pulmonary arterial hypertension〔J〕.Circulation,2006;113(22):2630-41.
17Schwedhelm E,Böger RH.The role of asymmetric and symmetric dimethylarginines in renal disease〔J〕.Nat Rev Nephrol,2011;31(5):275-85.
〔2014-09-15修回〕
(编辑赵慧珍/曹梦园)
中图分类号〔〕R459.5〔
文献标识码〕A〔
文章编号〕1005-9202(2016)01-0087-04;
doi:10.3969/j.issn.1005-9202.2016.01.038

