肝细胞癌切除术后行经导管肝动脉灌注化疗术患者ALT水平改变相关的单核苷酸多态性位点分析▲
陈治伟 刘晓光 韩创业 朱广志 苏 浩 于 龙 鲁 磊 廖锡文 覃 玮 杨成昆 刘征涛 叶新平 李佳荃 桂 滢 莫曾南 胡艳玲 肖开银 彭 涛
(1 广西医科大学第一附属医院肝胆外科,南宁市 530021,E-mail:yzxiaozhi@163.com;2 广西医科大学,南宁市 530021)
论著·基础研究
肝细胞癌切除术后行经导管肝动脉灌注化疗术患者ALT水平改变相关的单核苷酸多态性位点分析▲
陈治伟1刘晓光1韩创业1朱广志1苏 浩1于 龙1鲁 磊1廖锡文1覃 玮1杨成昆1刘征涛1叶新平1李佳荃2桂 滢2莫曾南2胡艳玲2肖开银1彭 涛1
(1 广西医科大学第一附属医院肝胆外科,南宁市 530021,E-mail:yzxiaozhi@163.com;2 广西医科大学,南宁市 530021)
目的 探讨影响原发性肝细胞癌(PHC)切除术后行经导管肝动脉灌注化疗术(TAC)患者血清ALT水平变化相关的单核苷酸多态性(SNP)位点。方法 纳入肝癌肝切除术后行TAC治疗的PHC患者59例,获取其术中切取标本以提取组织DNA,通过芯片技术获取全外显子SNP。通过EMMAX检验多因素分析选择与术后ALT/术前ALT比值相关的SNP位点。通过KOBAS 2.0 program数据库筛选有关的候选SNP位点,采用线性回归模型分析影响患者术后ALT变化的基因型。结果 KOBAS 2.0 program筛选结果显示,位于12号染色体SLCO1B1基因上的rs2306283与患者术后ALT/术前ALT比值升高相关(最小等位基因频率=0.132,P=3.65×10-5)。线性回归分析结果显示,相对于GG基因型,SLCO1B1基因的AA+AG基因型OR=2.55(P<0.05),rs2306283为显性遗传模型,AA基因型和AG基因型为风险基因型。结论 肝细胞癌切除术后行TAC患者SLCO1B1基因rs2306283的 AA和AG基因型可能与术后ALT水平升高相关。
原发性肝细胞癌;经肝动脉化疗术;谷丙转氨酶;单核苷酸多态性;全基因组关联分析
原发性肝细胞癌(primary hepatocellular carcinoma,PHC)是最常见的恶性肿瘤之一,在中国每年发病约36万例,年死亡约35万例,因此也是我国最常见的致死恶性肿瘤之一[1-2]。PHC主要的治疗方法是早期手术切除,然而即使是根治性切除,其术后复发率依然很高,远期疗效并不理想[3]。经导管肝动脉灌注化疗术(trans-catheter arterial chemotherapy,TAC)是一种常用于肝癌切除术后预防肝癌复发的辅助治疗方法之一,而这一侵入性治疗术后常引起患者肝功能损害,表现为ALT等酶学指标改变[4],而ALT是评估肝功能改变的常用指标[5]。在临床治疗中,常能观察到患者行TAC治疗术后血清ALT的改变存在个体化差异,并且我们在前期研究[6-7]中发现人群ALT水平的个体化差异存在遗传基础。因此我们通过对PHC切除术后预防性行TAC术患者的临床资料进行分析,采用全基因组关联研究(Genome-Wide Association Study,GWAS)方法,探讨与TAC术后ALT水平改变可能相关的遗传因素,为临床制订个体化治疗方案提供参考。
1 资料和方法
1.1 临床资料 收集2003年9月至2013年12月于广西医科大学第一附属医院肝胆外科行肝癌肝切除术患者485例,术中切除标本均立即送至我科-80℃冰箱进行保存。纳入标准:(1)HBsAg均为阳性;(2)患者行肝癌切除术术前未接受任何介入治疗及化疗;(3)术后病理诊断均为肝细胞癌;(4)术后1~2个月返院行TAC术;(5)TAC术中用药方案为5-氟尿嘧啶500~1 000 mg、顺铂30~50 mg、吡柔比星30~50 mg;(6)术前及术后第1天均检测肝功能。根据以上标准共纳入59例病例,其中男性53例、女性6例,年龄27~75岁,中位年龄45岁,所有入组病例Child-Pugh评分均为A级[8]。1.2 血清ALT测定方法 所有入组病例采血均为清晨空腹(禁食12 h)卧位下采取静脉血5 ml,采入真空分离胶采血管内,静止1 h后以2 000 r/min离心10 min,采用丙氨酸氨基转移酶测定试剂盒(上海执诚生物科技有限公司,批号:ZCAPRP015)进行检测,样品测定设备为日立全自动生化分析仪(型号:7600-020)。
1.3 相关SNP位点检测方法
1.3.1 DNA提取:采用血液/细胞/组织基因组DNA提取试剂盒[天根生化科技(北京)有限公司,生产批号:M1909]对59例组织标本中的DNA进行提取。为确保DNA质量的可靠性,每例标本DNA均使用Nano Drop 2000 system(美国Thermo Fisher Scientific公司,型号Nano Drop 2000)对其浓度和纯度进行测定。所有步骤均按照试剂盒或仪器的说明进行操作。1.3.2 基因分型:59例DNA样本由外显子芯片(Illumina公司,Human Exome BeadChip V1.0)对其单核苷酸多态性(single nucleotide polymorphism,SNP)位点进行基因分型,芯片包含SNP位点为242 898个。1.3.3 全外显子SNP检测:通过iScan系统Illumina® HD Assay Ultra manual and imaging BeadChip检测平台对所有纳入研究的芯片标本外显子SNP进行检测,共检测SNP 242 901个。这些SNP包括错义SNP、剪切位点SNP和启动子区SNP等。使用Genotyping Module v1.0 in GenomeStudio 2011.1版对59例样本进行基因分型,平均分型率>98.5%。1.3.4 数据质控:在全外显子SNP检测中,所有标本均使用Plink 1.07版 (http://pngu.mgh.harvard.edu/~purcell/plink/download.shtml)、 R语言3.0.1(http://www.r-project.org/) 和EIGENSOFT package(http://genetics.med.harvard.edu/reich/Reich_Lab/Software.html)软件包进行质控。质控标准如下:(1)剔除基因分型率<95%的样本;(2)剔除性别不确定的样本;(3)剔除全基因组血缘相似度>0.1875的样本;(4)对59例标本行主成分分析,剔除离群样本; (5)剔除应答率<95%的SNP位点;(6)剔除哈-温平衡(Hardy-Weinberg equilibrium,HWE)P值<1×10-6的SNP位点;(7)剔除最小等位基因频率(minor allele frequency,MAF)<0.1的SNP位点。1.3.5 多因素分析:运用EPACTS软件包3.2.6版(http://csg.sph.umich.edu//kang/epacts/download/index.html)进行多因素分析(EMMAX检验[9]),由于ALT是数量性状,其值可能因使用不同试剂盒而产生误差,因此我们采用术后ALT值/术前ALT比值作为本次研究的因变量,SNP位点为自变量,对民族、年龄、性别、体重指数(body mass index,BMI)、吸烟、饮酒和单位体表面积用药量(包括5-氟尿嘧啶、顺铂、吡柔比星)作为协变量进行校正,计算得出与术后ALT/术前ALT比值升高相关且P值<0.05的SNP位点。
1.3.6 相关SNP位点筛选:通过KOBAS 2.0 program数据库(http://kobas.cbi.pku.edu.cn)对SNP进行筛选。根据本次研究目的,相关SNP所在基因功能应与肝炎、肝硬化、肝癌、肝脏代谢通路、肝脏药物代谢有关,以此条件筛选出符合条件的候选SNP位点。
1.4 相关定义或标准 (1)吸烟指承认有吸烟行为,且持续吸烟超过6个月;饮酒指承认既往有饮用含酒精饮料史,如白酒、葡萄酒、啤酒等;(2)BMI≥25 kg/m2定义为肥胖[10],肥胖是非酒精性脂肪肝的高危因素[11],非酒精性脂肪肝可引起血清ALT升高[12],因此将BMI以25 kg/m2进行分组比较其ALT比值是否存在差异性;(3)巴塞罗那分期(Barcelona Clinic Liver Cancer,BCLC)标准采用2010版标准[8];(4)肿瘤数目综合术中解剖所见及术后病理报告,以病理报告为准;(5)肿瘤大小为术中解剖离体肝癌标本所测最大肿瘤长径,多个肿瘤者则以最大横径相加所得。
1.5 统计学分析 应用SPSS 21.0软件进行统计学分析。呈偏态分布的计量资料以中位数表示,组间比较采用非参数检验分析;针对候选SNP位点,采用线性回归模型,以候选SNP位点基因型为自变量,术后ALT/术前ALT比值为因变量,同时矫正了民族、年龄、性别、吸烟、饮酒、BMI和单位体表面积用药量,计算SNP基因型的相关系数,并由此推算该SNP基因型的危险度(odds ratio,OR)。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同临床特征患者的术后ALT/术前ALT比值 59例TAC术患者中,不同临床特征分组患者的术后ALT/术前ALT比值比较,差异性均无统计学意义(P>0.05),提示以上因素对患者的术后ALT/术前ALT比值无明显影响,见表1。
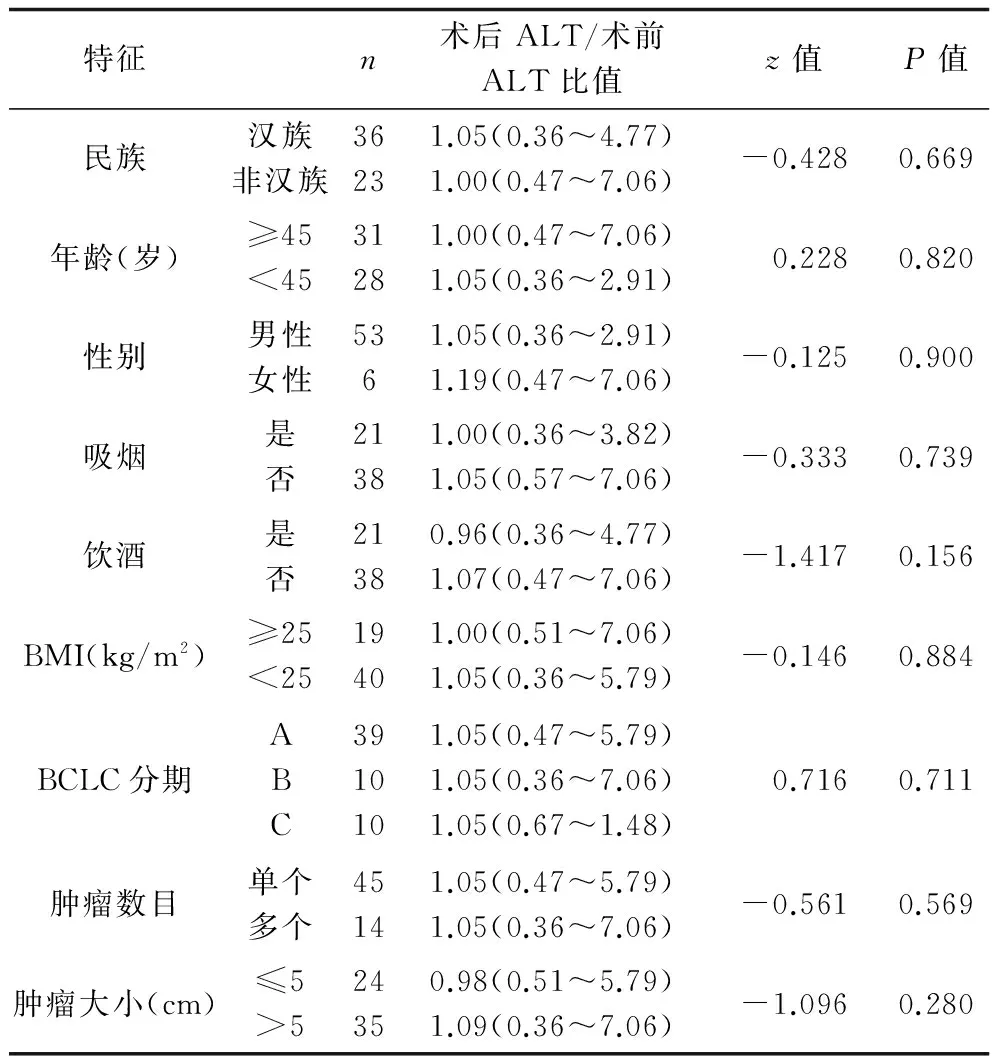
表1 不同临床特征分组患者的术后
2.2 数据质控及EMMAX检验多因素分析结果 所有经EPACTS软件包运算得到的SNP(包括MAF<0.1的SNP)均在曼哈顿图中显示,见图1。根据SNP的数据质控标准并经EPACTS软件包运算,59例标本外显子芯片,共有836个SNP被纳入最终研究。
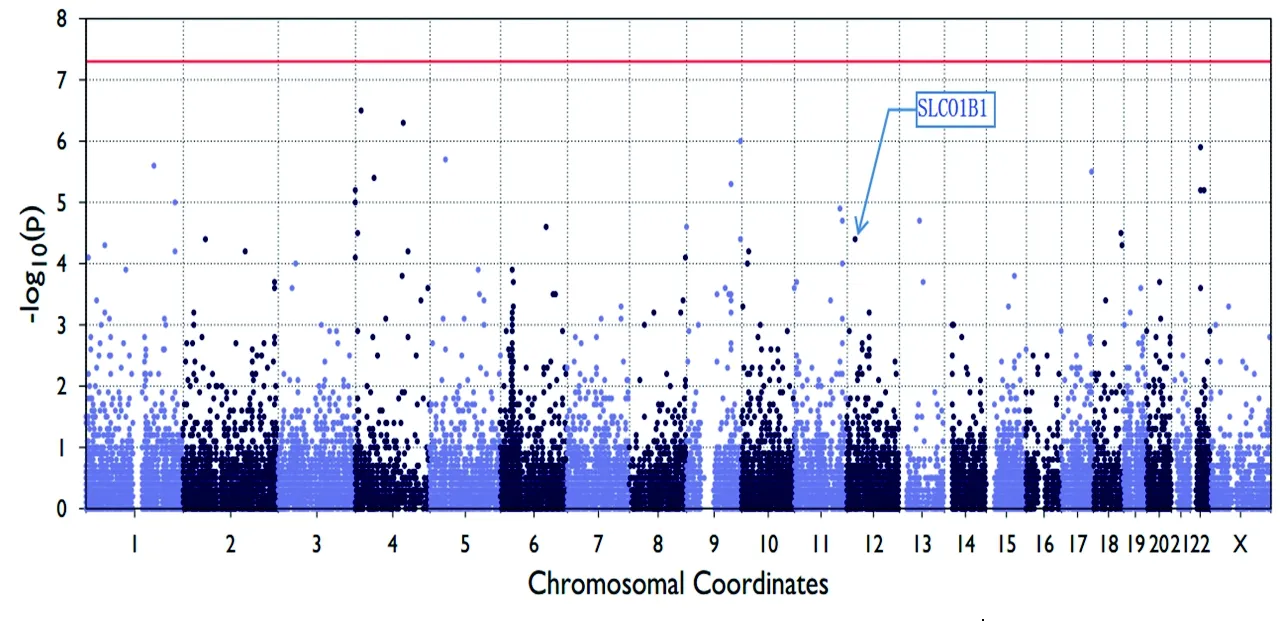
注:SLCO1B1(rs2306283)如曼哈顿图中所示,P=3.65×10-5,-lg(P)=4.44。
图1 曼哈顿图
根据质控标准,我们只关注满足MAF>0.1且P值最具有显著性(按P值从小到大排列的前10位)的10个SNP,见表2。10个SNP的相关基因型中,SRRD、HPS4、AGBL4基因的AA基因型以及ALDH7A1、ARIH1基因的TT基因型均为保护型基因型(OR<1,P<0.05),SLCO1B1、AGBL4、MRC1L1、AGT基因的AA+AG基因型以及PCDH20基因的TT+TG基因型为风险基因型(OR>1,P<0.05),见表3。
2.3 相关SNP位点筛选及线性回归分析的结果 通过生物信息学平台KOBAS 2.0 program进一步筛选,在入组的10个SNP中,我们发现1个SNP(rs2306283,MAF=0.132,P=3.65×10-5)可能与TAC术后ALT/术前ALT比值升高相关。线性回归分析结果显示,相对于GG基因型,AA+AG基因型的OR=2.55(P=0.048),因此rs2306283是显性遗传模型,即携带A基因型则表现出显性性状。由于AG+AG基因型的OR>1,因此AA基因型和AG基因型均是风险基因型。
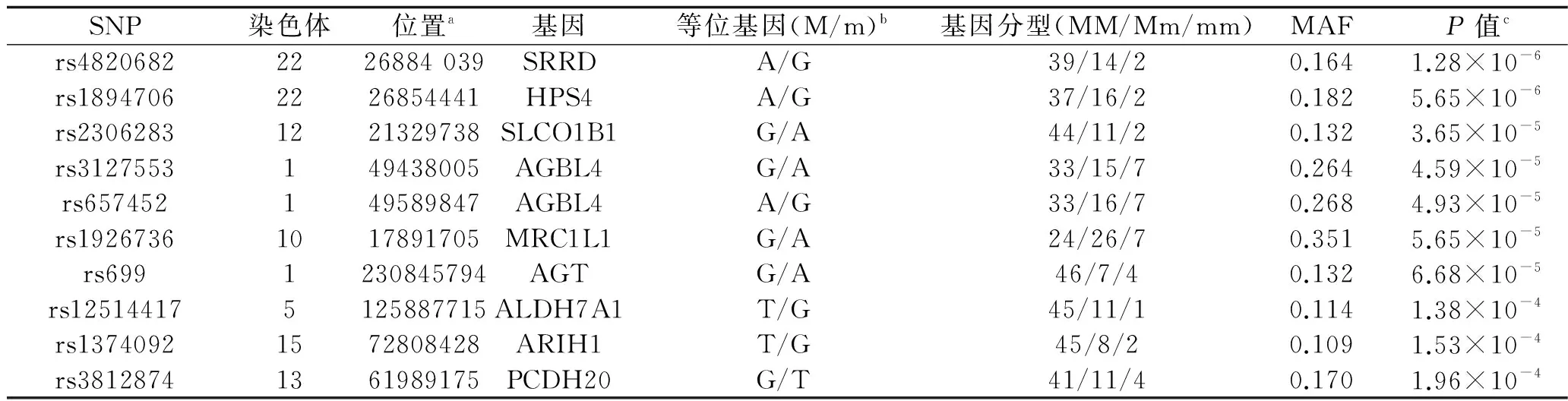
表2 符合入组条件的10个SNP
注:a:SNP位置标注基于NCBI(http://www.ncbi.nlm.nih.gov/variation/tools/1000genomes/)标识;b:M代表高频等位基因,m代表低频等位基因;c:P值矫正了民族、年龄、性别、吸烟、饮酒、BMI和单位体表面积用药量因素。
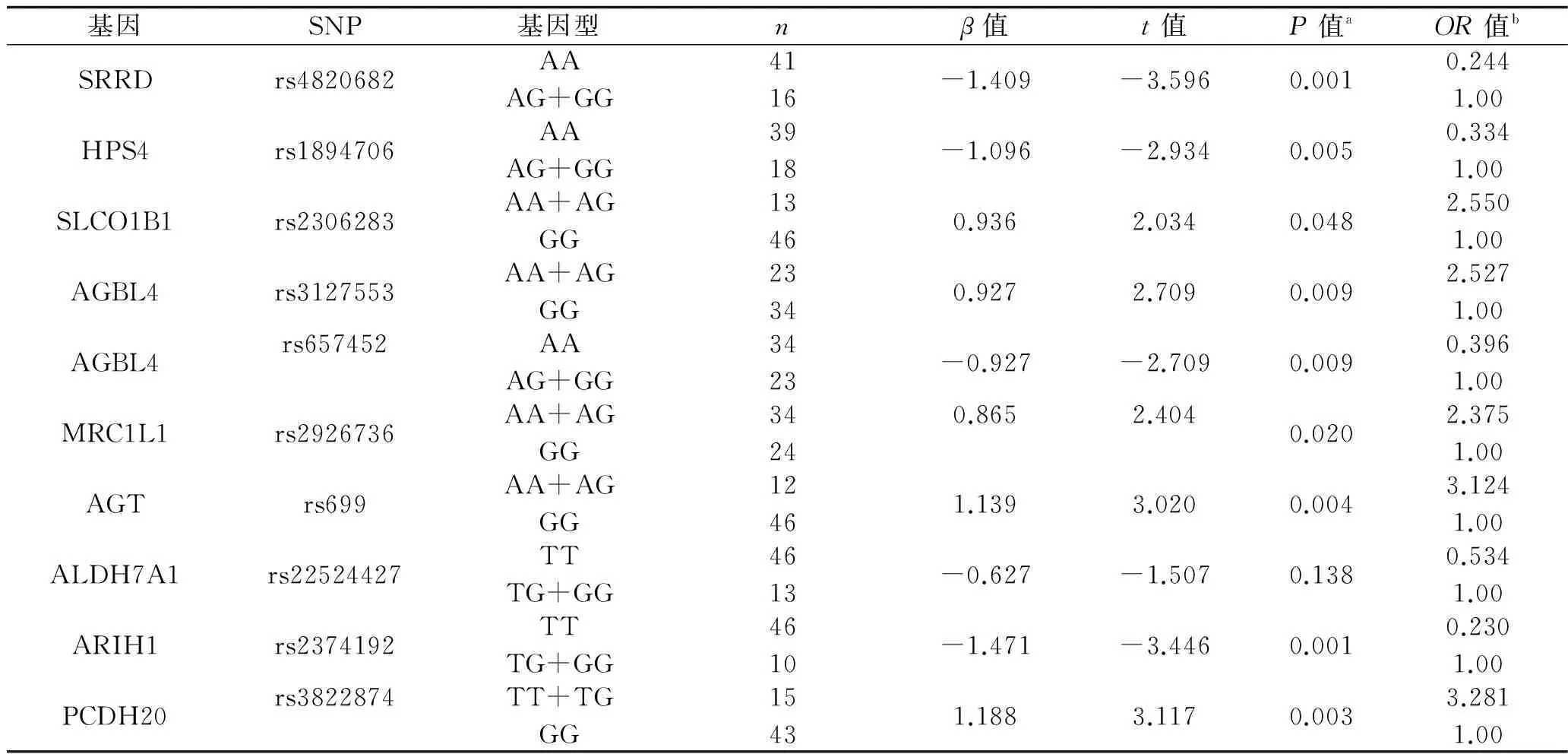
表3 入组SNP基因型对TAC患者术后ALT/术前ALT比值变化影响的多因素分析
注:a:P值矫正了民族、年龄、性别、吸烟、饮酒、BMI和单位体表面积用药量因素;b:OR值由自然数e的β次方计算得出。
3 讨 论
在本研究中,我们发现了一批与TAC术后患者血清ALT水平升高相关的潜在SNP,按照P值由小到大的顺序选出前10位的SNP,其中显著性最高的是rs4820682,其位于22号染色体的SRRD基因上,SRRD又称SRR1基因,其与SRR2基因共同构成神经细胞分化关键基因SOX2的增强因子,SRR1基因中包含POU转录因子,POU转录因子可指导Sox2的表达[13]。排在第2位的rs1894706位于22号染色的HPS4基因上,日本的一项针对精神分类症患者认知功能的GWAS研究结果显示,HPS4编码的BLOC-3蛋白与精神分裂症患者的认知障碍有关[14]。排在第3位的rs2306283位于12号染色体SLCO1B1基因上,SLCO1B1基因是编码肝脏细胞的一种跨膜转运受体,而这一受体参与药物在肝脏中的清除相关[15]。rs3127553和rs657452则位于1号染色体AGBL4基因中,有学者发现AGBL4基因上CpG岛的甲基化与结肠癌的发生相关[16]。rs1926736位落于10号染色体的MRC1L1基因中,MRC1L1基因编码的蛋白质是一种膜受体,该受体主要功能介导的糖蛋白的内吞作用。一项针对中国西南方汉族人群的GWAS研究结果显示,MRC1L1的基因变异与麻风病相关[17]。rs699位于1号染色AGT基因上,其编码的蛋白与血管紧张素合成相关,在一项针对波兰运动员的耐力和爆发力遗传因素研究中,AGT基因的rs699的多态性被认为与运动员的爆发力相关,而与耐力无关[18]。rs12514417位于5号染色体的ALDH7A1基因上,其所编码的蛋白是乙醛脱氢酶家族的成员,该酶主要作用是参与酒精代谢和脂质过氧化过程中产生的醛类物质的解毒过程。Giacalone等[19]认为,ALDH7A1的表达与经手术切除的非小细胞肺癌复发相关。另外有文献报告,ALDH7A1 rs1318240与对食管鳞状细胞癌发生有关[20]。rs1374092位于15号染色体ARIH1基因上,ARIH1又称为HHARI,其编码的蛋白质是一种泛素蛋白质连接酶,该酶对细胞增殖有至关重要的作用[21]。rs3812874位于13号染色体PCDH20基因上,有学者认为PCDH20 可能是一个潜在的肝细胞肝癌[22]和鼻咽癌[23]的肿瘤抑制基因。既往也曾有研究表明ALT水平是受遗传因素影响[24]。本课题组前期的Meta分析研究结果显示,PNPLA3基因rs738409的多态性与血清ALT水平相关[6]。本课题组在前期的GWAS研究中发现,位于SLC35F3 基因的rs10157061、rs10752781和rs1878544可能与酒精暴露下的人群血清ALT 水平存在相关性,推测SLC35F3可能是调节 ALT 水平的关键基因[7]。目前尚无文献报告本研究中入组的SNP与TAC术后血清ALT水平直接相关。
我们将所有入组的SNP位点经KOBAS 2.0 program生物信息平台进一步筛选,分析各SNP所在基因的功能和信号通路,发现位于12号染色体SLCO1B1基因上rs2306283在功能学上较其他SNP更有可能是造成TAC术后血清ALT变化的潜在SNP位点。rs2306283位于12号染色体SLCO1B1基因中,SLCO1B1基因是编码肝脏特异性有机阴离子转运蛋白家族的成员,其编码的蛋白质是一种跨膜转运受体,而这一受体参与药物在肝脏中的清除,如他汀类药物、甲氨蝶呤等从肝细胞中的转运至血液中[13,25-26]。相关文献报告,SLCO1B1的遗传变异对用于治疗癌症和自身免疫疾病的药物有显著影响,在SLCO1B1基因的常见突变体中,缺乏一种编码肝脏转运子,而该转运子是从机体清除药物的关键,从而影响机体清除化疗药物的效率,而这一影响已被证实在使用化疗药物甲氨蝶呤时尤为显著,甲氨蝶呤的低清除状况,导致血液中甲氨蝶呤的蓄积并增加其毒副作用[13]。而目前尚无文献报告其与肝癌切除术后TAC术中使用的常规化疗药物引起肝功能损害与SLCO1B1基因有关。
通过建立线性相关模型,发现SLCO1B1基因中的rs2306283的显性遗传模型(AA和AG)较隐性遗传模型(GG)更易发生术后肝功能损害,这可能与甲氨蝶呤从肝脏中清除机理相似,即SLCO1B1的遗传变异使得TAC术中常用化疗药在肝脏蓄积并导致肝脏细胞受损,从而引起ALT升高,而显性遗传模型(AA和AG)有可能是导致SLCO1B1遗传变异的因素之一。这一研究结果可能对指导临床介入治疗有指导意义。随着个体化医疗的发展,通过基因检测技术给予患者最合理的治疗方案并评估其预后是医学发展的必然方向。在TAC治疗术前,我们可以通过基因检测技术,检测患者是否携带相关风险基因型,从而评估患者TAC术后发生肝功能损坏的风险,并进一步指导临床用药方案及调整用药剂量。
本研究存在一定的局限性:首先由于苛刻的入组标准和质控标准,研究纳入的病例数较少;其次本次入组病例TAC方案仅为顺铂、吡柔比星、5-氟尿嘧啶三联用药方案,其他用药方案仍需进一步验证;最后本研究的人群局限于广西人群,还需要多中心对照研究验证。
[1] Chen JG,Zhang SW.Liver cancer epidemic in China:past,present and future[J].Semin Cancer Biol,2011,21(1):59-69.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Malek NP,Schmidt S,Huber P,et al.The diagnosis and treatment of hepatocellular carcinoma[J].Dtsch Arztebl Int,2014,111(7):101-106.
[4] 程永德,程英升,颜志平.常见恶性肿瘤介入治疗指南[M].北京:科学出版社,2013:76-77.
[5] Kim WR,Flamm SL,Di Bisceglie AM,et al.Serum activity of alanine aminotransferase(ALT) as an indicator of health and disease[J].Hepatology,2008,47(4):1 363-1 370.
[6] Liu ZT,Ning HJ,He XY,et al.Meta-analysis reveals a specific association of the PNPLA3 I148M polymorphism with ALT level in adolescents[J].Per Med,2015,12(2):67-82.
[7] 刘征涛.影响广西防城港地区男性人群谷丙转氨酶水平的遗传变异及其在永生化肝细胞株中的验证[D].南宁:广西医科大学,2014.
[8] 中华人民共和国卫生部.原发性肝癌诊疗规范(2011年版)[J].临床肝胆病杂志,2011,27(11):1 141-1 159.
[9] Lin DY,Tang ZZ.A general framework for detecting disease associations with rare variants in sequencing studies[J].Am J Hum Genet,2011,89(3):354-367.
[10]World Health Organization Western Pacific Regional.The Asia-Pacific perspective:redefining obesity and its treatment[M].Sydney:Health Communications Australia Pty Limited,2000:11-12.
[11]向国卿,孟宪云,张 浩,等.脂肪肝相关危险因素的评估[J].世界华人消化杂志,2009,17(10):1 038-1 041.
[12]Clark JM,Brancati FL,Diehl AM.The prevalence and etiology of elevated aminotransferase levels in the United States[J].Am J Gastroenterol,2003,98(5):960-967.
[13]Sikorska M,Sandhu JK,Deb-Rinker P,et al.Epigenetic modifications of SOX2 enhancers,SRR1 and SRR2,correlate with in vitro neural differentiation[J].J Neurosci Res,2008,86(8):1 680-1 693.
[14]Kuratomi G,Saito A,Ozeki Y,et al.Association of the Hermansky-Pudlak syndrome type 4(HPS4) gene variants with cognitive function in patients with schizophrenia and healthy subjects[J].BMC Psychiatry,2013,13:276.
[15]Ramsey LB,Bruun GH,Yang W,et al.Rare versus common variants in pharmacogenetics:SLCO1B1 variation and methotrexate disposition[J].Genome Res,2012,22(1):1-8.
[16]Lin PC,Lin JK,Lin CH,et al.Clinical relevance of plasma DNA methylation in colorectal cancer patients identified by using a Genome-Wide High-Resolution array[J].Ann Surg Oncol,2015,22(Suppl 3):S1 419-S1 427.
[17]Wang D,Feng JQ,Li YY,et al.Genetic variants of the MRC1 gene and the IFNG gene are associated with leprosy in Han Chinese from Southwest China[J].Hum Genet,2012,131(7):1 251-1 260.
[18]Zarębska A,Sawczyn S,Kaczmarczyk M,et al.Association of rs699(M235T) polymorphism in the AGT gene with power but not endurance athlete status[J].J Strength Cond Res,2013,27(10):2 898-2 903.
[19]Giacalone NJ,Den RB,Eisenberg R,et al.ALDH7A1 expression is associated with recurrence in patients with surgically resected non-small-cell lung carcinoma[J].Future Oncol,2013,9(5):737-745.
[20]Wang H,Tong L,Wei J,et al.The ALDH7A1 genetic polymorphisms contribute to development of esophageal squamous cell carcinoma[J].Tumour Biol,2014,35(12):12 665-12 670.
[21]Elmehdawi F,Wheway G,Szymanska K,et al.Human homolog of drosophila ariadne(HHARI) is a marker of cellular proliferation associated with nuclear bodies[J].Exp Cell Res,2013,319(3):161-172.
[22]Lv J,Zhu P,Yang Z,et al.PCDH20 functions as a tumour-suppressor gene through antagonizing the Wnt/β-catenin signalling pathway in hepatocellular carcinoma[J].J Viral Hepat,2015,22(2):201-211.
[23]Chen T,Long B,Ren G,et al.Protocadherin20 Acts as a tumor suppressor gene: epigenetic inactivation in nasopharyngeal carcinoma[J].J Cell Biochem,2015,116(8):1 766-1 775.
[24]Yuan X,Waterworth D,Perry JR,et al.Population-Based genome-wide association studies reveal six loci influencing plasma levels of liver enzymes[J].Am J Hum Genet,2008,83(4):520-528.
[25]Daka A,Dimovski A,Kapedanovska A,et al.Effects of single nucleotide polymorphisms and haplotypes of the SLCO1B1 gene on the pharmacokinetic profile of atorvastatin in healthy Macedonian volunteers[J].Pharmazie,2015,70(7):480-488.
[26]SEARCH Collaborative Group,Link E,Parish S,et al.SLCO1B1 variants and statin-induced myopathy--a genomewide study[J].N Engl J Med,2008,359(8):789-799.
Analysis on single nucleotide polymorphism loci related to ALT level variation in patients undergoing trans-hepatic artery chemotherapy after resection for hepatocellular carcinoma
CHENZhi-wei1,LIUXiao-guang1,HANChuang-ye1,ZHUGuang-zhi1,SUHao1,YULong1,LULei1,LIAOXi-wen1,QINWei1,YANGCheng-kun1,LIUZheng-tao1,YEXin-ping1,LIJia-quan2,GUIYing2,MOZeng-nan2,HUYan-ling2,XIAOKai-yin1,PENGTao1
(1DepartmentofHepatobiliarySurgery,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China;2GuangxiMedicalUniversity,Nanning530021,China)
Objective To explore the single nucleotide polymorphism(SNP) loci related to the serum ALT level variation in patients undergoing trans-catheter arterial chemotherapy(TAC) after resection for primary hepatocellular carcinoma(PHCC).Methods Fifty-nine patients with PHCC who underwent TAC after resection for liver cancer were enrolled,and their DNAs were extracted from the specimens obtained in surgical resection.The SNPs of whole exons were acquired using DNA chips technology.The SNP loci related to postoperative ALT/preoperative ratio were selected by EMMAX multivariate analysis.The relative candidate SNP loci were screened by KOBAS 2.0 program database.The genotypes influencing postoperative ALT variation of the patients were analyzed by linear regression analysis.Results The result screened by KOBAS 2.0 program showed that rs2306283 located in SLCO1B1 gene of chromosome12 was related to elevated postoperative ALT/preoperative ratio(minor allele frequency=0.132,P=3.65×10-5).The result of linear regression analysis showed that OR value of SLCO1B1 gene AA+AG genotype was 2.55(P<0.05),rs2306283 was a dominant model,and AA and AG genotypes were risk genotypes.Conclusion For patients underwent TAC after resection for PHCC,AA genotype and AG genotype of SLCO1B1 gene rs2306283 are probably associated with the elevation of postoperative ALT level.
Primary hepatocellular carcinoma,Trans-hepatic artery chemotherapy,Alanine aminotransferase,Single nucleotide polymorphism,Genome-wide association study
国家自然科学基金(81560535,81072321,30760243,30460143,30560133),2009年教育部新世纪优秀人才支持计划(NCET),广西科学研究与技术开发计划项目(桂科攻1104003A-7),广西医疗卫生重点科研课题(重201018)
陈治伟(1989~),男,硕士,医师,研究方向:肝细胞肝癌介入治疗的并发症及其遗传基础分析。
彭涛(1969~),男,博士,教授、主任医师、博士生导师,研究方向:原发性肝癌的病因,E-mail:pengtaocn@hotmail.com。通信作者:肖开银(1970~),男,博士,教授、主任医师、硕士生导师,研究方向:肝胆外科疾病的基础及临床研究,E-mail:xiaokaiyin@163.com。
R 342.4
A
0253-4304(2016)12-1629-05
10.11675/j.issn.0253-4304.2016.12.01
2016-06-07
2016-08-16)

