人乳头状瘤病毒不同亚型感染与宫颈病变程度关系研究
庞小芬 王佳丽 石丹丽 陈昌贤 莫凌昭
(广西医科大学附属肿瘤医院妇瘤科,南宁市 530021,E-mail:1334049578@qq.com)
临床创新
人乳头状瘤病毒不同亚型感染与宫颈病变程度关系研究
庞小芬 王佳丽 石丹丽 陈昌贤 莫凌昭
(广西医科大学附属肿瘤医院妇瘤科,南宁市 530021,E-mail:1334049578@qq.com)
目的 探讨人乳头状瘤病毒(HPV)感染与宫颈病变的相关性。方法 采用凯普人乳头状瘤病毒核酸扩增分型检测方法检测217例宫颈细胞学正常/炎症患者(对照组)、131例高级别宫颈上皮内瘤变(CINⅡ~Ⅲ组)、338例宫颈癌(宫颈癌组)患者HPV基因。3组患者又根据年龄不同分为年轻组(≤35岁)和中老年组(≥35岁),根据民族分为汉族和少数民族两组,分别比较各组患者HPV感染率与年龄、民族的关系。结果 (1)对照组HPV感染率为20.74%(45/217),明显低于CINⅡ~Ⅲ组的86.26%(113/131)、宫颈癌组的90.53%(306/338)(P均<0.05),CINⅡ~Ⅲ组与宫颈癌组HPV感染率比较,差异无统计学意义(P>0.05)。(2)对照组、CINⅡ~Ⅲ组、宫颈癌组HPV多重感染率分别为11.11%、27.43%、19.28%,CINⅡ~Ⅲ组多重感染率明显高于对照组(P<0.05)。(3)常见的亚型检出率: HPV16为41.25%,HPV18为10.35%,HPV58为9.33%,HPV52为6.27%,HPV33为3.94%。logistic回归分析显示:感染HPV16、58、52、33型患CINⅡ~Ⅲ的风险升高(P<0.05);感染HPV16、18、58、52型患宫颈癌的风险升高(P<0.05)。(4)对照组患者中,年轻组HPV感染率高于中老年组(P<0.05),宫颈癌组中,中老年组HPV感染率高于年轻组(P<0.05),CINⅡ~Ⅲ组患者中,年轻组与老年组HPV感染率无差异(P>0.05)。结论 HPV感染率随宫颈病变严重程度加重呈升高;HPV多重感染可能是宫颈病变加重的重要因素;HPV16、18、58、52、33型与宫颈病变密切相关。
宫颈癌;宫颈上皮内瘤变;人乳头状瘤病毒;基因分型
宫颈癌是最常见的妇科恶性肿瘤之一,严重威胁女性的健康和生命。在我国,每年新增宫颈癌患者约13.5万,占全球发病数量的1/3[1]。宫颈癌的发生发展是宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)-原位癌-早期浸润癌-浸润癌的连续发展过程,期间可经历10~15年。故在此过程中,对宫颈病变特别是宫颈癌的筛查、早期诊治十分关键。目前认为人乳头状瘤病毒(human papillomavirus,HPV),特别高危型别HPV的持续性感染是引起宫颈癌的基本原因。故HPV的筛查是早期发现和预防宫颈癌的重要手段,对HPV特别是高危型HPV的监测及分型研究对预测宫颈病变的进展、判断预后、指导治疗有重要价值。本文检测对照组、CINⅡ~Ⅲ组、宫颈癌组患者HPV感染情况,以了解HPV感染与宫颈上皮内瘤变、宫颈癌的关系。
1 资料与方法
1.1 临床资料 收集2010年8月至2013年8月在广西医科大学附属肿瘤医院就诊的CINⅡ~Ⅲ患者131例,年龄24~75岁,宫颈癌患者338例,年龄21~79岁,均经我院病理检查确诊。选取同期接受宫颈薄层液基细胞学检测并显示宫颈细胞正常或炎性反应性细胞改变的非宫颈病变患者217例为对照组,年龄19~75岁。所有患者按年龄不同分为年轻组(≤35岁)和中老年组(>35岁),根据民族不同分为汉族和少数民族组。
1.2 试剂及仪器 HPV DNA抽提试剂盒(QIA Mini试剂盒,德国Qiagen公司);HPV基因分型检测试剂盒(中国凯普生物科技有限公司);扩增仪(GeneAmp 9700,美国ABI公司);医用核酸分子快速杂分仪(中国凯普生物科技有限公司)。
1.3 方法
1.3.1 标本采集:标本采样前3 d内不用阴道内药物,不行阴道冲洗,前1 d起禁止性生活。由妇科医师用阴窥器暴露宫颈,用棉拭子擦去宫颈口过多的分泌物,将宫颈刷伸入宫颈口处,轻轻转动宫颈刷,顺时针旋转3~5周,慢慢抽出宫颈刷,将其放入含专用保存液的小瓶中,旋紧瓶盖,标记好送检验室检测。1.3.2 标本DNA提取:取上述液体0.5 ml,13 000 r/min离心1 min,弃上清液,利用QIA Mini试剂盒提取DNA,具体操作步骤参照试剂盒说明书。
1.3.3 HybriMax法检测21种HPV亚型:(1)标本DNA扩增: 将水、PCR MIX、Taq酶和DNA模板按要求混匀,反应体系为25 μl。PCR反应条件为20℃10 min,95℃预变性9 min;95℃ 20 s→55℃ 30 s→72℃ 30 s→95℃ 20 s,共40个循环后,72℃延伸5 min,最后将温度维持在4℃。(2)导流杂交: 将扩增后的PCR产物加热变性后冰浴,同时将固定有特异性核酸探针的膜固定在杂交仪上,进行预杂交。把PCR产物加到薄膜上,让样品流入膜内进行导流杂交,清洗除去未结合的DNA,整个杂交过程保持在45℃。(3)芯片显色: 用封阻液封闭膜,孵育5 min,重复2次。排出封阻液后加入酶标液,25℃温育3.5 min。用冲洗缓冲液彻底冲洗膜,除去未结合的酶标液,后加入NBT/BCIP底物显色3~5 min。在显色后1 h内分析结果。
1.3.4 结果判定:固定有特异性核酸探针的膜共分隔成21个小圆,每个圆点表示一种HPV型别,21种HPV分为高危型和低危型两类:高危型15种,包括HPV16、18、31、33、35、39、45、51、52、53、56、68、59、66、68;低危型6种,包括HPV6、11、42、43、44、CP8304。显示为紫蓝色圆点提示该HPV型别检测结果阳性,两个或两个以上圆点显色者为多亚型感染。
1.4 统计学分析 采用SPSS 16.0软件进行统计学分析。计数资料率的比较采用χ2检验;采用logistic回归进行相关性分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组患者HPV感染情况 对照组217例,HPV感染率为20.74%;CINⅡ~Ⅲ组131例,HPV感染率为86.26%;宫颈癌组338例,HPV感染率为90.53%。宫颈癌组HPV感染率高于CINⅡ~Ⅲ组、对照组(χ2=141.474,P<0.001),CINⅡ~Ⅲ组与宫颈癌组HPV感染率无差异(χ2=1.810,P=0.185)。对照组、CINⅡ~Ⅲ组、宫颈癌组高危型HPV感染率分别为97.78%、98.23%、98.69%。见表1。
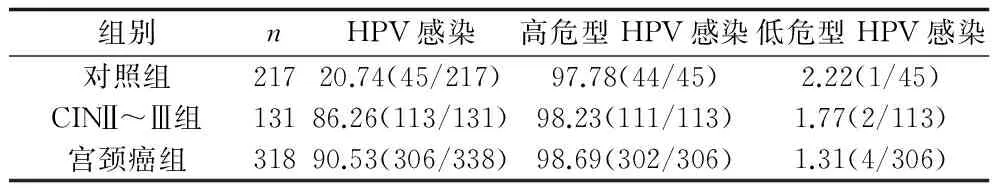
表1 3组患者HPV感染率 及高危型HPV感染构成比较(%)
2.2 各组患者HPV多重感染情况 对照组多重感染5例,其中二重感染4例,以HPV16与其他型别合并感染为主,共3例。CINⅡ~Ⅲ 组多重感染31例,其中二重感染24例,HPV16与其他型别合并感染为主,占58.06%(18/31),并以HPV16+18、HPV16+52、HPV16+58多见。宫颈癌组多重感染59例,其中二重感染47例,合并HPV16感染占多重感染47.46%(28/59),以HPV16+52、HPV16+18、HPV16+58等多见。3组患者的HPV感染均以二重感染为主,其中对照组和CINⅡ~Ⅲ 组主要以合并HPV16感染为主。3组多重感染率比较,差异有统计学意义(χ2=4.874,P=0.035),CINⅡ~Ⅲ组HPV多重感染率高于对照组(P<0.05),对照组与宫颈癌组、CINⅡ~Ⅲ组与宫颈癌组HPV多重感染率比较,差异均无统计学意义(P>0.05)。见表2。
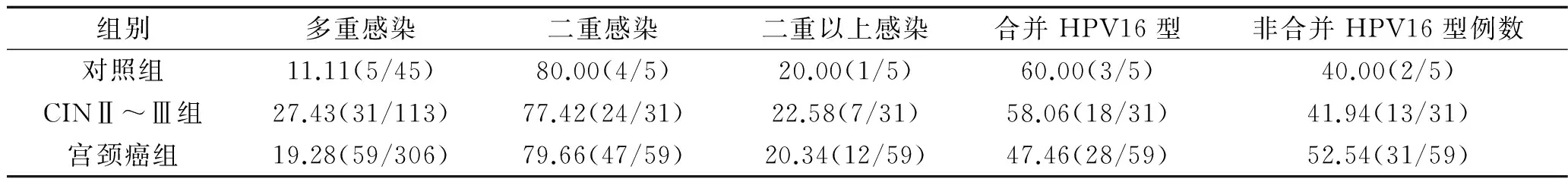
表2 3组患者HPV多重感染情况(%)
2.3 HPV亚型的分布及其与CINⅡ~Ⅲ、宫颈癌的关系 本研究3组共686例患者,检出HPV感染464例,21种HPV亚型中,除HPV43亚型未检出外,其他20种HPV亚型均被检出。3组患者16、18、58、52和33亚型检出率比较,差异有统计学意义(χ2=114.870、36.548、28.102、15.823、26.910,P均<0.001),其余亚型检出率比较,差异无统计学意义(P>0.05)。见表3。采用logistic回归分析显示: 16型(OR=7.017,95% CI=4.114~11.970,P<0.001)、58型(OR=6.782,95% CI=2.977~15.450,P<0.001)、52型(OR=8.884,95% CI=1.915~41.212,P=0.001)、33型(OR=27.934,95% CI=3.644~214.115,P<0.001)HPV感染患CINⅡ~Ⅲ的风险升高。16型(OR=9.778,95% CI=6.155~15.534,P<0.001)、18型(OR=7.437,95%CI=3.151~17.551,P<0.001)、58型(OR=2.452,95% CI=1.099~5.469,P=0.024)、52型(OR=10.855,95%CI=2.571~45.839,P<0.001)HPV感染者患宫颈癌的风险升高。
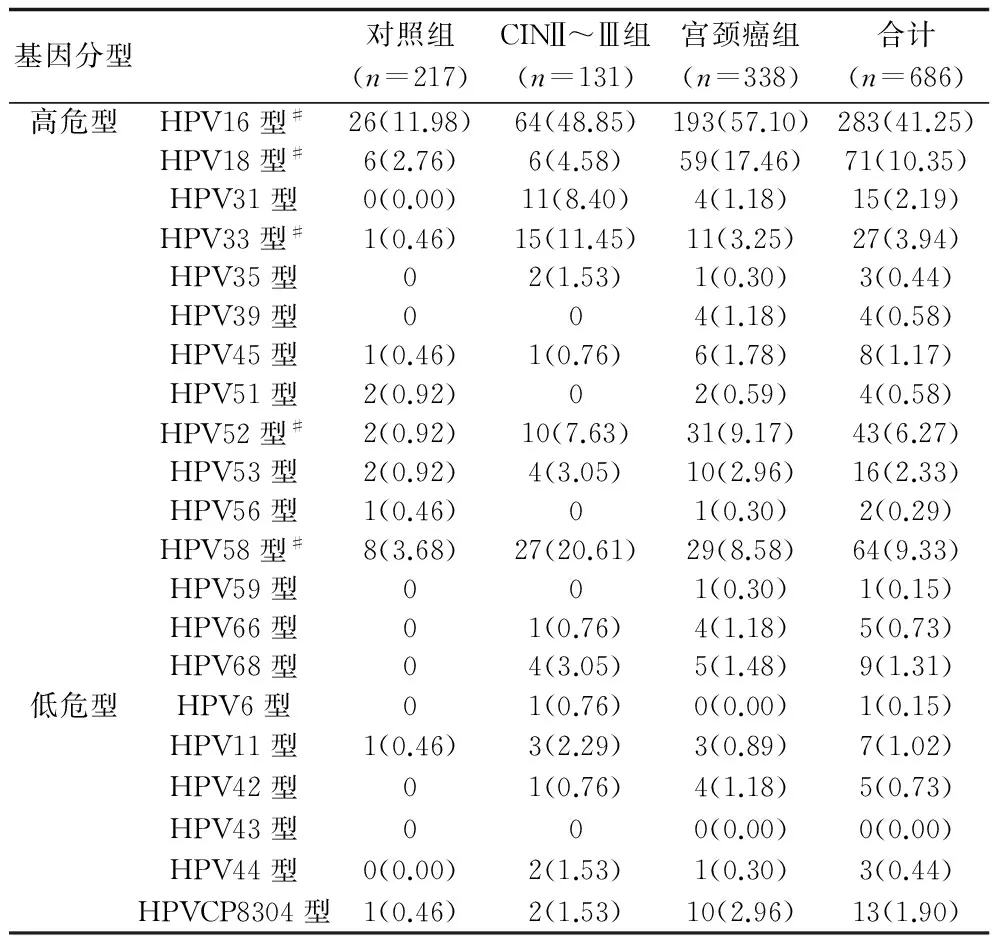
表3 3组患者 HPV亚型感染分布情况(n,%)
注:多型感染,各亚型单独计数统计;#P<0.05。
2.4 各组内不同年龄、民族患者HPV感染率的比较 对照组患者平均年龄41.97岁(95%可信区间为:40.65~43.32岁);CINⅡ~Ⅲ组患者平均年龄42.98岁(95%可信区间为:41.33~44.63岁);宫颈癌组患者平均年龄50.11岁(95%可信区间为:48.97~51.26岁);3组患者均以35岁为界分为年轻组(≤35岁)、中老年组(>35岁)。对照组中,年轻组HPV感染率明显高于中老年组患者(P<0.05);宫颈癌组中,老年患者HPV感染率明显高于年轻组患者(P<0.05);CINⅡ~Ⅲ组中,年轻组患者与中老年组患者HPV感染率比较,差异无统计学意义(P>0.05)。将3组患者分为汉族和少数民族。对照组、CINⅡ~Ⅲ组、宫颈癌组患者中汉族与少数民族HPV感染率比较,差异均无统计学意义(P>0.05)。见表4。
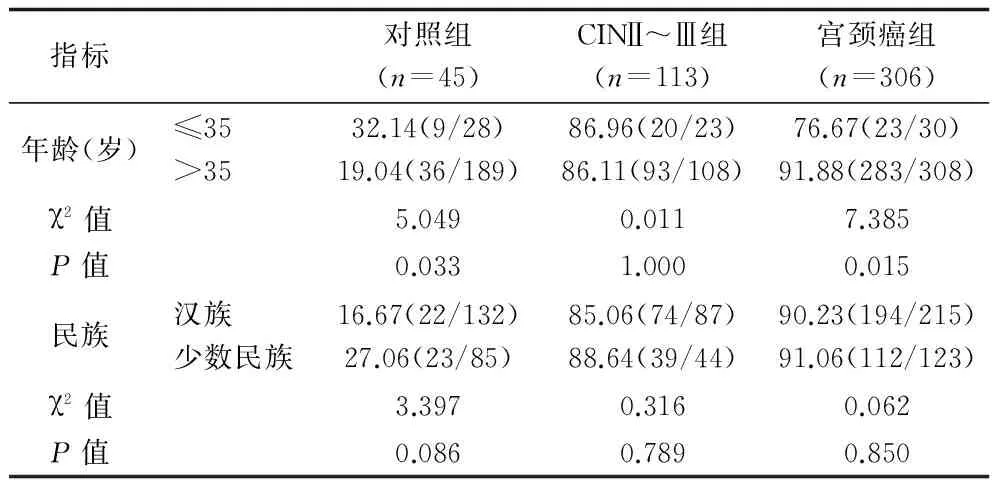
表4 各组内年龄、民族患者HPV感染率的比较(%)
3 讨 论
流行病学调查显示,HPV感染是宫颈癌前病变和宫颈癌的主要致病因子,目前已经分离出130多种HPV亚型,其中30余种与下生殖道良性疣及宫颈癌有密切关系。根据与女性生殖道肿瘤的关系,HPV被分为高危型和低危型,其中HPV6、11、42、43、44、CP8304属低危型,一般不诱发癌变,多见于生殖道良性病变;HPV16、18、31、33、35、45、52、58等属高危型,与宫颈癌的发生关系最为密切。本研究中,CINⅡ~Ⅲ组HPV感染率为86.26%、宫颈癌组为90.53%,均明显高于对照组的20.74%(P<0.05),3组患者均以含高危型HPV感染为主。说明CINⅡ~Ⅲ和宫颈癌与高危型HPV感染密切相关。
根据感染HPV病毒不同,可以分为单一感染和多重感染,多重感染中常见的有二重感染、三重感染,或者更多亚型的合并感染。目前研究虽然在单一HPV感染和多重HPV感染在宫颈疾病的发生发展、病情评估及预后影响上存在不同的意见,但均认为多重感染与宫颈病变之间存在密切关系[2]。陶萍萍等[3]采用凯普导流杂交HPV DNA检测各种宫颈病变,结果显示随着病变程度的升级,多重感染率逐渐增加,提示多重感染可能与宫颈病变的进展有关。本研究结果显示,对照组、CINⅡ~Ⅲ组、宫颈癌组患者多重感染率分别为11.11%、27.43%、19.28%,CIN Ⅱ~Ⅲ组多重感染率明显高于对照组(P<0.05)。提示多重感染可能在一定程度上有促进宫颈病变加重的作用。但宫颈癌的多重感染率却低于CINⅡ~Ⅲ组患者,并且与对照组的多重感染率比较无差异(P>0.05)。这与多重感染促进宫颈病变加重的观点并不符合,可能是由于宫颈癌患者子宫颈肿物坏死组织较多,影响取样,导致宫颈癌患者HPV亚型检测结果产生偏差。3组患者多重感染均以二重感染为主,最常见的二重感染型别为HPV16+52、HPV16+18、16+58等。多重感染中含有HPV16的混合感染所占比例最高。由此可见,无论在二重感染还是多重感染中,HPV16都是最主要的感染型别。
有研究显示,CIN和宫颈癌患者的HPV感染型别和分布在不同区域有一定的差异[4]。不同亚型的HPV感染其致病后果不同,HPV阳性的宫颈癌患者中,HPV16型感染率最高[5]。本研究中,对照组、CINⅡ~Ⅲ组、宫颈癌组均以HPV16型感染为主要类型。 除HPV16型外,其他20种亚型分布则各有不同,有文献报告[5]在拉丁美洲最常见的是33型,其次是39、59型,而在亚洲国家最常见的是58、52型。张东红等[6]研究发现,我国宫颈癌HPV感染以HPV16、18、58为主,特别在南方长江中下游地区,58型感染仅次于16型。本研究HPV各亚型检出率排序为HPV16(41.25%)、18(10.35%)、58(9.33%)、52(6.27%)、33(3.94%)。HPV16型和18型检出率均大于10%。logistic回归分析结果显示:CIN Ⅱ~Ⅲ的主要风险是感染HPV16、58、52、33型;宫颈癌的主要风险是感染HPV16、18、58、52型。猜测HPV16、58、52型是CINⅡ~Ⅲ和宫颈癌共同的危险因素;HPV33型可能与CINⅡ~Ⅲ关系更为密切,而感染HPV18型则可能更容易引起宫颈癌。
近年来宫颈癌的发病有明显年轻化趋势。本组宫颈癌患者最小年龄为23岁,平均年龄50.11岁。将3组患者分别分为年轻组(≤35岁)、中老年组(>35岁),发现宫颈癌组的中老年患者HPV感染率(91.88%)明显高于年轻患者(76.67%)(P<0.05),说明宫颈癌患者年龄越大的HPV感染率越高,考虑这可能与患者的免疫力下降及激素水平波动大等有关。而在对照组中,HPV感染率则是年轻患者(31.48%)高于中老年患者(19.16%)(P<0.05),可能由于年轻女性性生活较频繁,性伴侣多,且免疫系统未被致敏,易受HPV病毒感染。宫颈细胞学形态正常,但可检出HPV-DNA,相关文献称之为隐匿感染[7]。若这种HPV感染不及时消退,可能会进一步发展,导致宫颈细胞学形态改变,引起宫颈癌前病变或宫颈癌。对照组的年轻患者HPV感染率较高从另一方面也反映了宫颈癌年轻化。有文献报道,不同地域、不同民族间因为文化差异、生活习惯等因素可导致HPV感染谱不同[8]。广西是多山地区,少数民族多集中居住在边远山区。此次调查的患者中涉及多个民族,3组患者均包含有多个少数民族,如壮族、苗族、仫佬族等,本研究提示各民族HPV感染率比较无差异。
[1] 丰有吉,沈 铿,马 丁,等.妇产科学[M].北京:人民卫生出版社,2002:325-331.
[2] Ho GY,Burk RD,Klein S,et al.Persistent genital human papillomavirus infection as a risk factor for persistent cervical dysplasia[J].J Natl Cancer Inst,1995,87(18):1 365-1 371.
[3] 陶萍萍,卞美璐,李 敏,等.HPV多重感染与宫颈病变关系探讨[J].中国妇产科临床杂志,2006,7(2):94-96,127.
[4] Bosch FX,Manos MM,Muoz N,et al.Prevalence of human papillomavirus in cervical cancer:a worldwide perspective.International biological study on cervical cancer(IBSCC) Study Group[J].J Nat Cancer Inst,1995,87(11):796-802.
[5] Clifford GM,Smith JS,Plummer M,et al.Human papillomavirus types in invasive cervical cancer worldwide:a meta-analysis[J].Br J Cancer,2003,88(1):63-73.
[6] 张东红,林美珊.人乳头瘤病毒在国人宫颈病变中感染及型别分布特征的Meta分析[J].中国全科医学,2010,13(12):1 287-1 290.
[7] 乌兰娜,吴瑞芳,周艳秋,等.人乳头瘤病毒基因亚型与宫颈病变的关系[J].中国妇产科临床杂志,2005,6(5):346-350.
[8] Kahn JA,Lan D,Kahn RS.Sociodemographic factors associated with high-risk human papillomavirus infection[J].Obstet Gynecol,2007,110(1):87-95.
庞小芬(1990~),女,硕士,研究方向:妇科肿瘤。
莫凌昭(1971~)男,博士,副教授,研究方向:妇科肿瘤学,E-mail:1279512058@qq.com。
R 737.33
A
0253-4304(2016)10-1430-04
10.11675/j.issn.0253-4304.2016.10.25
2016-04-18
2016-07-22)

