三种信号通路抑制剂两两联合用药对胰腺癌细胞Panc-28和Panc-1增殖的影响
万 君,卢银忠,郑 军,吴 方,郑卫红
(1.三峡大学医学院国家中药药理科研三级实验室,湖北宜昌 443002;2.上海交通大学系统生物医学研究院,上海 200240)
三种信号通路抑制剂两两联合用药对胰腺癌细胞Panc-28和Panc-1增殖的影响
万 君1,2,卢银忠2,郑 军1,吴 方2,郑卫红1
(1.三峡大学医学院国家中药药理科研三级实验室,湖北宜昌 443002;2.上海交通大学系统生物医学研究院,上海 200240)
目的 选用表皮生长因子受体(EGFR)抑制剂厄洛替尼、Anexelekto(AXL)抑制剂R428和γ-分泌酶抑制剂(2S)-N-N-(3,5-二氟苯乙酰基)-L-丙氨酰-2-苯基甘氨酸叔丁酯(DAPT),观察两两联合用药对胰腺癌细胞增殖的影响,为指导临床用药提供参考。方法 采用Panc-28和Panc-1胰腺癌细胞,厄洛替尼、R428和DAPT单用或两两联用72 h,MTS法检测细胞增殖率,乳酸脱氢酶(LDH)法检测细胞毒性,流式细胞术检测细胞周期。结果 用厄洛替尼5~80 μmol·L-1对Panc-28细胞增殖无明显影响,DAPT 5~80 μmol·L-1或R428 50~800 nmol·L-1作用72 h可使Panc-28细胞增殖率呈浓度依赖性降低(rDAPT=0.995,P<0.01;rR428=0.833,P<0.01),最大下降约40%。厄洛替尼50 μmol·L-1,DAPT 50 μmol·L-1或R428 300 nmol·L-1分别两两联用后,与单用相比均未明显增加细胞毒性,厄洛替尼与R428联用使胰腺癌细胞增殖率较R428单用下降>40%(P<0.01)。流式细胞术检测结果表明,厄洛替尼与R428联用分别使Panc-28和Panc-1细胞S期和G1期增加(P<0.01)。结论 DAPT和R428能一定程度地抑制胰腺癌细胞Panc-28和Panc-1增殖。厄洛替尼与R428联用具有协同抑制Panc-28和Panc-1细胞增殖的作用,对细胞分裂间期阻滞更为明显。
胰腺癌;厄洛替尼;R428;细胞增殖;细胞毒性;细胞周期
胰腺癌是严重威胁人类健康的消化系统疾病之一[1]。尽管新型辅助疗法和化疗方案已取得一定疗效,但胰腺切除依然是目前治愈胰腺癌最常用的方法[2]。即便是胰腺切除成功的癌症患者,依然会有高达70%的转移复发率。因此,在诊断期内对多数患者而言,胰腺癌是一种系统性疾病,辅助化疗对胰腺切除患者显得尤为重要。据报道,辅助化疗能使10%胰腺癌患者存活时间明显延长[3]。在辅助化疗中,靶向药物治疗是最广泛也是最基本的治疗方法之一。因此,寻找新型的靶向药物以提高胰腺癌对化疗药物的敏感性已成为目前研究的重点和热点。
研究表明,表皮生长因子受体(epidermal growth factor receptor,EGFR)和 Anexelekto(AXL)受体等对肿瘤细胞的生长、增殖、迁移以及黏附发挥着重要作用[4-5]。Notch信号通路作为跨膜蛋白,对肿瘤细胞的正常代谢亦发挥着重要作用。最近有研究报道,Notch通路激活与胰腺癌治疗失败密切相关[6]。在胰腺癌细胞Panc-28和Panc-1中,以上3种蛋白均有不同程度的表达,并发挥着相关作用,共同维持肿瘤细胞的活性。作为已知的EGFR抑制剂,厄洛替尼(erlotinib)已广泛运用于癌症的治疗并取得了一定的治疗效果[7]。临床前研究表明,AXL受体在胰腺癌中高表达,抑制其表达可抑制肿瘤细胞增殖[8]。R428是选择性较好的AXL受体抑制剂,在乳腺癌小鼠模型中可阻止癌细胞转移并影响模型小鼠的新陈代谢[9]。(2S)-N-N-(3,5-二氟苯乙酰基)-L-丙氨酰-2-苯基甘氨酸叔丁酯{N-〔N-(3,5-difluorophenacetyl)-l-alanyl〕-S-phenylg⁃lycine t-butyl ester,DAPT}是已知的γ-分泌酶抑制剂,可通过抑制γ-分泌酶活性而阻断Notch信号通路,进而影响胰腺癌细胞增殖[10]。药物联合用药在癌症治疗中发挥着极其重要的作用。研究显示,在Ⅱ期临床试验中,西妥昔单抗(cetuximab)与厄洛替尼联用对结肠癌具有较好的抑制效果[11],培美曲塞(pemetrexed)与厄洛替尼联用对临床Ⅱ期EGFR突变的非鳞状非小细胞肺癌的治疗具有协同效应[12]。在治疗胰腺癌的过程中,许多药物单用并未达到预期的治疗效果,故应观察多靶点联用是否会达到满意的效果。EGFR,AXL以及Notch信号通路被认为是胰腺癌的药物靶点。本研究以EGFR、AXL和Notch受体相关的信号通路为主要研究对象,通过阻断相应的受体或通路,观察对胰腺癌细胞增殖的影响。本研究分别采用EGFR抑制剂厄洛替尼,AXL受体抑制剂R428和γ-分泌酶抑制剂DAPT单用或联用,通过阻断相应的信号通路,观察其对胰腺癌细胞Panc-28和Panc-1增殖、细胞毒性和细胞周期的影响,初步阐明其可能的作用机制,为胰腺癌的化疗及联合用药提供参考。
1 材料与方法
1.1 细胞、药物、试剂和仪器
人胰腺癌细胞Panc-28由中国科学院海洋研究所林秀坤研究员馈赠,Panc-1购自中国科学院上海细胞库。厄洛替尼购自美国Cayman Chemical公司,DAPT和R428购自美国Selleck公司。碘化丙啶和二甲亚砜(DMSO)购自美国Sigma公司,DMEM高糖培养基、胎牛血清和胰蛋白酶购自美国Invitrogen公司,CellTiter 96®AQueous One Solution Reagent和乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自美国Promega公司,多功能酶标仪购自美国BioTek公司。CO2细胞培养箱和离心机购自美国Thermo公司,恒温水槽购自上海精宏实验设备有限公司,Odyssey双色红外荧光成像系统购自美国LI-COR公司,流式细胞分选仪购自美国Beckman公司。
1.2 细胞复苏和培养
从液氮中分别取出Panc-28和Panc-1细胞冻存管,迅速置入37℃水浴锅中,使其在短时间内完全解冻,并在无菌条件下取出细胞,转移到15 mL离心管中,100×g离心5 min,弃上层液,加入适量含1%青霉素和链霉素双抗及10%胎牛血清的高糖培养基,重悬细胞,并接种到培养皿中,摇匀后在37℃,5%CO2培养箱中静置培养。次日观察细胞贴壁情况,并及时更换培养液,细胞传3代以上进行实验。
1.3 MTS法检测药物单用对Panc-28细胞增殖的影响
用DMSO配置厄洛替尼、DAPT及R428贮存液,实验时稀释至需要浓度加入培养基。取对数生长期细胞,分别用胰蛋白酶消化3~4 min后加入含有10%胎牛血清的DMEM培养基终止消化,以100×g离心5 min,弃上清,用无菌的PBS洗2遍后再用全DMEM培养基重悬细胞,取10 μL细胞悬液计数并稀释,按每孔3.5×103个细胞分别将Panc-28细胞接种到96孔板中,每孔加培养基100 μL。细胞在CO2培养箱中培养24 h后弃培养基,加入含有终浓度为5~80 μmol·L-1的厄洛替尼、终浓度为5~80 μmol·L-1的DAPT和终浓度为50~800 nmol·L-1的R428培养基(每孔100 μL)。R428针对AXL受体体外纯酶的IC50约为14 nmol·L-1,故本实验中采用纳摩尔级的给药浓度。每浓度设3复孔。同时设细胞对照组及仅含DMEM培养基的空白组。继续培养72 h后,每孔加入20 μL MTS,轻轻晃匀后在37℃,5%CO2培养箱中避光孵育1 h。取出96孔板,避光摇匀10 s,用酶标仪于490 nm波长下检测每孔的吸光度(A490nm)值,计算细胞增殖率。细胞增殖率(%)=(实验组A490nm-空白组A490nm)/(对照组A490nm-空白组A490nm)×100%。
1.4 MTS法检测联合用药对Panc-28和Panc-1细胞增殖的影响
根据厄洛替尼、DAPT和R428对Panc-28细胞的抑制作用,选取能抑制细胞增殖浓度的40%的抑制剂两两联用,观察上述3种抑制剂两两联用对Panc-28和Panc-1细胞增殖的影响。由于Panc-28易对厄洛替尼产生耐药,实验中选其浓度为50 μmol·L-1;R428在200和400 nmol·L-1浓度下抑制效果无显著差异,实验中选取300 nmol·L-1;DAPT作用效果明显,选取与厄洛替尼相同的浓度即50 μmol·L-1。Panc-28和Panc-1细胞虽然均为胰腺癌细胞,两者对3种抑制剂的敏感性可能存在差异,但本研究的重点是探索联合给药策略,故Panc-1细胞的给药浓度同Panc-28细胞。
细胞培养同1.3。Panc-28和Panc-1细胞在CO2培养箱中培养24 h后弃培养基,分为细胞对照组、DMSO溶剂对照组、厄洛替尼50 μmol·L-1、DAPT 300 nmol·L-1和R428 50 μmol·L-1单用及同浓度两两联用组,每组3复孔。药物处理组分别加入含有相应浓度厄洛替尼、DAPT和(或)R428的培养基(每孔100 μL)。细胞对照组和DMSO溶剂对照用等体积培养基代替药物。继续培养72 h后,同1.3方法用酶标仪于490 nm波长下检测每孔A490nm值,计算细胞增殖率。
1.5 LDH酶活性法检测联合用药对Panc-28和Panc-1细胞的细胞毒性
细胞处理、分组和给药同1.4。给药72 h后,取50 μL培养基于黑色96孔板中,室温静置20~30 min,使培养基温度达到室温。每孔加入LDH检测试剂盒中提供的底物50 μL,摇晃10 s。室温反应10 min后加25 μL终止液终止反应。在激发光波长540 nm、发射光波长590 nm条件下,用酶标仪读取荧光强度。
1.6 流式细胞仪检测联合用药对Panc-28和Panc-1细胞周期的影响
细胞处理、分组和给药同1.4。按1×109L-1细胞密度、每孔2 mL接种于6孔板内,给药处理48 h后收集细胞。于4℃条件下用70%乙醇将细胞样本固定2 h或过夜。用碘化丙锭染色液在37℃、避光条件下将细胞染色30 min后立即上机检测。每个样本收集细胞数量2×104,用流式细胞仪信息采集系统记录数据,并借助FACSDiva软件进行数据处理和分析。
1.7 统计学分析
实验结果数据用x±s表示,采用SPSS 18.0软件进行统计学分析。多组间数据的比较采用单因素方差分析,两组间数据的比较采用t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 厄洛替尼、DAPT和R428联合用药浓度的确定
厄洛替尼5~80 μmol·L-1作用72 h后,Panc-28细胞增殖率与细胞对照组相比无统计学差异(图1A),表明在所测定的浓度范围内厄洛替尼对Panc-28细胞增殖无明显影响。
DAPT 5~80 μmol·L-1作用72 h后,Panc-28细胞增殖率随DAPT浓度的升高而降低,呈浓度依赖性(r=0.995,P<0.01)(图1B)。与细胞对照组相比,DAPT 5 μmol·L-1时Panc-28细胞增殖率下降20%;当浓度增加到80 μmol·L-1时,细胞增殖率降低至58%(下降约40%)。表明DAPT能抑制Panc-28细胞增殖。
R428 100 nmol·L-1作用72 h,Panc-28细胞增殖率降低约10%;浓度增加到800 nmol·L-1时细胞增殖率下降约40%(图1C),表明R428同样能抑制Panc-28细胞增殖。
2.2 厄洛替尼、DAPT及R428两两联用对Panc-28和Panc-1细胞增殖的影响
根据厄洛替尼、DAPT及R428单独给药的实验结果,选取能抑制胰腺癌细胞生长的合适浓度,采用两种抑制剂联合用药方式观察对胰腺癌细胞增殖的影响。由于厄洛替尼的溶解性较低且对Panc-28细胞增殖的抑制不明显,故实验选取其最大溶解浓度50 μmol·L-1。DAPT及R428选取单独给药抑制Panc-28细胞增殖率30%~40%的浓度。
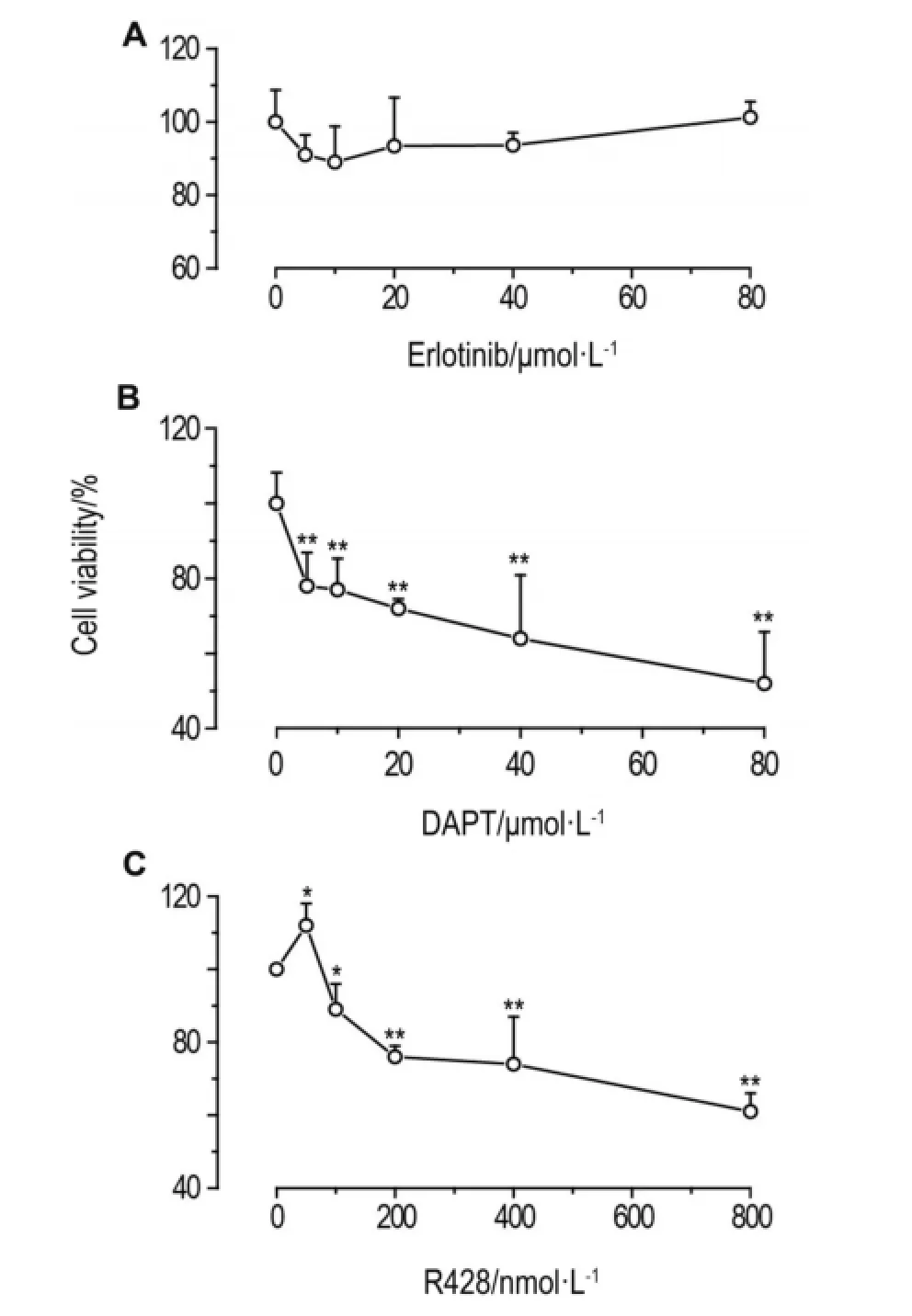
Fig 1.Effect of erlotinib(A),N-〔N-(3,5-difluorophen⁃acetyl)-l-alanyl〕-S-phenylglycine t-butyl ester(DAPT)(B)and R428(C)for 72 h on proliferation of Panc-28 cells detected by MTS method.Cell viability(%)=(experi⁃mental groupA490nm-blank groupA490nm)/(control groupA490nm-blank groupA490nm)×100%.±s,n=3.*P<0.05,**P<0.01,compared with cell control(0)group.
由图2结果可见,与细胞对照组相比,厄洛替尼和DAPT联用、或和R428联用及DAPT和R428联用均能抑制Panc-28和Panc-1细胞增殖(P<0.001)。厄洛替尼和DAPT联用与DAPT单用相比,细胞增殖率明显变化,表明厄洛替尼和DAPT联用的抑制作用主要来自于DAPT。尽管DAPT和R428联用与R428单用相比,对胰腺癌细胞增殖的抑制作用增强(细胞增殖率下降约40%),但与DAPT单用相比无明显差异,提示两药合用无协同作用,药物的作用主要来自DAPT。厄洛替尼和R428联用后,与厄洛替尼或R428单用相比,胰腺癌细胞增殖率均明显下降(P<0.01),较R428单用下降>40%,显示出良好的联用效果。
2.3 厄洛替尼、DAPT及R428两两联合用药对Panc-28和Panc-1细胞的毒性
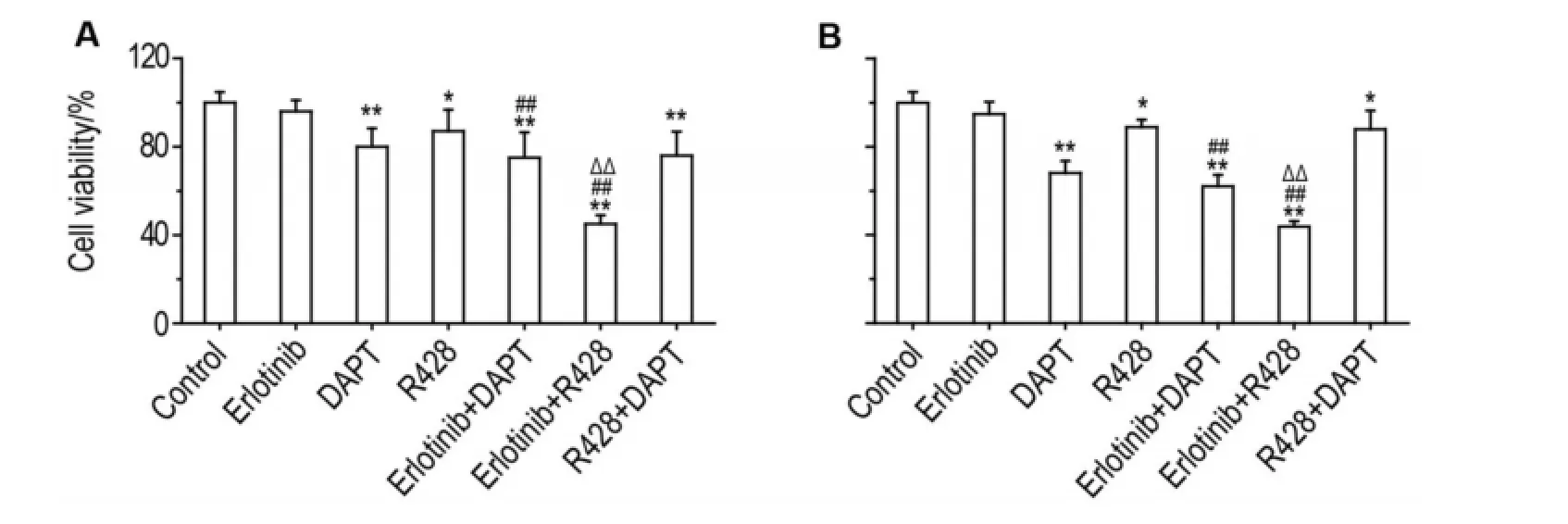
Fig.2 Effect of combination of inhibitors on proliferation of Panc-28(A)and Panc-1(B)cells detected by MTS method. Panc-28 and Panc-1 cells were treated with erlotinib(50 μmol·L-1),DAPT(50 μmol·L-1)and R428(300 nmol·L-1)for 72 h,respectively.±s,n=3.*P<0.05,**P<0.01,compared with control group;##P<0.01,compared with erlotinib alone group;ΔΔP<0.01,compared with R428 alone group.
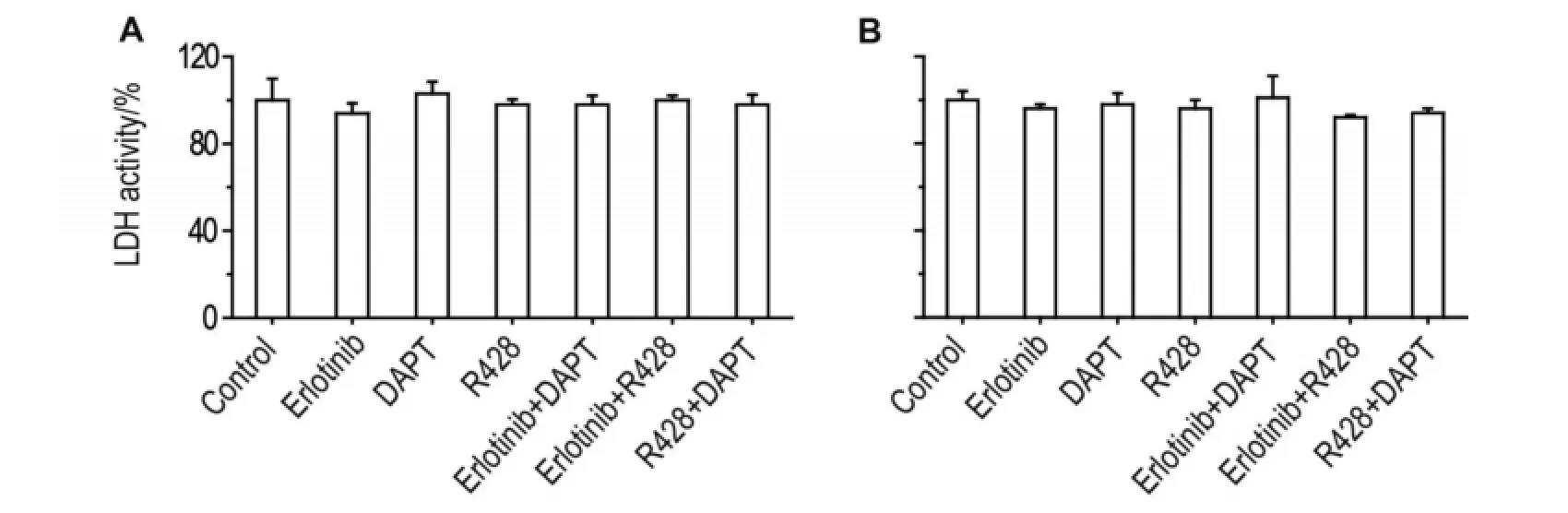
Fig.3 Cytotoxicities of combination of inhibitors for Panc-28(A)and Panc-1(B)cells detected by LDH activity assay.See Fig.2 for the cell treatment.LDH activity of control group was taken as 100%.±s,n=3.
为了观察上述抑制剂是否通过引起细胞坏死而降低细胞增殖率,用LDH活性法测定其细胞毒性。如图3所示,厄洛替尼、DAPT及R428单用或联用对Panc-28和Panc-1细胞无明显毒性,LDH活性变化<10%。提示其降低Panc-28和Panc-1细胞增殖率并非由于导致细胞坏死所致。
2.4 厄洛替尼、DAPT及R428两两联用对Panc-28和Panc-1细胞周期的影响
由图4可见,Panc-28细胞经R428单独处理48 h后,与细胞对照组相比,S期细胞百分比升高(P<0.01)。R428联合厄洛替尼或DAPT处理48 h,S期百分比与单用相比明显增加(P<0.01)。表明Panc-28细胞S期细胞增多,细胞周期阻滞在S期,细胞增殖减慢。厄洛替尼与DAPT联用组与单用组相比,各期细胞百分比均无明显变化。
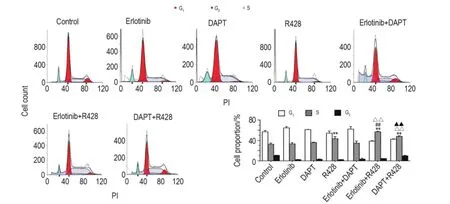
Fig.4 Effect of combination of inhibitors on Panc-28 cell cycle detected by flow cytomtry.Panc-28 cells were treat⁃ed with erlotinib,DAPT and R428 for 48 h,respectively.±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with erlotinib alone group;△△P<0.01,compared with R428 alone group;▲▲P<0.01,compared with DAPT alone group.
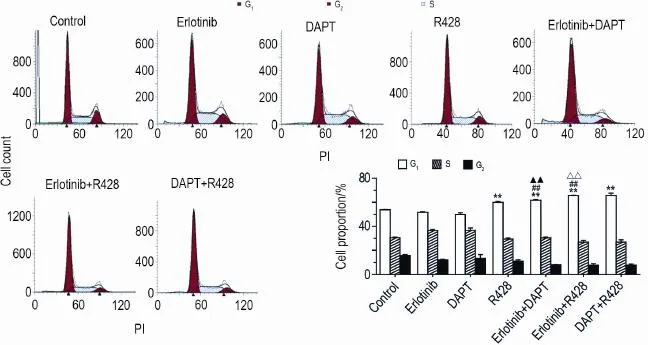
Fig.5 Effect of combination of inhibitors on Panc-1 cell cycle detected by flow cytometry.Panc-1 cells were treated with erlotinib,DAPT and R428 for 48 h,respectively.±s,n=3.**P<0.01,compared with control group;##P<0.01,compared with erlo⁃tinib alone group;△△P<0.01,compared with R428 alone group;▲▲P<0.01,compared with DAPT alone group.
由图5可见,Panc-1细胞给药刺激48 h后,R428和DAPT单用组G1期细胞百分比与细胞对照组相比明显增加(P<0.01);R428与厄洛替尼和DAPT联用组与R428单用组相比,G1期细胞百分比进一步增加(P<0.01)。厄洛替尼单用作用不明显。表明联用对Panc-1细胞有G1期阻滞作用。各组G2期和S期细胞百分比无明显变化。
3 讨论
厄洛替尼作为EGFR酪氨酸激酶抑制剂广泛用于非小细胞肺癌的治疗,但随着病情的恶化易产生耐药性[14]。本研究结果表明,厄洛替尼单用后,Panc-28细胞增殖率并无明显变化,提示EGFR抑制剂厄洛替尼在本研究浓度范围不能抑制Panc-28胰腺癌细胞增殖。尽管过表达的EGFR信号通路被证实参与了癌细胞的增殖、迁移、血管生成及新陈代谢[15],但仅阻断EGFR对胰腺癌Panc-28细胞的增殖作用有限。因为细胞可通过磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(phosphaty-dylinositol 3 kinase/serine-threonine kinase,PI3K/AKT)、Ras/ Raf/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及Janus激酶/信号传导和转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)途径激活EGFR下游信号通路,使细胞绕过正常的EGFR调节而增殖。PI3K/AKT信号通路是介导多种生长因子促细胞增殖的主要通路。研究发现,约61%胰腺癌K-Ras发生了突变,从而导致依赖于EGFR的PI3K/AKT和 MEK/ERK下游信号的激活[16-17]。因此,可能需要阻断EGFR及其他通路介导的PI3K/AKT等下游信号才能有效抑制Panc-28细胞增殖。
AXL受体是酪氨酸激酶家族成员之一。AXL信号能刺激细胞反应,包括PI3K/AKT的活化、促分裂原活化蛋白激酶ERK和P38的活化以及NF-κB通路、STAT信导传导和转录的活化[18]。此外,AXL信号通路还与癌细胞的侵袭、迁移、增殖、血管生成、对化疗药物和靶向药物的抵抗以及细胞增殖等生物学效应密切相关[19],并在胰腺导管腺癌中得到证实[20]。本研究结果表明,单用AXL受体抑制剂R428能浓度依赖性地抑制Panc-28细胞增殖。最近研究结果显示,AXL通过激活EGFR/PKC/mTOR通路从而介导PI3Ka抑制剂在食管鳞癌的耐药性[21]。在多形性成胶质细胞瘤中,R428也被证实能选择性地抑制AXL的活性及其下游信号[22]。因此,EGFR和AXL信号通路抑制剂的联用可以阻断肿瘤细胞的核心信号通路PI3K/AKT等,从而达到治疗肿瘤的目的。本研究结果也表明,厄洛替尼与R428联用可使Panc-28和Panc-1细胞周期阻滞于S期或G1期,协同性地增强对胰腺癌细胞增殖的抑制,较单用的抑制率提高约40%。
尽管确切的机制尚不清楚,但Notch信号通路的活化被认为是引起胰腺癌发生的重要因素[23]。Notch信号通路再激活参与了胰腺导管腺癌的起始、发展和维持[24]。据报道,通过γ-分泌酶抑制剂或Hes1小发夹RNA(shRNA)抑制胰腺癌细胞中Notch的表达可减少瘤体积和肿瘤干细胞的百分比;相反,通过增加外源Notch配体等方法激活Notch,可增加肿瘤干细胞的百分比及实体瘤的形成[25]。Notch作为γ-分泌酶的底物能被该酶识别并剪切,产生Notch受体细胞内域(Notch receptor intracellular domain)而发挥相应的功能。因此,γ-分泌酶是影响Notch代谢的关键酶。DAPT作为γ-分泌酶抑制剂已被广泛运用于各种分子或细胞实验中。本研究结果表明,DAPT能浓度依赖性地抑制胰腺癌Panc-28细胞增殖。该结果进一步表明Notch信号通路参与了胰腺癌细胞的增殖,阻断Notch通路可抑制胰腺癌细胞增殖。
本研究结果表明,与单独给药相比,两两联用后Panc-28和Panc-1细胞增殖能力均有不同程度的下降,说明联用以EGFR,AXL及Notch信号通路为作用靶点的抑制剂比单用效果更好。尤其以厄洛替尼与R428联用对胰腺癌细胞的抑制效果最明显。这与文献关于AXL过表达能引起厄洛替尼耐药性的报道[26]相吻合。当抑制AXL受体的表达后,EGFR抑制剂的作用更明显。本研究检测结果表明,Panc-28细胞给药处理后主要引起S期细胞百分比升高,Panc-1细胞给药处理后G1期细胞百分比升高,这可能与两种细胞在形态、传代时间及周期性等方面存在一定的差异有关。上述结果提示,上述3种抑制剂能抑制胰腺癌细胞的分裂,将细胞周期阻滞在分裂间期。
综上所述,本研究从细胞水平检测了厄洛替尼、R428和DAPT 3种抑制剂对胰腺癌细胞的作用。结果表明,R428和DAPT可浓度依赖性地抑制胰腺癌细胞的增殖,其作用可能与阻断AXL受体和Notch通路有关。厄洛替尼与R428联用后作用较单用时明显增强,二者联用效果大于单用效果之和,表明其对胰腺癌细胞增殖的抑制具有协同效应,对细胞周期阻滞作用更为明显。本研究3种药物作用靶点不同,提示多作用靶点的药物对胰腺癌细胞的抑制效果可能更好,这一结果为指导临床用药提供了一定的参考。
[1]Jemal A,Siegel R,Xu JQ,Ward E.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2]Biankin AV,Waddell N,Kassahn KS,Gingras MC,Muthuswamy LB,Johns AL,et al.Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes[J].Nature,2012,491(7424):399-405.
[3]Werner J,Combs SE,Springfeld C,Hartwig W,Hackert T,Büchler MW.Advanced-stage pancre⁃atic cancer:therapy options[J].Nat Rev Clin Oncol,2013,10(6):323-333.
[4]Verma A,Warner SL,Vankayalapati HA,Sharma S. Targeting Axl and Mer kinases in cancer[J].Mol Cancer Ther,2011,10(10):1763-1773.
[5]Pierce AM,Keating AK.TAM receptor tyrosine kinases:expression,disease and oncogenesis in the central nervous system[J].Brain Res,2014,1542(2):206-220.
[6]Lee JY,Song SY,Park JY.Notch pathway activa⁃tion is associated with pancreatic cancer treatment failure[J].Pancreatology,2014,14(1):48-53.
[7]Ni X,Suhail MM,Yang Q,Cao A,Fung KM,Postier RG,et al.Frankincense essential oil prepared from hydrodistillation ofBoswellia sacragum resins induces human pancreatic cancer cell death in cultures and in a xenograft murine model[J].BMC Complement Altern Med,2012,12(1):253-267.
[8]Leconet W,Larbouret C,Chardès T,Thomas G,Neiveyans M,Busson M,et al.Preclinical valida⁃tion of AXL receptor as a target for antibody-based pancreatic cancer immunotherapy[J].Oncogene,2014,33(47):5405-5414.
[9]Holland SJ,Pan A,Franci C,Hu Y,Chang B,Li W,et al.R428,A selective small molecule inhibitor of Axl kinase,blocks tumor spread and prolongs survival in models of metastatic breast cancer[J].CancerRes,2010,70(4):1544-1554.
[10]Du X,Cheng Z,Li Y, Zhou ZG,Yang L,Zhang MM.Suppressive effects of γ-secretase inhibitor DAPT on the proliferation of pancreatic cancer cell[J].J Sichuan Univ(Med Sci Edi)〔四川大学学报(医学版)〕,2013,44(5):699-702.
[11]Weickhardt AJ,Price TJ,Chong G,Gebski V,Pavlakis N,Johns TG,Azad A,et al.Dual targeting of the epidermal growth factor receptor using the combination of cetuximab and erlotinib:preclinical evaluation and results of the phaseⅡ DUX study in chemotherapy-refractory,advanced colorectal cancer[J].J Clin Oncol,2012,30(13):1505-1512.
[12]Minami S,Kijima T,Hamaguchi M,Nakatani T,Koba T,Takahashi R,et al.PhaseⅡ study of pemetrexed plus intermittent erlotinib combination therapy for pretreated advanced non-squamous non-small cell lung cancer with documentation ofepidermal growth factor receptor mutation status[J].Lung Cancer,2013,82(2):271-275.
[13]ApelqvistA, LiH,SommerL,BeatusP,Anderson DJ,Honjo T,et al.Notch signalling con⁃trols pancreatic cell differentiation[J].Nature,1999,400(6747):877-881.
[14]Wang L,Li MC.Advances in epidermal growth factor receptor-tyrosine kinase inhibitor combination therapy in non-small cell lung cancer[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2015,29(4):638-642.
[15]Seshacharyulu P,Ponnusamy MP,Haridas D,Jain M,Ganti AK,Batra SK.Targeting the EGFR signaling pathway in cancer therapy[J].Expert Opin Ther Targets,2012,16(1):15-31.
[16]Lu Y,Jin Y,Sui HJ,Liu Z,Qu WH,Yu SX,Jin YX,et al.Sarsasapogenin inhibits amyloid beta-protein induced decrease of synaptophysin in hippocampal neurons of neonatal rats via up-regu⁃lating PI3K/Akt/GSK3 pathway[J].Chin J Phar⁃macol Toxciol(中国药理学与毒理学杂志),2013,27(4):635-640.
[17]Prior IA,Lewis PD,Mattos C.A comprehensive survey of Ras mutations in cancer[J].Cancer Res,2012,72(10):2457-2467.
[18]Hafizi S,Dahlbäck B.Signalling and functional diversity within the Axl subfamily of receptor tyro⁃sine kinases[J].Cytokine Growth Factor Rev,2006,7(4):295-304.
[19]Linger RM,Keating AK,Earp HS,Graham DK. TAM receptor tyrosine kinases:biologic functions,signaling,and potential therapeutic targeting in human cancer[J].Adv Cancer Res,200,100:35-83.
[20]Song XZ,Wang H,Logsdon CD,Rashid AA, Abbruzzese JL,Gomez HF,et al.Overexpression of receptor tyrosine kinase Axl promotes tumor cell invasion and survival in pancreatic ductal adeno⁃carcinoma[J].Cancer,2011,117(4):734-743.
[21]Elkabets M,Pazarentzos E,Juric D,Sheng Q,Pelossof RA,Brook S,et al.AXL mediates resis⁃tance to PI3Kα inhibition by activating the EGFR/ PKC/mTOR axis in head and neck and esopha⁃geal squamous cell carcinomas[J].Cancer Cell, 2015,27(4):533-546.
[22]Vouri M,An Q,Birt M,Pilkington GJ,Hafizi S. Small molecule inhibition of Axl receptor tyrosine kinase potently suppresses multiple malignant properties of glioma cells[J].Oncotarget,2015,6(18):16183-16197.
[23]Hu YF,Su HX,Li X,Guo GL,Cheng LA,Qing GL,et al.The NOTCH ligand JAGGED2 pro⁃motes pancreatic cancer metastasis Independent of NOTCH signaling activation[J].Mol Cancer Ther,2015,14(1):289-297.
[24]Subramaniam D,Ponnurangam S,SayedA,Dhar A,Dixon AD,Tawfik O,et al.Quinomycin a affects pancreatic cancerstem cells in part through suppression of Notch signaling pathway[J].Cancer Res,2015,75(15 Suppl):4214.
[25]Abel EV,Kim EJ,Wu J,Hynes M,Bednar F,Proctor E,et al.The Notch pathway is important in maintaining the cancer stem cell population in pancreatic cancer[J].PLoS One,2014,9(3):e91983.
[26]Zhang Z,Lee JC,Lin L,Olivas V,AuV,LaFramboise T,et al.Activation of the AXL kinase causes resistance to EGFR-targeted therapy in lung cancer[J].Nat Genet,2012,44(8):852-860.
Effect of combination of two of three signal pathway inhibitors on proliferation of Panc-28 and Panc-1 pancreatic cancer cells
WAN Jun1,2,LU Yin-zhong2,ZHENG Jun1,WU Fang2,ZHENG Wei-hong1
(1.The Third-level Pharmacological Laboratory of State Administration of Traditional Chinese Medicine,Medical Science College of China,Three Gorges University,Yichang 443002,China;2.Shanghai Center for Systems Biomedicine,Shanghai Jiaotong University,Shanghai 200240,China)
OBJECTIVE To observe the effect of three signal pathway inhibitors:epidermal growth factor receptor(EGFR)inhibitor erlotinib,Anexelekto(AXL)inhibitor R428 and γ-secretaseinhibitor N-〔N-(3,5-difluorophenacetyl)-l-alanyl〕-S-phenylglycine t-butyl ester(DAPT),on the proliferation of pancreatic cancer cells when any two of them are used in combination in order to offer experimental evidence for clinical medication.METHODS Panc-28 and Panc-1 cell lines were selected in this experi⁃ment.Erlotinib,R428 and DAPT were administered alone or in combination for 72 h before MTS assay was used to detect cell proliferation.Lactate dehydrogenase(LDH)activity assay was used to investi⁃gate the cytotoxicities.The flow cytometry was used to evaluate the cell cycle.RESULTS Erlotinib 5-80 μmol·L-1alone had no significant effect on the proliferation of Panc-28 cells,whereas DAPT 5-80 μmol·L-1or R428 50-800 nmol·L-1inhibited the proliferation of Panc-28 cells in a concentrationdependent manner(rDAPT=0.995,P<0.01;rR428=0.833,P<0.01)after being treated for 72 h.Compared with single use,the combination of two of the three inhibitors(erlotinib 50 μmol·L-1,DAPT 50 μmol·L-1,R428 300 nmol·L-1)inhibited the Panc-28 and Panc-1 cell proliferation but didn′t cause more cytotoxicity. Erlotinib and R428 in combination inhibited the proliferation rate of two pancreatic cancer cells by more than 40%compared with R428 used alone(P<0.01).In erlotinib and R428 combination group,cell cycle of Panc-28 and Panc-1 cells at S and G1was increased(P<0.01).CONCLUSION DAPT and R428 can inhibit the proliferation of pancreatic cancer cells to some extent.The combination of erlotinib and R428 has a synergistic inhibitory effect on proliferation of pancreatic cancer cells.
pancreatic cancer;erlotinib;R428;cell proliferation;cytotoxicity;cell cycle
ZHENG Wei-hong,E-mail:zwh20110606@163.com,Tel:(0717)6397501
R966
A
1000-3002-(2016)11-1156-08
10.3867/j.issn.1000-3002.2016.11.005
Foundation item:The project supported by National Natural Science Foundation of Chna(31270853);and Graduate Research Innovation Fund of Three Gorges University
2016-03-17接受日期:2016-11-01)
(本文编辑:齐春会)
国家自然科学基金项目(31270853);三峡大学研究生科研创新基金项目
万 君,硕士研究生主要从事分子药理学研究。
郑卫红,E-mail:zwh20110606@163.com,Tel:(0717)6397501

