药物亲和反应的靶点稳定性技术及其应用研究进展
徐 朝,顾伟桢,邓建平,许启泰,许 君
(1.河南农业大学生命科学学院,河南 郑州450002;2.海南绿槟榔科技发展有限公司,海南万宁 571500)
药物亲和反应的靶点稳定性技术及其应用研究进展
徐 朝1,顾伟桢1,邓建平2,许启泰2,许 君1
(1.河南农业大学生命科学学院,河南 郑州450002;2.海南绿槟榔科技发展有限公司,海南万宁 571500)
药物靶标是指存在于组织细胞内与药物相互作用,并赋予药物效应的特定分子,>98%药物靶标为蛋白质。药物与细胞内靶标相互作用,是药物发挥作用的基础。如何综合运用多种研究方法发现和确证药物作用新靶标是目前研究者面临的重要挑战。药物亲和反应的靶点稳定性(DARTS)技术是根据小分子药物与其靶标蛋白结合后导致对蛋白酶敏感性下降而发展起来的一项新技术,由于无需药物保护性修饰且无药物活性依赖性,因此可广泛应用于药物筛选与靶标鉴定。本文对DARTS技术的发现、技术原理及方法要点和应用进行综述。
药物亲和反应的靶点稳定性;药物筛选;靶标鉴定;蛋白酶
药物筛选是发现有效治疗人类疾病药物的基础,而药物靶标的发现和验证是新药研发的第一步,也是药物筛选及药物定向合成成败的关键因素之一[1-2]。小分子药物除能解除疾病给人们带来的痛苦,提高健康水平之外,也在社会经济发展中发挥着重要作用。这类进入细胞与特定的靶标分子结合、借助靶标分子起到特定防治作用,是药物发挥作用的基础[3-6]。此外,小分子药物在病毒性疾病的治疗中占据很重要的地位[6-7]。亲和色谱、同位素示踪法和紫外及荧光光谱等物理学或化学技术在药物靶标寻找与鉴定中发挥重要作用[8]。但随着对药物研发要求的不断提高,新药研发与药物靶标研究正面临挑战,传统的药物筛选方法和药物靶标鉴定技术亟待创新[9]。近年来,随着基因组学[10]、蛋白质组学[11-13]及生物信息学[14-15]等多项技术的应用和发展,先后出现了多种研究技术相结合的一些新技术。药物亲和反应的靶点稳定性(drug affinity responsive target stability,DARTS)技术就是新近发现的一项用于小分子药物筛选及靶标寻找的新技术[16]。
1 DARTS技术的发现
DARTS的概念最初于2009年提出,根据基因启动子研究中特异性的DNA结合位点与其相应的转录因子结合后具有抗DNA酶降解这一特性,Lomenick等[16]推测药物与靶标蛋白结合后可能使靶标具有蛋白酶抗性,并以K506结合蛋白12为研究对象,用两种与之具有较强结合活性的免疫抑制剂他克莫司(普乐可复,tacrolimus,FK506)和西罗莫司(雷帕霉素,sirolimus,Rapamycin),将枯草杆菌(Bacillus subtilis)蛋白酶作为工具酶,证实了他们的推测。同时,这一推测又在低特异性药物E4与雷帕霉素靶分子(mammalian target of rapamy⁃cin,mTOR)相互作用后具有抗嗜热菌蛋白酶降解中得到证实。由此开启了DARTS在药物筛选和靶标鉴定的研究。
2 DARTS技术中常用的蛋白酶
DARTS反应体系中加入合适浓度的蛋白酶是该技术操作的关键点之一。目前报道的可应用于DARTS技术的蛋白酶主要有3类,分别是枯草杆菌蛋白酶[16]、嗜热菌(B.kaustophilus)蛋白酶[17-19]和链酶菌(streptomyces)蛋白酶[6,20-23]。
2.1 枯草杆菌蛋白酶
枯草杆菌蛋白酶是最早从枯草芽孢杆菌中得到的一系列丝氨酸蛋白酶混合体,在一定条件下,通过活性位点丝氨酸残基对肽键的亲核进攻而快速地催化蛋白质的水解,分子质量为20~45 ku。此外,其他一些芽孢杆菌如解淀粉芽孢杆菌(B.amylo⁃liquefaciens)等也可分泌该蛋白酶。目前,该枯草杆菌蛋白酶广泛应用于化工、医药和酿造等多个领域。由于其具有较强的蛋白水解活性且成分复杂,并要求碱性条件下操作,在DARTS中受到限制,后逐渐被嗜热菌蛋白酶和链霉菌蛋白酶所取代。
2.2 嗜热菌蛋白酶
嗜热菌蛋白酶是由嗜热细菌产生的一种具有低切割活性的胞外耐高温金属蛋白酶,结构中有4个Ca2+,钙和锌为酶的辅因子,可水解蛋白N端疏水性氨基酸残基,pH 5.0~9.5保持稳定活性,最佳反应温度为70℃,最适作用pH 8.0[17,24]。该酶仅能对非折叠状态的蛋白多肽链进行有效切割,由于可产生短片段的一系列多肽,可用于蛋白质的氨基酸序列测定。在DARTS实验中,嗜热菌蛋白酶可在标准反应条件下水解细胞的多种蛋白,但在小分子与非靶标蛋白结合后其稳定性大大提高,不利于降解,需更换为链酶菌蛋白酶。
2.3 链霉菌蛋白酶
链霉菌蛋白酶是从灰色链霉菌(S.griseus)中分离到的一种丝氨酸酶和酸性蛋白酶的胞外蛋白酶混合物,可特异性地切割折叠和非折叠态蛋白和多肽链的天冬氨酸和谷氨酸的羧基侧肽键[25],在中性pH下具有较强活性。在新型药物靶标筛选实验中,是DARTS技术发明者优先推荐使用的蛋白酶。
3 DARTS操作流程
DARTS实验的具体过程并不复杂,在蛋白酶水解细胞裂解前后,都需要一些特定的方法或技术检测蛋白酶解效果,在实际操作中常借助一种甚至多种蛋白质研究技术,如较为常用的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)和考马斯亮蓝凝胶染色,以及蛋白二维电泳2D-PAGE、凝胶或非凝胶质谱(gel-based or gel-free MS-based pro⁃teomics)和亲核色谱等。现以哺乳动物细胞裂解的DARTS为例,具体操作技术路线见图1。
3.1 主要试剂的准备
DARTS是一项较为灵敏的蛋白质鉴定技术,对实验条件的要求较高,实验中的一些关键试剂的选择尤为重要,蛋白酶、细胞裂解液和缓冲液的选择和使用是决定DARTS是否成功的关键因素。为了保证实验体系的稳定性,最好采用商品化的缓冲液,如M-PER裂解缓冲液,适用于多种细胞系的小分子结合鉴定实验,其他的如以NP-40温和变性剂为成分的非变性裂解液也可用,要尽量避免使用含有强变性剂的RIPA裂解液。同时,反应中最好含有合适的蛋白酶抑制剂防止细胞裂解液自身降解。
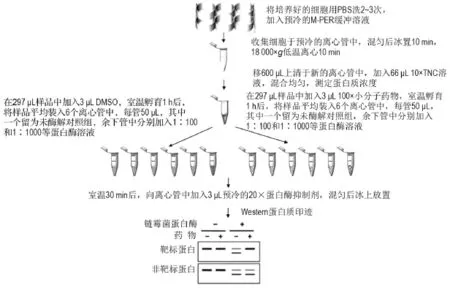
图1 利用药物亲和反应的靶点稳定性技术鉴定细胞裂解液中药物靶标的技术路线.
3.2 细胞收集和裂解
将培养好的细胞用预冷的磷酸盐缓冲液(PBS)清洗2~3次,然后加入预冷的M-PER缓冲液(含有磷酸化酶和蛋白酶抑制剂),用细胞刮铲将细胞轻轻刮下,置于预冷的离心管内上下颠倒几次,混匀后于冰上静置裂解10 min。
3.3 制备细胞裂解液
将预冷的细胞液于18 000×g低温高速离心10 min,将上清转移至新的离心管,按比例加入酶蛋白反应缓冲液,如链酶菌蛋白酶需含有钙离子的TNC缓冲液(Tris 50 mmol·L-1,NaCl 140 mmol·L-1,CaCl210 mmol·L-1),用牛血清白蛋白测定试剂盒测定裂解液的蛋白质浓度。根据蛋白质浓度,吸取适当裂解液,将裂解液蛋白质浓度调整为4~6 g·L-1,然后将裂解液平分为2份。
3.4 药物与裂解液孵育结合
对照管中加入二甲亚砜,药品管中加入合适浓度的小分子药物,混匀后于室温结合1 h,或低温过夜结合。
3.5 蛋白酶解
预先配好蛋白酶储存液(10 g·L-1),临用前用TNS稀释至适当浓度(根据蛋白酶与裂解液中总蛋白质的比例如1∶100,1∶1000和1∶2000等稀释)。将每组样品分为5份,每份样品均留1/2作为非酶解对照,按比例加入蛋白酶后,用计时器精确计时1~30 min,30 min后加入20倍蛋白酶抑制剂或直接加入蛋白胶上样缓冲液终止反应,将反应管置于冰上或放入开水中煮沸。
3.6 结合蛋白的鉴定
需依据实验要求采用SDS-PAGE和Western蛋白质印迹等多种方法检测并鉴定结合蛋白。
4 DARTS技术在药物靶标鉴定中的应用
4.1 抗癌药物及其靶标研究
4.1.1 乳腺癌
三阴性乳腺癌(triple negative breast cancer,TNBC)是指雌激素受体、孕激素受体和人表皮生长因子受体2(Her-2)均为阴性的乳腺癌,临床上只能采用放疗和化疗。Robinson等[12]采用高通量筛选方法,从3185种化合物中筛选出双硫仑(戒酒硫,disnlfiram)具有抑制多种TNBC细胞生长的作用。DARTS实验结果揭示了其直接作用靶标为含IO基序的GTP酶激活蛋白1和肌球蛋白重链9。
4.1.2 直肠癌
葡萄籽提取物(grape seed extract,GSE)具有多种生物学活性。Derry等[26]利用人结直肠癌细胞(human colorectal cancer cells,CRC),采用DARTS技术与液相色谱/质谱联用(liquid chroma⁃tography-mass spectrometry,LC/MS)和MASCOT(蛋白质质谱)数据分析方法,分析了GSE可通过内质网应激蛋白导致翻译相关蛋白的整体下调,并强烈抑制磷脂酰肌醇3-激酶-mTOR信号通路。
4.1.3 哌嗪类药物抗癌机制研究
Kost等[18]利用DARTS技术和同位素标记法证实哌嗪类(piperazines)小分子RX-5902可通过与Y593磷酸化的p68 RNA解旋酶结合,从而下调了β-链蛋白信号通路中c-myc、细胞周期蛋白D1(cyclin D1)和p-c-jun等一系列基因的表达,进而抑制癌细胞的生长,揭示了其抗癌效应的分子机制。
4.2 细胞自噬相关研究
4.2.1 α-酮戊二酸作用靶标研究
α-酮戊二酸(α-ketoglutarate,α-KG)是三羧酸循环中的重要的代谢中间产物。Chin等[23]发现,α-KG可延长线虫的寿命;DARTS实验结果显示,α-KG的作用靶标为ATP合成酶的β亚基,α-KG与ATP酶亚基结合后,其ATP合成能力下降,减少了氧的消耗,增加了实验中线虫和哺乳动物细胞的自噬作用,揭示了α-KG这一关键代谢物介导长寿的机制。
4.2.2 二氯乙酸盐作用靶标研究
二氯乙酸盐(dichloroacetate,DCA)是丙酮酸脱氢酶的抑制剂。近来发现其有望作为无毒的抗肿瘤药物,但具体机制仍不明确。Gong等[19]研究表明,DCA可诱导LoVo细胞自噬体的形成,将DARTS技术与电喷雾液质联用四级杆飞行时间串联质谱并用,表明DCA可通过组织蛋白酶D和硫氧还蛋白样蛋白1(thioredoxin-like protein 1)导致活性氧不正常聚集,以及自噬作用最重要的负性调控通路Akt-mTOR受到抑制。
4.3 抗病毒药物作用靶标研究
Fleta-Soriano等[21]发现一种黏细菌代谢产物Ratjadone A具有体外抑制人免疫缺陷病毒HIV感染的作用,并采用DARTS技术分析其作用靶标。结果显示,ratjadone A可通过结合核输出蛋白1/染色体区域稳定蛋白1(CRM1/Exportin1)从而抑制CRM1-蛋白表达调节因子-病毒颗粒蛋白表达调节因子(CRM1-Rev-ES)复合物的形成,干扰了CRM1/Exportin1对蛋白表达调节因子(Rev)蛋白中亮氨酸富集区信号的识别,从而抑制了HIV非剪接或部分剪接的mRNA基因组的核输出。
5 结语
DARTS技术作为一种药物筛选和靶标研究具有极其重要的意义,在生物医学研究方面具有较好的应用前景。未来与之相关的研究将会融合基因组学、蛋白质组学、色谱及质谱等相关技术,在蛋白降解组学、反应条件研究和新药筛选等多个方面开展,也必将有大批的科研成果出现。
[1]Zhou TT,Zeng HH,Qiu DW.Advance in methods of small molecular drug target discovery[J].Curr Biotechnol(生物技术进展),2011,01(1):38-44.
[2]Zhou W,Wang YH,Lu AP,Zhang G.Systems pharmacology in small molecular drug discovery[J].Int J Mol Sci,2016,17(2):246.
[3]Tsuji A.Small molecular drug transfer across the blood-brain barrier via carrier-mediated transport systems[J].NeuroRx,2005,2(1):54-62.
[4]Smith TK, Young BL,Denton H,Hughes DL,Wagner GK.First small molecular inhibitors ofTry⁃panosoma bruceidolicholphosphate mannose syn⁃thase(DPMS),a validated drug target in African sleeping sickness[J].Bioorg Med Chem Lett,2009,19(6):1749-1752.
[5]Grünberger C,Wyles DL,Kaihara KA,Schooley RT. 3-Drug synergistic interactions of small molecular inhibitors of hepatitis C virus replication[J].J Infect Dis,2008,197(1):42-45.
[6]Karpus WJ,Reynolds N,Behanna HA,Watterson DM.Inhibition of experimental autoimmune enceph⁃alomyelitis by a novel small molecular weight proin⁃flammatory cytokine suppressing drug[J].J Neuro⁃immunol,2008,203(1):73-78.
[7]Zeng XY,Lu L,Jiang SB,Liu SW.Small molecular agents againstMERS-CoV infection[J].Acta Pharm Sin(药学学报),2015,50(12):1520-1526.
[8]Chen GQ,Xu YB,Guo M.Innovative drugs and drug targets:Opportunities and Challenges[J].Foreign Med Sci Physiol Pathol Clin Med(国外医学·生理、病理科学与临床分册),2004,24(3):205-207.
[9]Guo ZR.Drug innovation and reverse thinking[J].Acta Pharm Sin(药学学报),2016,51(3):325-331.
[10]Hoon S, Smith AM,Wallace IM,Suresh S,Miranda M,Fung E,et al.An integrated platform of genomic assays reveals small-molecule bioactiviti[J].Nat Chem Biol,2008,4(8):498-506.
[11]Huang J,Zhu H,Haggarty SJ,SpringDR,Hwang HA,Snyder M,et al.Finding new compo⁃nents of the target of Rapamycin(TOR)signaling network through chemical genetics and proteome chips[J].Proc Natl Acad Sci USA,2004,101(47):16594-16599.
[12]Robinson TJ,Pai M,Liu JC,Vizeacoumar F,Sun T,Egan SE,et al.High-throughput screen identifies disulfiram as a potential therapeutic for triple-negative breastcancercells Interaction with IQ motifcontaining factors[J].Cell Cycle,2013,12(18):3013-3024.
[13]Geng Y,Deng ZP.Application of proteomics to screening biomarkers of drug-induced liver injury[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2016,30(4):381-388.
[14]Jiang Z,Zhou Y.Using bioinformatics for drug target identification from the genome[J].Am J Pharmacogenom,2005,5(6):387-396.
[15]Haag N,Velk K,McCune T,Wu C.Bioinformatics and molecular biological characterization of a hypo⁃thetical protein SAV1226 as a potential drug target formethicillin/vancomycin-Staphylococcus aureusinfections[J].World Acad Sci Eng Technol,2015,9(6):587-591.
[16]Lomenick B,Jung G,Wohlschlegel JA,Huang J. Target identification using drug affinity responsive target stability(DARTS)[J].Curr Protoc Chem Biol,2011,3(4):163-180.
[17]Conejerolara F,Mateo PL.Presence of a slow dimerization equilibrium on the thermal unfolding of the 205-316 thermolysin fragment at neutral pH[J].Biochemistry,1996,35(11):3477-3486.
[18]Kost GC,Yang MY,Li LW,Zhang YW,Liu CY,Kim DJ,et al.A novel anti-cancer agent,1-(3,5-dimethoxyphenyl)-4-〔(6-fluoro-2-methoxyquinoxalin-3-yl)aminocarbonyl〕piperazine(RX-5902),inter⁃feres with-catenin function through Y593 phosphop68 RNA helicase[J].J Cell Biochem,2015,116(8):1595-1601.
[19]Gong F,Peng X,Sang Y,Qiu M,Luo C,He Z,et al.Dichloroacetate induces protective autophagy in LoVo cells:involvement of cathepsin D/thioredoxinlike protein 1 and Akt-mTOR-mediated signaling[J].Cell Death Dis,2013,4:e913.
[20]Kobet RA,Pan X,Zhang B,Pak SC,Asch AS,Lee MH.A model system for anti-cancer drug discovery and therapeutic targe tidentification[J].Biomol Ther(Seoul),2014,22(5):371-383.
[21]Fleta-Soriano E, Martinez JP, Hinkelmann B,Gerth K,Washausen P,Diez J,etal.The myxobacterial metabolite ratjadone A inhibits HIV infection by blocking the Rev/CRM1-mediated nuclear export pathway[J].Microb Cell Fact,2014,13:17.
[22]Chin RM,Fu XD,Pai MY,Vergnes L,Hwang H,Deng G,et al.The metabolite alpha-ketoglutarate extends lifespan by inhibiting ATP synthase and TOR[J].Nature,2014,510(755):397-401.
[23]Lomenick B,Olsen RW,Huang J.Identification of direct protein targets of small molecules[J].ACS Chem Biol,2011,6(1):34-46.
[24]Inouye K,Lee SB,Tonomura B.Effect of amino acid residues at the cleavable site of substrates on the remarkable activation of thermolysin by salts[J].Biochem J,1996,315(Pt 1):133-138.
[25]Bauer CA,Löfqvist B.Studies of the heterogeneity ofStreptomyces griseusprotease.Isolation and char⁃acterization of an alkaline serine protease from commercial pronase-P derived fromStreptomyces griseusK1[J].Acta Chem Scand,1973,27(9):3147-3166.
[26]Derry MM,Somasagara RR,Raina KA,Gomez J,Patel M,Agarwal RA.Target identification of grape seed extract in colorectal cancer using drug affinity responsive target stability(DARTS)tech⁃nique:role of endoplasmic reticulum stress response proteins[J].Curr Cancer Drug Targets,2014,14(4):323-336.
Drug affinity responsive target stability and its application:review
XU Zhao1,GU Wei-zhen1,DENG Jian-ping2,XU Qi-tai2,XU Jun1
(1.School of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China;2.Hainan Green Areca Technology Development Co.,Ltd,Wanning 571500,China)
A drug target refers to specific molecules that exist within tissue cells and interact with a drug to produce the drug effect.More than 98%of drug targets belong to protein.The interactions between a drug and the target in cells play a key role in the drug effect.How to use various methods to find and confirm the new target of a drug is one of the important challenges facing researchers.Drug affinity responsive target stability(DARTS)is a new technique based on the principle that when a small molecule compound binds to a protein,the interaction stabilizes the target protein′s structure so that it becomes protease resistant.This technique is universally applicable to drug screening and target identification because it requires no modification of the drug and is independent of the mechanism of drug action.This paper reviews the discovery of DARTS method,technical principles,methodology and its applications in researches.
drug affinity responsive target stability;drug screening;target identification;protease
XU Jun,E-mail:xujun0828@126.com,Tel:(0371)63555790
R966
A
1000-3002-(2016)11-1225-05
10.3867/j.issn.1000-3002.2016.011.015
Foundation item:The project supported by National Natural Science Foundation of China(31201332);Scientific and Technological Project of Henan Province(112300410088);Scientific and Technological Project of Henan Province(112102310324);Scientific and Technological Project of Henan Province(132102310033);and Natural Science Fund Guidance Program Education of Bureau of Henan Province(12B230007)
2016-06-01 接受日期:2016-11-04)
(本文编辑:齐春会)
国家自然科学基金(31201332);河南省科技攻关项目(112300410088);河南省科技攻关项目(112102310324);河南省科技攻关项目132102310033);河南省教育厅自然基金指导计划(12B230007)
徐朝,硕士研究生,主要从事病毒以及抗病毒机理的研究。
许 君,E-mail:xujun0828@126.com,Tel:(0371)63555790

