纳米二氧化硅对正常人外周血单个核细胞凋亡的诱导作用
钟建斌,雷泽林,唐 艳,张 丹,刘举科,马建秀
(1.西北民族大学医学院,甘肃兰州 730030;兰州大学第一医院2.呼吸科,3.中心实验室,甘肃兰州 730000;4.兰州城市学院,甘肃兰州 730070)
纳米二氧化硅对正常人外周血单个核细胞凋亡的诱导作用
钟建斌1,雷泽林2,唐 艳3,张 丹1,刘举科4,马建秀1
(1.西北民族大学医学院,甘肃兰州 730030;兰州大学第一医院2.呼吸科,3.中心实验室,甘肃兰州 730000;4.兰州城市学院,甘肃兰州 730070)
目的 观察纳米二氧化硅(SiO2)对正常人外周血单个核细胞(PBMC)凋亡的诱导作用,探讨纳米SiO2对人体的毒理特性。方法 透射电子显微镜观察纳米SiO2粒径、形态及分散性;采集6名健康志愿者外周血标本,进行体外全血培养和体外PBMC分离培养;纳米SiO212.5,25,50,100和200 mg·L-1与外周全血细胞和PBMC作用24 h后,血常规法检测外周血白细胞数目,罗丹明标记鬼笔环肽标记法于荧光倒置显微镜观察PBMC骨架微丝结构,AnnexinⅤ-FITC/PI双染检测细胞早期凋亡率,ELISA检测细胞培养上清液活性氧(ROS)自由基水平。结果 与正常对照组相比,纳米SiO2100和200 mg·L-1引起外周全血细胞中淋巴细胞和单核细胞数目明显减少(P<0.01);PBMC胞体皱缩、变圆,细胞核固缩并出现空泡化,细胞骨架微丝结构破坏;早期凋亡率和胞内ROS水平明显升高(P<0.01),且细胞早期凋亡率与胞内ROS水平呈明显的正相关(R2=0.847,P<0.01)。结论 纳米SiO2对PBMC有明显的细胞毒性作用,可诱导细胞凋亡;激发氧化应激反应可能是其导致细胞凋亡的主要原因。
纳米二氧化硅;外周血;单个核细胞;氧化应激;细胞凋亡
大气可吸入固体颗粒物是造成空气污染的重要因素,在大气对流层中矿物颗粒约达到大气颗粒物总量的1/2[1]。越来越多的研究表明,在全世界干旱地区沙尘暴天气是最常见的自然灾害,沙尘暴尘埃颗粒对人体健康可产生危害[2-3]。二氧化硅(silica dioxide,SiO2)是亚洲地区沙尘暴尘埃颗粒中的重要组成成分[4-5]。相关学者对亚洲沙尘暴尘埃颗粒的分析得出,其粒径范围可在10 nm~40 μm之间[6-7]。除沙尘暴天气等自然因素外,人为因素产生的纳米SiO2也广泛存在于自然环境中[8]。当前对大气细颗粒物的研究主要集中于致病性相关的有机颗粒和重金属离子[9-10],对纳米级尘埃颗粒研究较少。纳米SiO2具有空气动力学直径小,较微米级颗粒具有更高的表面活性、生物相容性和载体量,更易通过呼吸、消化和皮肤等黏膜途径进入机体,经过胞吞和内化等各类转运机制进入潜在的致敏靶点,产生更为严重的毒性反应[11-13]。纳米SiO2可使L-02细胞活性氧自由基(reactive oxygen species,ROS)自由基水平升高,启动氧化应激反应进而诱导细胞凋亡[14]。另有研究发现,纳米SiO2作用于PC12细胞后导致细胞膜损伤,诱发凋亡小体形成,从而引发细胞凋亡程序[15]。血液系统作为人体重要的免疫防线,其在纳米颗粒进入人体过程中发挥了重要的识别和转运作用,但是目前国内外对纳米SiO2造成免疫系统的毒性研究较少。纳米SiO2对免疫细胞潜在的免疫刺激或免疫抑制作用目前尚未知晓,对健康人体外周血单个核细胞(peripheral blood mononuclear cells,PBMC)产生的毒性及凋亡诱导作用尚不明确。本研究以正常人PBMC作为细胞模型,通过体外培养的方法,观察不同浓度纳米SiO2对PBMC的毒性作用和可能的作用机制。
1 材料与方法
1.1 主要试剂和仪器
纳米SiO2(直径10 nm,纯度99.8%,比表面积为200 m2·g-1)购自中国基材科技有限公司。LSM淋巴细胞分离液购自北京索莱宝科技有限公司,RPMI 1640培养基购自美国Gibco公司,胰蛋白酶购自美国Sigma公司,DAPI染液购自美国Molecular Probes公司,罗丹明标记鬼比环肽TRITC-Phal⁃loidin购自上海翊圣生物科技有限公司,人活性氧(reactive oxygen species,ROS)ELISA检测试剂盒购自上海继锦化学科技有限公司,AnnexinⅤ/PI双染凋亡检测试剂盒购自南京诺唯赞生物科技有限公司,其他试剂均为分析纯。24孔板购自美国Costar公司,2 mL真空采血管购自泰州为尔康医用品有限公司,IX51荧光显微镜为日本Olympus公司产品,XT-1800i全自动血液分析仪为日本SYSMEX株式会社产品,FACSCAN流式细胞仪为美国BD公司产品。
1.2 透射电子显微镜观察纳米SiO2的粒径和分布
纳米SiO2溶液用无血清RPMI 1640培养液配制,终浓度为50 mg·L-1,超声振荡器超声10 min,滴到铜网中,室温下风干。透射电子显微镜观察粒子直径、分布情况及形态,Image-Pro plus软件随机测定300个粒子并计算颗粒平均粒径。
1.3 血常规法检测纳米SiO2作用于外周血细胞的毒性效应
6名健康志愿者(获得知情同意),男和女各3名,年龄为21~23岁,近期无感染史和其他疾病。运用真空采血管无菌抽取新鲜外周血。取外周全血于24孔板中,每孔1 mL。暴露组分别加入1 mL无血清RPMI 1640培养液配制纳米SiO2溶液,调整终浓度为12.5,25,50,100和200 mg·L-1,空白对照组添加无血清RPMI 1640培养液,以上各溶液每孔1 mL。置37℃,5%CO2培养箱内分别培养24 h,于XT-1800i全自动血液分析仪检测,并记录结果。
1.4 PBMC分离获取
PBMC的分离按照聚蔗糖-泛影葡胺密度梯度离心法分离PBMC。取健康志愿者新鲜外周血2 mL,按试剂盒说明书要求分离获取PBMC。
1.5 罗丹明标记鬼笔环肽标记检测PBMC微丝结构
调整PBMC浓度1×109L-1后接种于24孔板中,每孔1 mL。纳米SiO2暴露组分别加入1 mL无血清RPMI 1640培养液配制纳米SiO2溶液,调整终浓度为12.5,25,50,100和200 mg·L-1,正常对照组添加1 mL无血清RPMI 1640培养液,置37℃,5%CO2培养箱内培养24 h。按试剂盒说明书要求对PBMC细胞进行细胞微丝标记,标记结束后置于Olympus IX51荧光显微镜下观察荧光强度。微丝结构完整性与荧光强度呈正相关。
1.6 流式细胞术检测PBMC凋亡
PBMC接种和处理同1.5,纳米SiO2暴露培养24 h后经胰酶消化,PBS洗细胞2次,调节细胞终浓度为1.0×108L-1。使用Annexin V-FITC/PI凋亡试剂盒进行标记,具体步骤按照试剂盒说明书操作,标记结束后在室温下避光反应10 min,使用FACSCAN流式细胞仪检测PBMC凋亡,每样本收集10 000个细胞,使用Cell Quest软件(BD Biosci⁃ence),分析早期凋亡细胞(FITC+PI-)百分率。
1.7 ELISA测定细胞培养上清ROS含量
PBMC接种和处理同1.5,经纳米SiO2暴露培养24 h后,收集24孔板内细胞培养上清液移至离心管,4℃下2000×g离心5 min后取上清液,使用人ROS ELISA试剂盒测定上清液中ROS水平,具体步骤按照试剂盒说明书操作。
1.8 统计学分析
实验结果数据均以x±s表示。采用SPSS 19.0软件进行统计学分析,多组比较采用单因素方差分析(one-way ANOVA)。以P<0.05表示差异具有统计学意义。
2 结果
2.1纳米SiO2的形貌和分散性
透射电子显微镜下观察(图1),纳米SiO2分布存在轻度聚集,大小较均匀,颗粒形态呈球形,分散性较好,使用Image-Pro plus软件分析得到颗粒粒径为(10.53±1.25)nm。

Fig.1 Transmission electron microscopic photo of silica nanoparticles(nano-SiO2).
2.2 纳米SiO2对外周血白细胞数目的影响
血常规结果(表1)显示,纳米SiO212.5,25,50,100和200 mg·L-1作用外周全血24 h后,与正常对照组相比,纳米SiO2100和200 mg·L-1可使外周全血白细胞数目减少(P<0.05);其中以淋巴细胞和单核细胞减少为主(P<0.01)。
2.3 纳米SiO2对PBMC形态的影响
图2结果显示,与正常对照组(图2A)相比,当纳米SiO2暴露浓度为12.5,25和50 mg·L-1时对PBMC形态并无明显影响(图2B,2C和2D)。当暴露浓度增加至100和200 mg·L-1时,PBMC胞体皱缩,变圆,细胞核出现固缩并且空泡化,细胞密度明显降低并脱落(图2E和2F)。

Tab.1 Effect of nano-SiO2on leukocytes of human peripheral blood cells(PBCs)

Fig.2 Effect of nano-SiO2on morphology of human PBMCs.See Tab.1 for cell treatment.A:normal control;B-F:nano-SiO212.5,25,50,100 and 200 mg·L-1,respectively.↑:karyopyknosis.
2.4纳米SiO2对PBMC微丝结构的影响
倒置荧光显微镜下观察(图3),与正常对照组(图3A)相比,当纳米SiO2浓度为12.5和25 mg·L-1时(图3B和3C),对PBMC微丝结构无明显影响。暴露浓度增加至50和100 mg·L-1时(图3D和3E),荧光强度呈减弱趋势;暴露浓度为200 mg·L-1时,PBMC骨架微丝结构明显破坏(图3F)。
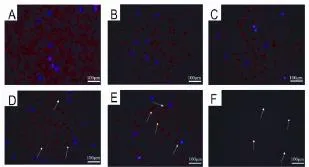
Fig.3 Effect of nano-SiO2on microfilaments in human PBMCs.See Tab.1 for cell treatment.A:normal control;B-F:nano-SiO212.5,25,50,100 and 200 mg·L-1,respectively.↑:microfilament destruction.
2.5 纳米SiO2对PBMC凋亡的影响
与正常对照组相比,纳米SiO2暴露浓度为12.5 mg·L-1时,细胞早期凋亡率无明显差异;浓度为25,50和100,200 mg·L-1时,早期凋亡率均升高(P<0.01)(图4和5),表明纳米SiO2能诱导PBMC凋亡。

Fig.4 Effect of nano-SiO2on early apoptosis of human PBMCs.See Tab.1 for the cell treatment.A:normal control;B-F:nano-SiO212.5,25,50,100 and 200 mg·L-1,respectively.

Fig.5 Effect of nano-SiO2on early apoptosis in human PBMCs.See Tab.1 for cell treatment.±s,n=6.**P<0.01,compared with normal control(0)group.
2.6 纳米SiO2对PBMC胞内ROS水平的影响
图6结果显示,与正常对照组相比,纳米SiO2暴露浓度为25,50,100和200 mg·L-1时,随暴露浓度的增加,PBMC胞内ROS浓度明显升高(P<0.01),表明纳米SiO2能诱导PBMC发生氧化应激反应,造成细胞损伤。

Fig.6 Effect of nano-SiO2on reactive oxygen species(ROS)level in human PBMCs.SeeTab.1forcell treatment.±s,n=6.*P<0.05,**P<0.01,compared with normal control(0)group.
2.7 PBMC早期凋亡率与ROS水平的相关性
图7结果显示,PBMC与纳米SiO2共培养24 h后,PBMC早期凋亡率与ROS水平呈明显的正相关性(R2=0.847,P<0.01)。

Fig.7 CorrelationbetweenROS levelandearly apoptosis rate in human PBMCs after treatment with nano-SiO2.PBMCs were cultured for 24 h.
3 讨论
纳米SiO2的生物学效应与颗粒粒径和暴露浓度存在密切的关系,粒径越小,其颗粒表面的原子数越多,不饱和键的数目增多,同时表面能急剧增加,使得这些表面原子具有很高的反应活性[16]。本研究电镜观察结果发现,纳米SiO2在细胞培养液中存在轻微的团聚现象,这种现象的产生可能与纳米SiO2存在极高的表面能以及培养过程中细胞释放的蛋白质或培养液中存在的其他成分有关。但相关研究表明,纳米SiO2进入细胞内之后,团聚现象即会消失[13,17]。Mendoza等[13]研究表明,10 nm的纳米SiO2较100 nm的纳米SiO2更易通过胞吞或者吞噬作用进入PBMC的胞质,从而造成更严重氧化损伤和细胞内环境稳态失调。本研究血常规结果表明,随着纳米SiO2暴露浓度增加,白细胞数目明显减少,其中以淋巴细胞和单核细胞减少最为明显。其原因可能是因纳米SiO2进入细胞后,诱发氧化应激反应造成细胞膜流动性下降和通透性增加,并造成细胞核形态改变,诱导细胞发生凋亡,最终导致白细胞减少[18]。DNA损伤、氧自由基的产生、细胞膜损伤和离子稳态失衡等的刺激信号均可诱导细胞凋亡的发生[19-20]。本研究联合采用细胞骨架荧光标记、流式细胞仪检测细胞早期凋亡率、ELISA测定细胞内ROS水平综合探讨纳米SiO2诱导PBMC凋亡的现象和潜在的机制。细胞胞体呈球形或卵球形,并出现细胞核固缩或者碎裂是细胞凋亡的典型形态特征。本研究中不同浓度纳米SiO2作用于PBMC 24 h后,光镜下观察细胞出现上述形态改变,提示纳米SiO2可引起PBMC凋亡。本研究观察PBMC骨架微丝结构,PBMC骨架在高浓度纳米SiO2(200 mg·L-1)处理后,出现明显的微丝断裂和骨架结构破坏。流式细胞术检测结果表明,各浓度纳米SiO2均能引起PBMC早期凋亡的发生,并呈现典型的浓度依赖性。有关文献结果也显示,纳米颗粒会造成细胞微丝结构破坏进而诱导细胞凋亡[21]。本研究与Ye等[14]报道结果一致,即纳米SiO2可以诱导细胞凋亡发生,并具有浓度依赖性。ROS是引发细胞凋亡的重要因素,当细胞内ROS蓄积过量时启动氧化应激反应,导致细胞内抗氧化系统稳态失调,引起细胞内DNA、蛋白质和脂质等发生氧化损害[22]。Tarantini等[23]研究发现,纳米SiO2引起细胞内ROS水平的升高,激发氧化应激反应,最终导致人肠道Caco-2细胞的凋亡发生。高浓度纳米SiO2诱导细胞产生ROS等物质,可破坏膜结构的完整性并造成DNA的损伤[19]。本研究结果表明,PBMC胞内ROS水平随着纳米SiO2暴露浓度的升高而明显上升,且PBMC早期凋亡率与ROS水平呈明显的正相关,也提示纳米SiO2造成的PBMC凋亡很可能是通过升高细胞ROS水平而诱导的。然而细胞凋亡的产生受多重因素的调节,除线粒体相关的氧化应激通路外,T细胞介导免疫反应的启动也是可能的因素,例如通过激活Fas/FasL途径诱导受损靶细胞的凋亡[24-25]。我们认为,本研究中纳米SiO2明显诱导PBMC发生凋亡的机制也有可能是纳米SiO2作为一类外源性抗原被巨噬细胞吞噬并加工后启动相关免疫应答。综上所述,不同浓度的纳米SiO2作用于PBMC后,在一定浓度范围内可引起PBMC形态改变,细胞骨架破坏,造成胞内ROS水平升高进而诱导细胞凋亡的发生。具体的凋亡诱导机制尚需深入研究。
[1]Andreae MO,Charlson RJ,Bruynseels F,Storms H,VAN Grieken R,Maenhaut W.Internal mixture of sea salt,silicates,and excess sulfate in marine aerosols[J].Science,1986,232(4758):1620-1623.
[2]Chang CC,Hwang JS,Chan CC,Wang PY,Cheng TJ.Effects of concentrated ambient particles on heart rate,blood pressure,and cardiac contractility in spontaneously hypertensive rats during a dust storm event[J].Inhal Toxicol,2007,19(11):973-978.
[3]Goudie AS.Desert dust and human health disor⁃ders[J].Environ Int,2014,63:101-113.
[4]Ma Q,Liu Y,Liu C,Ma J,He H.A case study of Asian dust storm particles:chemical composition,reactivity to SO2and hygroscopicproperties[J].J Environ Sci(China),2012;24(1):62-71.
[5]Li Y,Song YG,Chen XL,Li JC,Mamadjanov Y,AminovJ.Geochemical composition of Tajikistan loess and its provenance implications[J].Palaeo⁃geogr Palaeocol,2016,446:186-194.
[6]Liang CS,Yu TY,Lin WY.Source apportionment of submicron particle size distribution and PM2.5composition during an asian dust storm peri⁃od in two urban atmospheres[J].Aerosol Air Qual Res,2015,15(7):2609-2624.
[7]Niu HY,Zhang DZ,Hu W,Shi JH,Li RP,Gao HW,et al.Size and elemental composition of dry-deposited particles during a severe dust storm at a coastal site of eastern China[J].J Environ Sci,2016,40(2):161-168.
[8]Guo YT,Liu MX,Dong FQ.Research advances on cytotoxicity of nano-silica[J].J Environ Occup Med(环境与职业医学),2014,31(5):405-408.
[9]Zeng YL,Deng JJ,Huo TT,Dong FQ,Wang LM. Assessment of genetic toxicity with major inhalable mineral granules in A549 cells[J].Appl Clay Sci, 2016,119(1):175-182.
[10]Kim HW,Ahn EK,Jee BK,Yoon HK, Lee KH,Lim Y.Nanoparticulate-induced toxicity and related mechanismin vitroandin vivo[J].J Nanopart Res,2009,11(1):55-65.
[11]Passagne I,Morille M,Rousset M,Pujalté I,L'azou B.Implication of oxidative stress in size-de⁃pendent toxicity of silica nanoparticles in kidney cells[J].Toxicology,2012,299(2-3):112-124.
[12] Oberdörster G,Oberdörster E,Oberdörster J. Nanotoxicology:an emerging discipline evolving from studies of ultrafine particles[J].Environ Health Perspect,2005,113(7):823-839.
[13]Mendoza A,Torres-Hernandez JA,Ault JG,Pedersen-Lane JH,Gao D,Lawrence DA.Silica nanoparticles induce oxidative stress and inflam⁃mation of human peripheral blood mononuclear cells[J].Cell Stress Chaperones,2014,19(6):777-790.
[14]Ye Y,Liu J,Xu J,Sun L,Chen M,Lan M.Nano-SiO2induces apoptosis via activation of p53 and Bax mediated by oxidative stress in human hepatic cell line[J].Toxicol In Vitro,2010,24(3):751-758.
[15] Wang F,Jiao C,Liu J,Yuan H,Lan M,Gao F. Oxidative mechanisms contribute to nanosize silican dioxide-induced developmental neurotoxicity in PC12 cells[J].Toxicol In Vitro,2011,25(8):1548-1556.
[16]Oberdörster G,Maynard A,Donaldson K,Castra⁃nova V,Fitzpatrick J,Ausman K,et al.Principles forcharacterizing the potentialhuman health effectsfrom exposure tonanomaterials:elementsof a screening strategy[J].Part Fibre Toxicol,2005,2:8.
[17]Wang SG,Lu WT,Tovmachenko O,Rai US,Yu HT,Ray PC.Challenge in understanding size and shape dependent toxicity of gold nanomaterials in human skin keratinocytes[J].Chem Phys Lett,2008,463(1/3):145-149.
[18]Park EJ,Yi J,Chung YH,Ryu DY,Choi J,Park K.Oxidative stress and apoptosis induced by titani⁃um dioxide nanoparticles in cultured BEAS-2B cells[J].Toxicol Lett,2008,180(3):222-229.
[19] Tay CY,Fang WR,Setyawati MI,Chia SL,Tan KS,Hong CH,et al.Nano-hydroxyapatite and nano-titanium dioxide exhibit different subcellular distribution and apoptotic profile in human oral epithelium[J].ACSApplMaterInterfaces,2014,6(9):6248-6256.
[20] Wyllie AH,Kerr JF,Currie AR.Cell death:the sig nificance of apoptosis[J].Int Rev Cytol,1980,68:251-306.
[21]Li WS,Chen LJ.Glutathione mechanism of gold nanoparticles cytotoxicity in CHO-K1 cells[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2013,27(2):234-239.
[22]Roberts RA, Smith RA, Safe S,Szabo C,Tjalkens RB,Robertson FM.Toxicological and pathophysiological roles of reactive oxygen and nitrogen species[J].Toxicology,2010,276(2):85-94.
[23]Tarantini A,Lanceleur R,Mourot A,Lavault MT, Casterou G,Jarry G,et al.Toxicity,genotoxicity and proinflammatory effects of amorphous nanosilica in the human intestinal Caco-2 cell line[J].Toxicol In Vitro,2015,29(2):398-407.
[24] Elmore S.Apoptosis:a review of programmed cell death[J].ToxicolPathol, 2007, 35(4):495-516.
[25]Murphy KM,Heimberger AB,Loh DY.Induction by antigen of intrathymic apoptosis of CD4+CD8+TCRlo thymocytesin vivo[J].Science,1990,250(4988):1720-1723.
Induction of silica nanoparticles on apoptosis of normal human peripheral blood mononuclear cells
ZHONG Jian-bin1,LEI Ze-lin2,TANG Yan3,ZHANG Dan1,LIU Ju-ke4,MA Jian-xiu1
(1.Medical College of Northwest University for Nationalities,Lanzhou 730030,China;2.Department of Respiration,3.Department of Central Laboratory,the First Hospital of Lanzhou University,Lanzhou 730000,China;4.Lanzhou City University,Lanzhou 730070,China)
OBJECTIVE To elucidate the toxicological properties of silica nanoparticles(nano-SiO2)by investigating their effect on human peripheral blood mononuclear cells(PBMCs).METHODS The particle size,morphology and dispersion of nano-SiO2were characterized by the transmission electron microscope.Human blood samples were provided by 6 healthy volunteers,while PBMCs were isolated from the peripheral blood cells and cultured in vitro.The cells were treated with 10 nm nano-SiO2in RPMI 1640 media at the concentration of 0(normal control),12.5,25,50,100 and 200 mg·L-1for 24 h.Blood routine examination was performed.The human PBMC morphology was observed under an inverted microscope,followed by detection and analysis of the microfilament using TRITC-phallodin and fluorescence microscopy,respectively.After staining with AnnexinⅤ-FITC and propidumiodide,the cell early apoptosis rate was measured by flow cytometry.Reactive oxygen species(ROS)production in the supernatant medium liquid was measured with ELISA.RESULTS Compared with normal control group,the proportion of lymphocytes and macrophages significantly decreased when the cells were treated with nano-SiO2100 and 200 mg·L-1.The cell morphology changed and the microfilament was disrupted.The early apoptosis rate and intracellular ROS level both significantly increased along with the nano-SiO2exposure concentration(P<0.01).In addition,there was a significant positive correlation between ROS and apoptosis rate(R2=0.847,P<0.01).CONCLUSION Nano-SiO2demonstrates cytotoxicity when exposed to PBMCs.The elevated level of oxidative stress is probably a major reason for early apoptosis.
silica nanoparticles;peripheral blood;mononuclear cells;oxidative stress;apoptosis
MA Jian-xiu,E-mail:gsmjx@hotmail.com
R994.6
A
1000-3002-(2016)11-1176-06
10.3867/j.issn.1000-3002.2016.11.008
Foundation item:The project supported by National Natural Science Foundation of China(31260133);and Northwest University for Nationalities 2015 National College Students Innovation and Entrepreneurship Training Program(201510742088)
2016-07-05 接受日期:2016-11-09)
(本文编辑:齐春会)
国家自然科学基金(31260133);西北民族大学2015年国家级大学生创新创业训练计划项目(201510742088)
钟建斌,本科生,主要从事细胞毒性和纳米材料研究。
马建秀,E-mail:gsmjx@hotmail.com

