醛固酮对豚鼠耳蜗功能及AF9蛋白表达的调节作用
秦丽 章碧云 钟时勋
重庆医科大学附属第一医院,耳鼻咽喉科(重庆400016)
·基础研究·
醛固酮对豚鼠耳蜗功能及AF9蛋白表达的调节作用
秦丽 章碧云 钟时勋
重庆医科大学附属第一医院,耳鼻咽喉科(重庆400016)
目的检测豚鼠耳蜗组织中AF9蛋白的表达情况,分析醛固酮对耳蜗功能及AF9蛋白表达影响,探讨醛固酮与AF9蛋白在内淋巴积水中的作用。方法将28只豚鼠随机分为两组,对照组及实验组(Ald组)分别腹腔注射50μl生理盐水、0.1mg/kg/d醛固酮,各5天。1月后通过听性脑干反应(ABR)检测耳蜗功能学改变;应用苏木素-伊红染色(HE)检测两组耳蜗组织形态学差异,利用免疫组织化学(IHC)检测AF9蛋白在耳蜗组织中的定位表达以及醛固酮作用前后AF9蛋白的差异表达模式。结果醛固酮作用后,ABR提示Ald组听力阈值较对照组升高(P<0.05)。HE证实Ald组豚鼠耳蜗存在内淋巴积水,IHC显示AF9蛋白在血管纹、前庭膜、螺旋缘、Corti器、螺旋神经节及前庭阶骨膜均有表达,并且Ald组耳蜗AF9蛋白在血管纹及前庭膜表达量低于对照组,差异有统计学意义(P<0.05)。结论耳蜗组织中存在与Na+代谢相关的AF9蛋白,醛固酮可能通过下调AF9蛋白表达来参与内淋巴代谢,进而影响内耳功能。
醛固酮;AF9蛋白;内淋巴积水;耳蜗功能
Fund projects:Chongqing Natural Science Foundation(cstc2013jcyjA10034);National Key Clinical Specialties Construction Program of China([2012]649)
Declaration of interest:The authors report no conflicts of interest.
梅尼埃病(Meniere’s disease,MD)为常见内耳疾病,其典型症状为间歇发作性眩晕(每次持续数小时)、波动性感音神经性听觉损失、耳鸣及耳胀满感。目前一致认为耳蜗内淋巴积水(Endolymphatic Hydrops,ELH)为该病的组织病理学改变,但具体发病机制尚不清楚[1]。Na+、K+转运代谢失衡易导致内淋巴液高钾低钠的环境改变,从而诱导内淋巴积水的产生。醛固酮(Aldosterone)在人体中主要调控钠钾代谢及液体容量平衡,而醛固酮受体在耳蜗有分布,并且主要表达于血管纹、Corti器、螺旋韧带等部位[2]。研究发现醛固酮可诱导内淋巴积水形成,但作用机制仍不清[3,4]。
在肾脏疾病研究中证实,ENaC是Na+转运的重要通道蛋白,转录调控因子AF9在肾脏的肾小管和部分肾小球中有表达[5],醛固酮可抑制AF9与Dot1a蛋白的相互作用,促进上皮钠通道ENaC的转录,从而导致肾脏Na+代谢障碍,进而引起肾脏纤维化、高血压等疾病[6]。但AF9蛋白在内耳中有无表达尚不清楚,在内耳中AF9蛋白与醛固酮一同参与内耳内淋巴调节的相关机制亦缺乏相应的研究支持。
推测,醛固酮可能与AF9分子相互作用参与耳蜗内淋巴代谢调节。为此,采用醛固酮构建内淋巴积水模型,研究AF9在耳蜗组织中的表达及醛固酮对AF9表达及耳蜗功能的调控作用机制,进而探讨内淋巴积水形成的可能分子机制,为梅尼埃病的发病机理寻找新的理论依据。
1 材料与方法
1.1 实验动物及分组
健康白化红目豚鼠,雄性,体重200~250g,由重庆医科大学实验动物中心提供,声反射灵敏。将动物随机分为实验组(Ald组)与对照组,共28只(实验组14只,对照组14只)。
1.2 试剂
兔抗鼠AF9多克隆抗体(Abcam,英国),醛固酮(Aldosterone,sigma,美国),SABC免疫组化试剂盒(博士德,SA1022)。
1.3 实验方法
1.3.1 构建豚鼠内淋巴积水模型
对照组豚鼠每天腹腔注射生理盐水50μl,共5天,实验组豚鼠每天腹腔注射醛固酮0.1mg/kg/d,50μl,共5天。喂饲常规饮食,一个月后取材,行HE染色观察内淋巴积水形成。
1.3.2 行为学观察
建模期间间隔3天观察一次动物日常活动,如耳廓反射灵敏度,有无眼球震颤、行走迟缓等现象。1.3.3 功能学检测
造模前与造模一月取材前均行豚鼠双耳ABR阈值测试。测试在电声屏蔽室内进行,仪器采用美国INTELLEGENT HEARING的诱发电位仪,测试的软件为SMART EP,刺激声为短声,极性为交替波。1%戊巴比妥钠按40mg/kg腹腔内注射麻醉后,记录电极置于颅顶,参考电极置于测试耳耳廓后,地极置于对侧耳耳廓后,单频单耳刺激给声,检测从80dB开始,每20dB为一阶梯下降,观察快接近阈值时再以10dB、5dB下降,引出ABR的反应阈。
1.3.4 形态学检测
动物腹腔注射1%戊巴比妥钠(40mg/kg)麻醉后,立即分别以生理盐水及4%多聚甲醛行心脏灌流,待头颈完全僵硬后快速断头游离颞骨。剪开听泡,保留内耳,蜗尖钻孔,打开蜗窗及前庭窗,同时也取出肾脏。4%多聚甲醛中固定48 h,10%的乙二胺四乙酸(Ethylenediamine Tetraaceticacid,EDTA)溶液脱钙1个月(两天更换一次),随后梯度酒精脱水、透明、石蜡包埋,平行于蜗轴连续切片(片厚4ul),HE染色。前庭膜(Reissner’s膜)向前庭阶膨隆为积水形成标志。将内淋巴积水程度分为轻度、中度及重度,膨隆部分面积占前庭阶面积的0~1/3为轻度积水;1/3~2/3为中度积水;2/3以上为重度积水。
1.3.5 免疫组化
将耳蜗石蜡切片按照SABC法免疫组化试剂盒说明书操作,一抗为兔抗鼠AF9多克隆抗体(1:500),0.01M PBS代替一抗做为阴性空白对照,用已知阳性的肾脏做阳性对照。结果判定:显微镜下耳蜗细胞膜和/或细胞质可见棕黄色颗粒者为AF9蛋白阳性表达,无棕黄色颗粒者为阴性表达。用Im⁃age-Pro Plus 6.0软件计算平均光密度(OD)值。
1.4 统计学方法
采用SPSS 20.0软件处理全部数据,两组豚鼠实验前后ABR阈值比较应用配对t检验,其余数据采用独立样本t检验,以P<0.05为差异有统计学意义。计量资料数据以均数±标准差(±s)进行描述。
2 结果
2.1 行为学观察
观察豚鼠耳廓反射灵敏,胆小易惊,未捕捉到眼球震颤、行走不稳症状。
2.2 ABR检测结果
如表1,对照组实验前后比较,实验前ABR阈值为17.50±3.79,实验后ABR阈值为18.21±2.48,t=-0.69,P=0.50,ABR阈值的差异无统计学意义(P>0.05);Ald组实验前后比较,实验前ABR阈值为17.14±5.10,实验后 ABR阈值为 23.21±7.99,t=-2.88,P=0.01,ABR阈值的差异有统计学意义(P<0.05)。图1所示,Ald组实验后ABR阈值图:左耳35dB,右耳15dB。
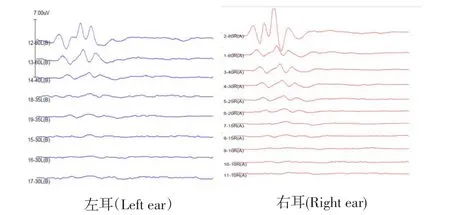
图1 实验后ABR阈值:左耳35dB,右耳15dB。Fig.1 TheABR threshold after aldosterone treatment:Left ear 35dB,right ear 15dB.
2.3 形态学检测结果(HE染色)
观察正常豚鼠切片发现耳蜗前庭阶面积与蜗管的面积比值随顶转到底转逐渐变大,前庭阶、蜗管、鼓阶的结构正常,且前庭膜未向前庭阶膨隆。按Re⁃issner’s膜向前庭阶膨隆程度可分为轻、中、重度积水,造模一月后对照组豚鼠耳蜗未见明显积水形成,Ald组取14只耳蜗,发现有10只出现轻度积水,底转尤为明显,余4只耳蜗未见明显积水,造模成功率71%。见图2(a、b)。
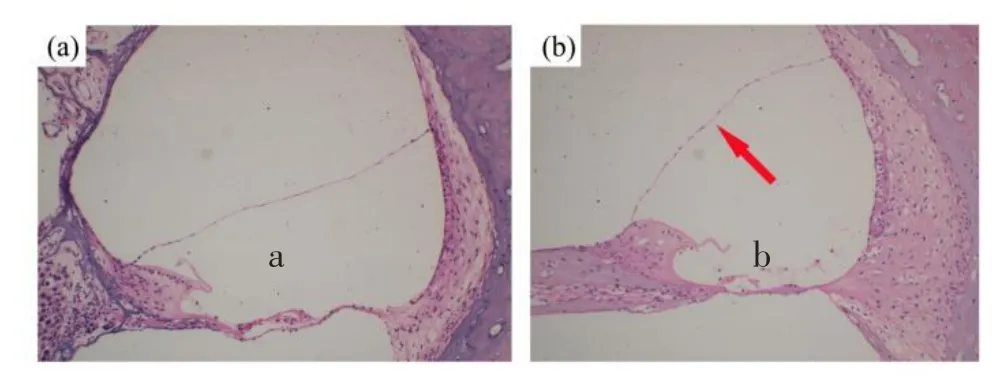
图2 对照组(a)与Ald(b)组豚鼠耳蜗内淋巴积水情况(HE× 100)。豚鼠耳蜗病理组织学切片(a:对照组:耳蜗结构正常b:Ald组:内淋巴积水)Fig.2 The endolymphatic hydrops condition of guinea pigs cochlear(a:control group,b:Ald group)(HE×100).The histopathological section of guinea pig cochlea(a:control group:normal in cochlea b:endolymphatic hydrops in cochlea)
2.4 对照组与Ald组豚鼠AF9表达部位及OD值比较对照组与Ald组豚鼠耳蜗组织均有AF9蛋白表达,主要表达于血管纹、前庭膜、螺旋缘、Corti器、螺旋神经节及前庭阶骨膜的细胞质、细胞膜及部分细胞核处,呈棕黄色颗粒状,且在血管纹、前庭膜及螺旋缘处表达尤为明显(图3)。用肾脏作为阳性对照,AF9蛋白主要表达于肾小管上皮的细胞膜和细胞质,呈棕黄色颗粒(图4)。
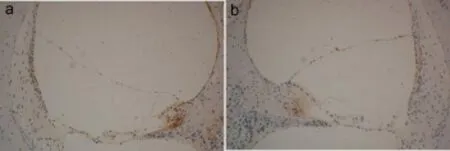
图3 耳蜗免疫组化显示AF9蛋白在耳蜗中的表达分布(× 100),对照组(a)、Ald组(b)均表达于血管纹、前庭膜、螺旋缘、Corti器、螺旋神经节及前庭阶骨膜。(×100)Fig.3 The immunohistochemistry staining pattern for AF9 protein in guinea pig cochlea(×100).Both control group and Ald group showed AF9 protein in the stria vascularis,Reissner’s membrane,spiral limbus,organ of Corti,spiral ganglions and periosteum of scala vestibule.(×100)
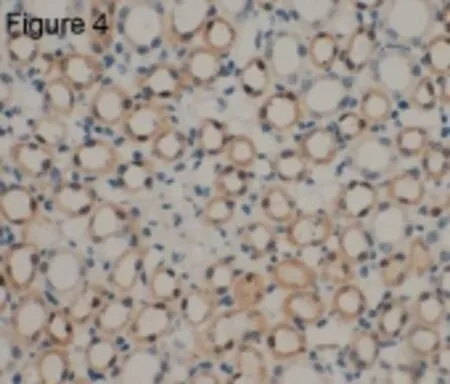
图4 肾脏免疫组化显示AF9蛋白在肾脏中的表达分布(× 100)。Fig.4 The immunohistochemistry staining pattern for AF9 protein in guinea pigs kidney(×100).
可见Ald组耳蜗中阳性表达部位处的颜色较对照组明显变浅。其中对照组与Ald组前庭膜AF9表达的平均OD值分别为0.18±0.02和0.11±0.01,t= 5.55,P=0.01;血管纹表达的平均OD值分别为0.43± 0.04和0.28±0.04,t=3.12,P=0.03,Ald组均低于对照组,差异有统计学意义(P<0.05)。
3 讨论
目前,梅尼埃病的病因及发病机制仍不清楚,临床也主要通过症状、实验室检测和排它法来诊断梅尼埃病。目前认为梅尼埃病最主要的组织病理学改变为内淋巴积水。受论理道德局限,无法获取大量人体颞骨样本以及活体无法进行内淋巴积水组织病理学研究,因此选择恰当的内淋巴积水动物模型对于研究梅尼埃病发病机制至关重要。醛固酮(Aldo⁃sterone)是由肾上腺皮质球状带分泌的作用最强的一种盐皮质激素,主要用于维持体内水容量平衡及钠钾代谢。1997年,Dunnebier等人利用两相法通过手术破坏单耳内淋巴囊及内淋巴管后3周,给予醛固酮建立内淋巴积水模型后,手术耳出现中、重度内淋巴积水,对侧耳出现轻度内淋巴积水,推测醛固酮影响内耳中Na+,K+-ATP酶活性,Na+/K+代谢紊乱所致[3]。随后国内有学者进行了单一的醛固酮建模,并对手术单耳建模、手术双耳建模、注射醛固酮组以及注射血管加压素组建模方法进行了对比研究,认为醛固酮建模适于研究膜迷路积水的可能内分泌代谢机制[4,7]。
表1 两组豚鼠实验前后ABR阈值比较(dB SPL,±s)Table 1 TheABR thresholds of all animals before and after aldosterone treatment(dB SPL,±s)

表1 两组豚鼠实验前后ABR阈值比较(dB SPL,±s)Table 1 TheABR thresholds of all animals before and after aldosterone treatment(dB SPL,±s)
注:与实验前ABR阈值比较,*P<0.05。
Group n t valu p value The Control group TheAld group 14 14 ABR threshold Before 17.50±3.79 17.14±5.10 After 18.21±2.48 23.21±7.99*-0.69 -2.88 0.50 0.01
上皮钠通道(Epithelial Sodium Channel,ENaC)是体内调节水、Na+代谢的重要分子。我们的前期研究证实内耳组织中有ENaC的表达[8,9]。运用小鼠敲除Pendrin基因和豚鼠腹腔注射醋酸去氨加压素构建内淋巴积水模型的实验研究证实,ENaC参与内淋巴积水形成[10,11]。肾脏相关研究发现,醛固酮可下调AF9与DOT1a分子的表达来促进ENaC的转录,导致肾脏钠离子代谢障碍[5,6]。而在内耳中是否也存在这种调节机制,参与内淋巴代谢尚不清楚。本实验通过豚鼠腹腔注射醛固酮构建内淋巴积水,对豚鼠内耳的症状学、功能学及形态学的改变进行研究,初步探索了AF9蛋白在内耳中的表达模式及与内淋巴代谢的可能关系。
在造模过程中,本实验未能捕捉到豚鼠出现眼球震颤、行动迟缓等典型梅尼埃病症状。最近有学者通过对确诊为梅尼埃病(无临床症状)的人体颞骨标本进行病例研究,认为膜迷路积水的病理改变与MD的临床特征不一定相一致[1],而动物的主观症状本身较难获取。
Ald组造模后豚鼠平均听阈提高约5dB,具有统计学意义。从临床角度考虑,听力损害较轻,这可能与种属个体差异、药物剂量、有效浓度维持时间、听力损害程度及听力损害已向痊愈方向转归等因素有关。但临床上也存在血浆醛固酮水平低(听力在正常值范围)的老年人,较醛固酮水平高(正常高值)的听力更差[12];且文献[13]在对自身免疫性听力损失的小鼠模型研究中,盐皮质激素(包括醛固酮)与糖皮质激素对听力恢复疗效相当,甚至优于糖皮质激素。因此,本文推测醛固酮在安全用量范围对听力具有一定的保护作用,当超过了安全剂量,可能触发机体某些损伤作用机制,对听力造成损害。
如图2所示,由于动物对药物的反应有差异,个别耳蜗积水形成较不明显,但是耳蜗内淋巴积水率仍达到71%。醛固酮造模方法相对于手术法[3]、免疫法等造模方法安全性高,稳定性好。本文耳蜗积水主要存在于底转,随着积水程度加重,可能诱发高频听力下降。
看似无关联的肾脏和内耳却都存在ENaC、非选择性阳离子通道、Na+,H+-交换体(NHE3)、Na+,K+-ATP酶、Na+,K+,Cl-协同转运蛋白(NKCC1)等[14]Na+转运相关通道及转运蛋白。当肾脏和内耳中的这些通道或转运蛋白发生障碍时,肾脏和内耳都会出现代谢失调[14,15]。可见肾脏和内耳拥有相似的代谢调节机制。ENaC属高选择性Na+通道,在多种具有Na+重吸收的组织(如肾脏、肺脏等)中有表达,拥有高K+低Na+特性的内淋巴液的耳蜗组织中同样有ENaC的定位表达,它能调节内淋巴液容积,维持内淋巴稳态[8,9]。在肾脏研究中证实,醛固酮对肾脏集合管上皮钠通道(ENaC)基因及上皮Na+吸收起到重要调控作用。过表达AF9基因可导致内源性αENaC启动子的组蛋白H3Lys79超甲基化,从而抑制mRNA水平上的αENaC,并与Dot1a协同干扰αENaC启动子荧光素酶合成;干扰敲除AF9基因的实验得出相反的结果,因此认为醛固酮能在mRNA及蛋白质水平下调AF9的表达[16]。因此,推测内耳中也可能同样存在醛固酮通过Dot1a-AF9途径作用于ENaC的表观遗传学通路。
虽然有研究显示AF9在肾脏的肾小管和部分肾小球中有表达,且参与醛固酮对ENaC的调节[6],但目前尚未发现在内耳中存在AF9表达。本文中实验首次证实内耳中有AF9分子的表达,并且在螺旋缘、血管纹及前庭膜的表达呈强阳性,前庭阶骨膜、Corti器、螺旋神经节处的表达呈弱阳性,与ENaC的三个不同亚基在内耳中的表达部位相似[8],皆是参与Na+代谢的重要部位。因此,AF9分子在内耳中可能也参与对ENaC的调节,共同维持内耳Na+稳态。
Corti器感受声音刺激,螺旋神经则可能参与听觉传导,目前尚未证实ENaC是负责哺乳类听觉的机械感觉通道[17]。如图3所示,本实验中AF9蛋白在Corti器、螺旋神经处表达很弱,因此推测该部位不是Na+转运的主要场所。而AF9蛋白在血管纹、前庭膜及螺旋缘处表达呈强阳性(图3(a))。内耳中血管纹边缘细胞中的离子转运蛋白负责分泌出K+进入中阶,然后主要依靠Corti器的机械敏感细胞被动排出K+以维持内淋巴液成分及蜗管内静息电位的稳定[18]。ENaC对Na+的吸收受前庭膜、球囊斑上皮、半规管上皮、内淋巴囊[19]及血管纹边缘细胞的管腔膜[20]控制。前庭膜主要通过阿米洛利选择性通道主动从内淋巴液中吸收Na+,维持内淋巴液低钠内环境,且不参与转运K+及内淋巴K+稳态的维持[21]。如图3(b)所示,Ald组醛固酮作用后的内淋巴处于高Na+环境,内耳中的血管纹及前庭膜处的AF9蛋白表达量较正常组明显降低,增强了ENaC蛋白的转录。推测前期血管纹及前庭膜代偿性将内淋巴中Na+转运至外淋巴,同时血管纹的离子转运蛋白将K+转运至内淋巴;后期内耳处于失代偿阶段时,内淋巴逐渐处于异常低钾高钠内环境。前庭膜渗透性的被动吸收,从而导致内淋巴积水的产生。
通过对实验结果的分析,本研究得出如下基本结论:(1)醛固酮对内淋巴积水的形成起着重要作用,并导致内耳形态学及功能学均发生变化;(2)首次证实了AF9蛋白在内耳血管纹、前庭膜、螺旋缘等Na+代谢的重要部位有表达;(3)醛固酮作用后,AF9蛋白在血管纹及前庭膜处表达明显减弱,提示血管纹及前庭膜部位可能存在醛固酮通过Dot1a-AF9途径作用于ENaC的表观遗传学通路。而在mRNA和蛋白水平上AF9与醛固酮在内耳中的具体调控机制尚不清楚,并且醛固酮受体、醛固酮受体拮抗剂、DOT1a与AF9及ENaC在内耳中又以何种关系存在有待后续实验进一步研究证实。
1 Merchant S N,Adams J C,Nadol Jr J B.Pathophysiology of Me⁃niere's syndrome:are symptoms caused by endolymphatic hydrops? [J].Otology&Neurotology,2005,26(1):74-81.
2 Yao X,Rarey K E.Localization of the mineralocorticoid receptor in rat cochlear tissue[J].Acta otolaryngologica,1996,116(3):493-496. 3 Dunnebier E A,Segenhout J M,Wit H P,et al.Two-phase endolym⁃phatic hydrops:a new dynamic guinea pig model[J].Acta oto-laryn⁃gologica,1997,117(1):13-19.
4 蒋子栋,张连山.醛固酮诱发豚鼠双耳膜迷路积水[J].中国医学科学院学报,2002,24(5):501-504.
Jiang ZD,Zhang LS.Endolymphatic Hydrops of Both Ee⁃ars of Guin⁃ea Pigs Produced by Aldosterone[J].Acta Academiae Me⁃dicinae Sinicae,2002,24(5):501-504.
5 Zhou Q,Liu K,Wu H,et al.Spironolactone rescues Dot1a-Af9-me⁃ diated repression of endothelin-1 and improves kidney injury in streptozotocin-induced diabetic rats[J].PloS one,2012,7(10): e47360.
6 Zhang D,Yu Z,Cruz P,et al.Epigenetics and the control of epitheli⁃al sodium channel expression in collecting duct[J].Kidney interna⁃tional,2009,75(3):260-267.
7 蒋子栋,高帆,孙程成.不同方法构建豚鼠膜迷路积水模型的对比研究[J].中华耳科学杂志,2015,13(4):734-737.
Jiang ZD,Gao F,Sun CC.A Comparative Study of Guinea Pig Mod⁃els of Endolymphatic Hydrops[J].Chinese Journal of Otology,2015, 13(4):734-737.
8 Zhong S X,Liu Z H.Immunohistochemical localization of the epithe⁃lial sodium channel in the rat inner ear[J].Hearing research,2004, 193(1):1-8.
9 Zhong S X,Hu G H,Liu Z H.Expression of ENaC,SGK1 and Nedd4 isoforms in the cochlea of guinea pig[J].Folia Histochemica et Cytobiologica,2014,52(2):144-148.
10 温雅,钟时勋.去氨加压素对耳蜗功能及上皮钠通道表达的调节作用[J].中华耳科学杂志,2014,12(3):498-502.
Wen Y,Zhong SX.Regulation of Epithelial Sodium Channels and Co⁃chlear Function by Desmopressin[J].Chinese Journal of Otol⁃ogy, 2014,12(3):498-502.
11 Kim B G,Kim J Y,Kim H N,et al.Developmental changes of ENaC expression and function in the inner ear of pendrin knock-out mice as a perspective on the development of endolymphatic hydrops[J]. PloS one,2014,9(4):e95730.
12 Tadros S F,Frisina S T,Mapes F,et al.Higher serum aldosterone correlates with lower hearing thresholds:a possible protective hor⁃mone against presbycusis[J].Hearing research,2005,209(1):10-18.
13 Trune D R,Beth Kempton J,Kessi M.Aldosterone(Mineralocorti⁃coid)Equivalent to Prednisolone(Glucocorticoid)in Reversing Hear⁃ing Loss in MRL/MpJ‐Faslpr Autoimmune Mice[J].The Laryngo⁃scope,2000,110(11):1902-1906.
14 Kim S H,Marcus D C.Regulation of sodium transport in the inner ear[J].Hearing research,2011,280(1):21-29.
15 Lang F,Vallon V,Knipper M,et al.Functional significance of chan⁃nels and transporters expressed in the inner ear and kidney[J].Amer⁃ican Journal of Physiology-Cell Physiology, 2007, 293(4): C1187-C1208.
16 Zhang W,Xia X,Reisenauer M R,et al.Dot1a-AF9 complex medi⁃ates histone H3 Lys-79 hypermethylation and repression of ENaCα in an aldosterone-sensitive manner[J].Journal of Biological Chemis⁃try,2006,281(26):18059-18068.
17 Corey D P.What is the hair cell transduction channel?[J].The Jour⁃nal of physiology,2006,576(1):23-28.
18 Patuzzi R.Ion flow in stria vascularis and the production and regula⁃tion of cochlear endolymph and the endolymphatic potential[J]. Hearing research,2011,277(1):4-19.
19 Kim S H,Marcus D C.Regulation of sodium transport in the inner ear[J].Hearing research,2011,280(1):21-29.
20 Kakigi A,Okada T,Takeda T,et al.Presence and regulation of epi⁃thelial sodium channels in the marginal cells of stria vascularis[J]. Acta oto-laryngologica,2008,128(3):233-238.
21 Yamazaki M,Kim K X,Marcus D C.Sodium selectivity of Reissner's membrane epithelial cells[J].BMC physiology,2011,11:4.
Regulation ofAF9 protein expression and cochlearfunction by aldosterone in guinea pigs
QIN Li,ZHANG Biyun,ZHONG Shixun
Department of Otorhinolaryngology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
ObjectiveTo study the effect of aldosterone on AF9 protein expression and cochlear function in guinea pigs and to investigate possible roles of aldosterone and AF9 protein in the pathogenesis of endolymphatic hydrops.Methods Twenty-eight guinea pigs were randomly divided into a control and an aldosterone treatment group(Ald group).The Ald group received daily aldosterone at 0.1mg/kg/d intraperitoneally for 5 days,while the control group received equivalent normal saline treatment.After one month,cochlear function was tested by auditory brainstem response(ABR),morphology of cochlea was examined by Hematoxylin and Eosin staining,and expression of AF9 protein was evaluated by immunohistochemistry.RusultsCompared to the control group,the Ald group showed higher ABR thresholds(P<0.05).Seventy-one percent of animals in the Ald group had endolymphatic hydrops.The AF9 protein was found in the stria vascularis,Reissner’s membrane,spiral limbus,organ of Corti,spiral ganglions and periosteum of scala vestibule.The expression of AF9 protein in stria vascularis and Reissner’s membrane in the Ald group was lower than that in the control group(P<0.05). Conclusion AF9 protein involved in Na+regulation is present in the cochlea.Aldosterone participates in endolymph metabolism and influence the function of inner ear by regulating the expression ofAF9 protein.
Aldosterone;AF9 protein;Endolymphatic hydrops;Cochlear function
R764.35
A
1672-2922(2016)06-788-5
2016-07-14审核人:郭维维)
10.3969/j.issn.1672-2922.2016.06.017
1.重庆市自然科学基金项目资助(cstc2013jcy⁃jA10034)2.国家临床重点专科建设经费项目卫办医政函[2012]649号
秦丽,硕士,研究方向:内耳病理生理学
钟时勋,Email:zhongsx@sohu.com

