2598例非综合征型耳聋患者基因型与临床表型的分析
王芳陈小婉徐百成刘晓雯朱一鸣陈兴健郭玉芬
1甘肃省兰州大学第二医院耳鼻咽喉头颈外科(兰州730030)
2甘肃省兰州大学第一医院耳鼻咽喉头颈外科(兰州730030)
·临床研究·
2598例非综合征型耳聋患者基因型与临床表型的分析
王芳1陈小婉2徐百成1刘晓雯1朱一鸣1陈兴健1郭玉芬1
1甘肃省兰州大学第二医院耳鼻咽喉头颈外科(兰州730030)
2甘肃省兰州大学第一医院耳鼻咽喉头颈外科(兰州730030)
目的探讨GJB2基因和线粒体DNAA1555G与临床听力学、发病年龄的相关性。方法对收集的2598例非综合征型耳聋患者进行GJB2和线粒体DNAA1555G检测,然后对GJB2纯合与复合杂合突变患者的听力学表型进行统计学分析,并对GJB2致病突变患者、线粒体DNAA1555G阳性检出者与患者的听力学表型及发病年龄进行统计学分析。结果①在GJB2纯合突变样本中,极重度、重度、中度、轻度的检出率依次为74.65%、19.27%、5.63%、0%;复合杂合样本中,极重度、重度、中度、轻度的检出率依次是56.60%、37.74%、5.66%、0%。GJB2纯合与复合杂合突变所致的听力损失程度之间的差异具有统计学意义(χ2=10.064,P=0.007)。②在GJB2致病突变患者中,听力损失程度构成比:极重度10.43%、重度8.81%、中度8.03%、轻度0%,四组之间的差异有统计学意义(χ2=8.32,P=0.04)。在线粒体DN⁃AA1555G阳性患者中,听力损失程度构成比之间的差异无统计学意义(χ2=6.90,P=0.07)。③GJB2致病突变患者中语前聋发病率为11.96%,语后聋发病率为3.83%,二者之间的差异有统计学意义(χ2=13.43,P=0.00);GJB2致病突变患者中各年龄组之间的发病率差异具有统计学意义(χ2=17.36,P=0.00)。A1555G阳性患者中语前聋与语后聋发病率之间的差异无统计学意义(χ2=0.089,P=0.766);A1555G阳性患者中各年龄组之间的差异无统计学意义(χ2=2.76,P= 0.59)。GJB2与A1555G基因突变患者在发病年龄构成比上的差异有统计学意义(χ2=9.90,P=0.02)。结论GJB2纯合突变患者的听力损失程度重于复合杂合突变患者;GJB2致病突变患者的听力损失程度以极重度为主,A1555G阳性患者的听力损失程度相对较轻;GJB2致病突变患者多集中于语前聋,线粒体DNAA1555G阳性患者在各年龄均可发病。
GJB2、线粒体DNAA1555G、听力损失、年龄
1 National Natural Science Foundation of China(81570926);2 Gansu Provincial Youth Science and Technology Fund Projects(1606RJYA227)
Declaration of interest:The authors report no conflicts of interest.
目前,全世界范围内大概有3.6亿耳聋患者,其在发达国家新生儿中的发病率大约是3‰[1],在耳聋患者中,超过半数是由遗传因素引起的,其中缝隙连接蛋白beta2(GJB2)和线粒体DNA(mtDNA)A1555G是目前较为常见的致聋基因,本研究将耳聋致病基因型与患者听力学表型、发病年龄相结合进行分析,探讨耳聋基因型与相关临床表型的相关性。
1 资料与方法
1.1 研究对象
收集2006年9月~2015年12月中国西北五省部分特殊教育学校的学生及五省散发病例共2598例非综合征型耳聋患者,均为双侧感音神经性耳聋。男:1508女:1090男:女=1.38检测年龄0-70岁,平均:16.31±4.12。共13个民族:汉族:921维吾尔族:652回族:480东乡族:267哈萨克族:77藏族:65柯尔克孜族:35蒙古族:29保安族:20塔吉克族:19土族:17裕固族:10撒拉族:6,具有西北地区民族代表性。通过问卷调查和电话家访的方式进行患者病史及家系资料的采集,排除具有中耳病变病史患者及综合征型耳聋患者。对于3岁以上能够配合者由专业人员进行纯音听阈测定,对于年龄较小及不能配合者行ABR及声导抗检测。按照2003年Mazzoci等欧洲工作组倡导的遗传性聋的分级标准[2],将遗传性聋的听力损失程度分为四级:轻度聋:26~40dB、中度聋:41~70dB、重度聋:71~95dB、极重度聋:>95dB。双耳听力损失不等时则以较轻耳为标准。经签署知情同意书后采取2598例患者的外周静脉血(5~10ml)储存备用。
1.2 实验方法
1.2.1 基因组DNA的提取及储存
采用传统酚氯仿法抽提白细胞中的基因组DNA,50ulTE溶解DNA,用紫外分光光度计进行DNA浓度和纯度的检测,-80°储存备用。
1.2.2 GJB2及mtDNAA1555G基因扩增
利用聚合酶链式反应对GJB2第二外显子及mtD⁃NAA1555G进行扩增,引物由上海生工合成,GJB2: Cx26-F:TGCTTACCCAGACTCGAGAA和Cx26-R: CGACTGAGCCT TGACAGCTGA,PCR产物片段大小为864bp。mtDNAA1555G:F:5′-TCAACCTCAC⁃CACCTCTT-3′和R:5′-TTTGTCGCCTCTACC⁃TA T-3′,PCR扩增片段大小为767 bp。反应体系:25ul。(表1)
将GJB2目的片段及使用A1w26I内切酶进行酶切后呈现阳性的线粒体基因送生物公司测序。
1.2.3 PCR产物测序结果分析
将生物公司反馈的测序结果与野生型GJB2基因的标准序列(GenBank登录号:M86849)和经过校正的线粒体DNA剑桥标准序列(GenBank登录号:NC_001807)进行比对比,确定突变位点。
1.3 统计学方法
使用SPSS 19.0软件,对GJB2致病突变患者中的纯合与复合杂合突变患者的听力损失程度的差异进行卡方检验,并分别对GJB2和mtDNAA1555G突变阳性患者的听力损失程度、发病年龄构成比进行卡方检验,P<0.05为差异有统计学意义(行列资料中当理论频数小于5的格子数的比例20%的情况下使用Fisher确切概率法,余使用卡方检验)。
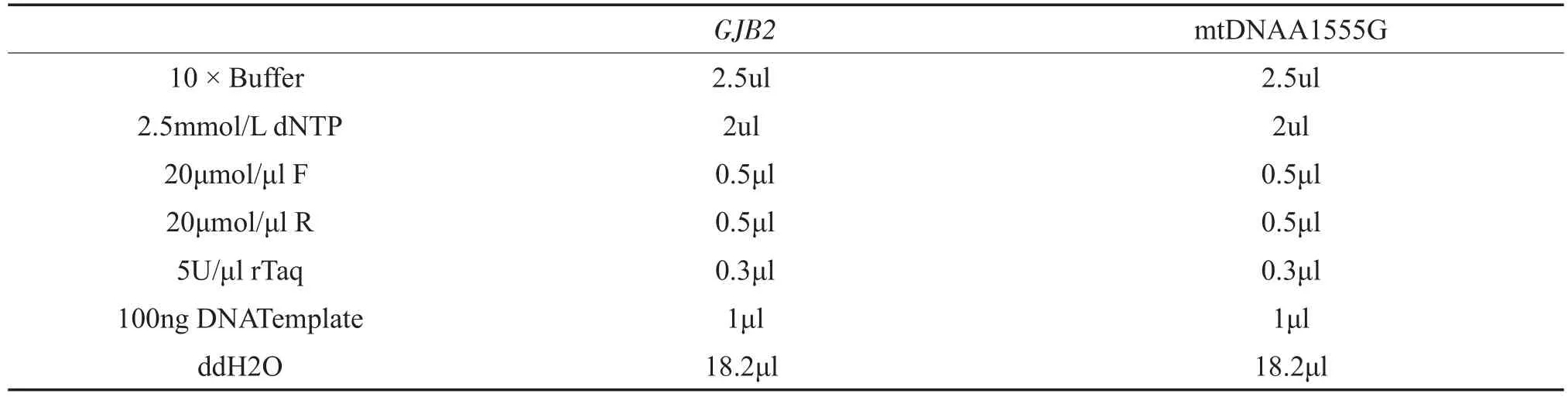
表1 GJB2及mtDNAA1555G基因扩增反应体系Table 1 GJB2 and mtDNAA1555G gene amplification reaction system
2 结果
2.1 GJB2与mtDNAA1555G致病突变的阳性检出结果
2598例NSHL患者中,明确由GJB2致病突变(双等位基因突变,排除常见的多肽及致聋机制不明确者)致聋的共有248例,突变率9.55%(248/2598),最常见的是235delC、299-300delAT、35delG,阳性检出率为74.60%(185/248)、31.05%(77/248)、15.32%(38/ 248)。176-191del16的阳性检出率为6.05%(15/ 248)。mtDNAA1555G阳性共有146例,突变率5.62%(146/2598),其中具有氨基糖苷类药物用药史者79例,可疑用药史者3例,用药史不详者31例,无用药史者33例。
2.2 GJB2纯合突变与复合杂合突变患者听力损失程度的对比分析
在248例GJB2致病突变患者中,GJB2纯合突变样本共142例,复合杂合突变样本共106例,纯合样本在极重度中的检出率最高,为74.65%(106/142),其次是重度与中度,分别为19.27%(28/142)、5.63%(8/142)。复合杂合样本同样在极重度检出率最高,为56.60%(60/106),重度、中度依次是37.74%(40/ 106)、5.66%(6/106)。纯合与复合杂合突变所致的听力损失程度之间的差异有统计学意义(χ2=10.064 P=0.007)。对235delC、299-300delAT、35delG纯合与复合杂合突变的听力损失程度分别进行卡方检验结果示235delC、299-300delAT纯合与复合杂合突变所致的听力损失程度之间差异具有统计学意义(χ2= 14.038 P=0.001、χ2=6.152 P=0.04)。35delG纯合与复合杂合突变所致的听力损失程度之间的差异无统计学意义(χ2=2.133 P=0.408)。(表2-1、2-2)
2.3 不同听力学表型人群的GJB2与mtDNAA1555G突变的阳性检出率
将耳聋患者的听力损失程度分为四度:轻度、中度、重度、极重度,在GJB2致病突变的患者中,极重度的比例最高,为10.43%(162/1553),其次依次为重度(8.81%,75/851)、中度(8.03%,11/137),轻度(0%)。四组之间的差异有统计学意义(χ2=8.32 P= 0.04)。在mtDNAA1555G阳性患者中,重度听力损失比例最高,为6.11%(52/851),其次是极重度(5.86%,91/1553)、轻度(1.75%,1/57)、中度(1.46%,2/137),四组之间差异无统计学意义(χ2=6.901 P= 0.068)。(表3)
2.4 不同发病年龄人群的GJB2与mtDNAA1555G突变的阳性检出率
本研究将发病年龄(y)分为成人组(y≥18)、婴儿组(y≤1)、幼儿组(1<y≤3)、学龄前组(3<y≤6)及学龄组(6<y<18)。将y≤3归为语前聋,y>3归为语后聋[3],GJB2致病突变患者中语前聋发病率为11.96%(236/2018),语后聋发病率为3.83%(9/235),二者之间的差异有统计学意义(χ2=13.434 P= 0.000)。不同发病年龄组之间的GJB2致病突变阳性检出率差异具有统计学意义(χ2=17.360 P=0.001)。A1555G阳性患者中语前聋发病率为5.90%(119/ 2018),语后聋发病率为6.38%(15/235),二者之间的差异无统计学意义(χ2=0.089 P=0.766),不同发病年龄组之间的A1555G阳性检出率差异无统计学意义(χ2=2.755 P=0.59)。GJB2与A1555G基因突变患者在发病年龄构成比上的差异有统计学意义(χ2=9.901 P=0.019)。(表4)

表2-1 GJB2纯合与复合杂合突变患者听力损失程度构成比Table2 -1 Proportion of hearing loss in patients with GJB2 homozygous and compound heterozygous mutations
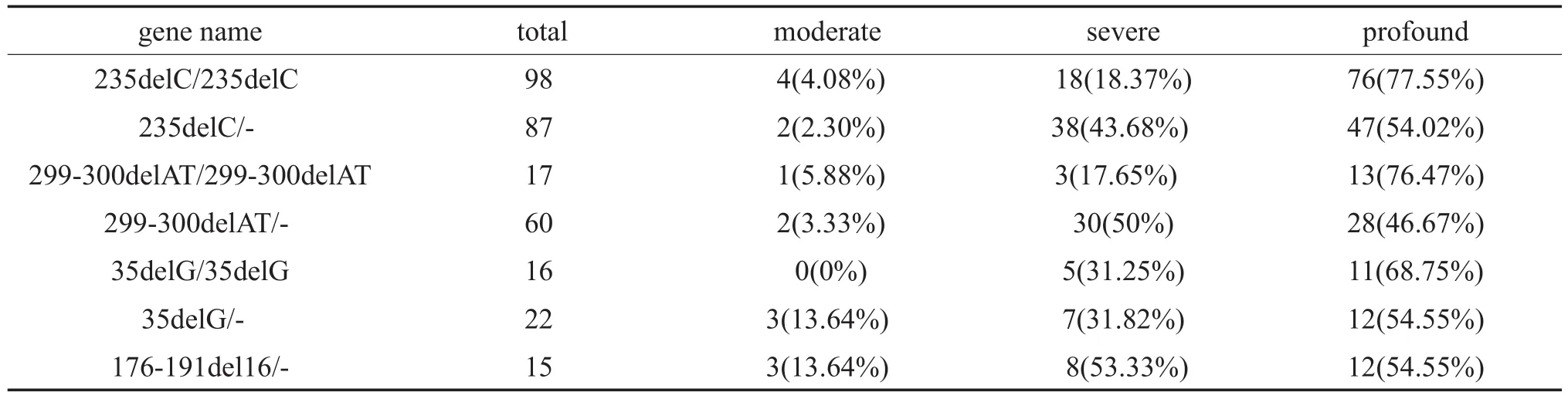
表2-2 GJB2不同基因型与听力损失程度构成比Table 2 -2 GJB2 different genotypes and the degree of hearing loss ratio
3 讨论
在2598例NSHL患者中,GJB2致病突变率为9.55%,低于全国GJB2总体致病突变率12.88%[4],这可能与地域、民族之间的差异以及样本的纳入标准不同有关。mtDNAA1555G阳性检出率5.62%,高于国内整体检出水平,但与朱庆文[5]对西北样本A1555G的检出率相近,说明西北地区的线粒体遗传背景有别于国内其他地区,具体原因仍需更进一步细致的分析。
GJB2致病突变引起的听力损失程度与基因突变类型和位点有关,多为重度和极重度听力损失[6]。本研究中,对248例GJB2致病突变的阳性患者进行听力学分析,发现纯合突变与复合杂合突变引起的听力损失程度都以极重度为主,纯合突变引起的听力损失程度要重于复合杂合突变引起的听力损失程度,他们之间的差异有统计学意义。另经统计学分析,235delC和299-300delAT纯合型突变患者听力损失程度要重于复合杂合型,而35delG纯合型与复合杂合型突变患者的听力损失程度无明显差异。但在Denoyelle等[7]的研究中表明35delG纯合型突变患者的听力损失要明显重于复合杂合型突变患者,这与本研究的结果不同,可能与地域不同、研究对象的种族不同等有关。
在248例GJB2致病突变的阳性患者中,极重度听力损失的比例最高,为10.43%,重度(8.81%)与中度(8.03%)相近,未检测到轻度听力损失患者,四组之间的差异有统计学意义,这与代志瑶[8]研究结果相近。A1555G突变患者的听力损失程度较GJB2轻,但差异较大,以重度(8.70%)为主,其次是极重度(4.44%)、轻度(1.75%)、中度(1.46%),四组之间的差异无统计学意义,可能与mtDNA的拷贝数、线粒体单倍型、外界环境因素及核修饰基因有关[9-11]。线粒体突变异质性对耳聋的发生与发展也有重要影响[12-13],与野生型mtDNA相比,突变型mtDNA具有复制优势,突变型mtDNA所占的比例越高,耳聋程度越严重[14]。另有研究证实氨基糖苷类药物对A1555G突变耳聋患者的临床表型具有诱发或加重作用[15],因A1555G位于氨酰tRNA核糖体小亚基的受体位点(A点位),这是一高度保守的区域,该突变使得线粒体12SrRNA上的第1494和1555两个位点形成新的碱基对(C1494-1555G),形成与氨基糖苷类药物结合的位点,从而影响线粒体蛋白质的合成而导致药物性耳聋[16]。2002年,Morales等[17]对 6个携带12SrRNA A1555G突变且无血缘关系的家系中的55位患者进行研究表明,未使用氨基糖苷类药物的耳聋患者听力损失多是迟发性的轻度至中度感音神经性耳聋,在17例使用氨基糖苷类药物的患者中多出现重度听力损失。本研究中,79例明确有氨基糖苷类用药史者,极重度聋占62.03%(49/79),重度占35.44%(28/79),中度占2.53%(2/79),在33例明确无氨基糖苷类用药史者,极重度占39.39%(13/33),重度占60.61%(20/33),可见氨基糖苷类药物可加重患者的听力损失程度,且应用药物的剂量越大、年龄越小,听力损失程度越重[18]。
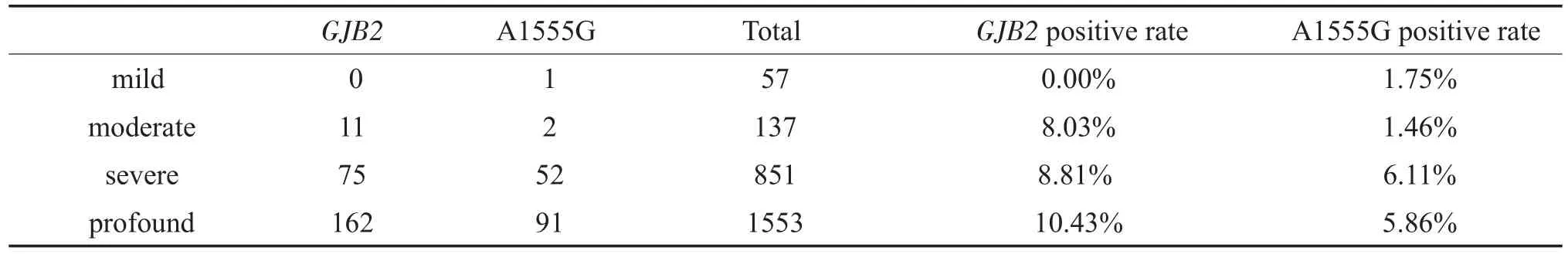
表3 GJB2与mtDNAA1555G突变阳性者的听力损失程度构成比Table 3 The degree of hearing loss in GJB2 and mtDNAA1555G mutation positive patients
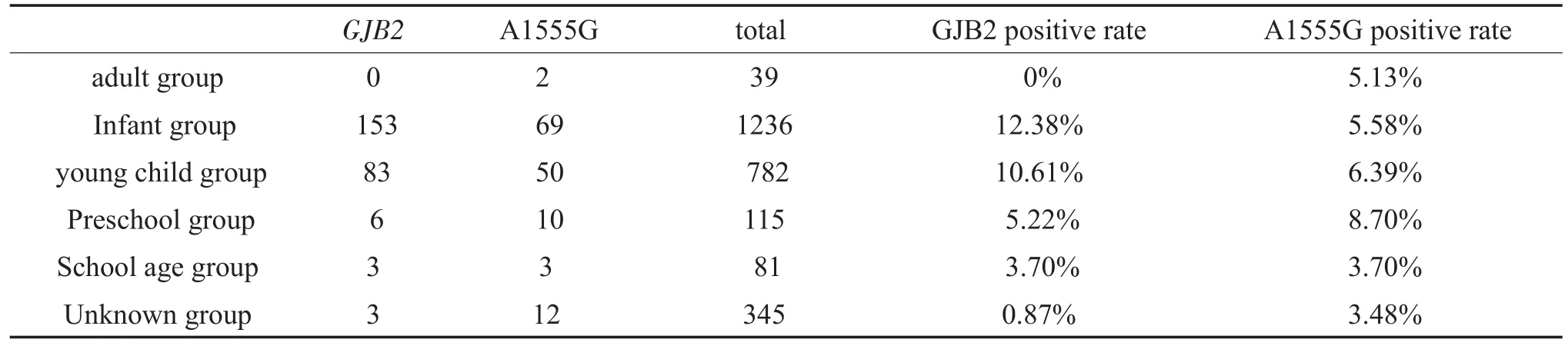
表4 GJB2与mtDNAA1555G突变阳性者的年龄构成比Table4 Age composition ratio of GJB2 and mtDNAA1555G mutation positive persons
GJB2致病突变的阳性患者的发病年龄主要集中在语前聋中,特别是y≤1的婴儿最常见,与语后聋之间具有显著的差异,因此临床医师在对耳聋患者基因筛查中,要特别重视语前聋患者,尤其是婴儿患者的GJB2筛查。A1555G突变阳性患者发病年龄分散,在语前聋与语后聋均可发病,差异无统计学意义,主要与氨基糖苷类药物的使用时间相关,患者可在使用药物后3天到3个月左右发病,严重者会出现“一针致聋”现象[19]。A1555G突变多见于母系遗传,因此在筛查中要对母系患者所有成员进行易感基因的筛查,检测出一例突变携带者,即可根据孟德尔遗传定律发现携带有突变但未耳聋的多名母系成员,对其进行用药指导,可以有效地避免药物性耳聋的发生。
GJB2与A1555G在西北地区有着较高的突变率,通过本研究,我们可以根据患者的听力损失程度及发病年龄优先选择不同的耳聋基因检测,婴幼儿患者、听力损失重者可优先筛查GJB2基因;发病年龄较晚、听力损失较轻者、有氨基糖苷类用药史者、怀疑母系遗传者可以优先选择A1555G基因筛查,做到早期干预。
本研究的一些不足之处:在部分偏远的西北地区,由于经济条件落后、文化水平低、患者本人及家属重视程度不足等会造成轻度听力损失患者不能及时发现自己的病情,因此会造成研究中轻度听力损失患者数据纳入的差异。另外,本研究的对象多来自西北五省特殊教育学校的未成年人,在年龄上未能全面覆盖西北耳聋人群样本,但本研究的结果仍可作为西北地区耳聋基因型与相关临床表型分析的一个参照。
1 White KR.Early hearing detection and intervention programs:oppor⁃tunities for genetic services.Am J Med Genet A,2004;130A:29–36.
2 Mazzoli M,Camp G V,Newton V,et al.Recommendations for the De⁃scription of Genetic and Audiological Data for Families with Nonsyn⁃dromic Hereditary Hearing Impairment[J].Audiological Medicine, 2009,1(2):148-150.
3 张初琴,陈波蓓,陈迎迎,等.不同年龄段非综合征性耳聋常见基因检测及临床表型分析[J].遗传,2013,35(3):352-358.
Zhang CQ,Chen BB,Chen YY,et al.Prevalence of common genetic mutations and clinical characteristics analysis in patients at differ⁃ent ages with nonsyndromic hearing impairment[J].Hereditas,2013, 35(3):352-358.
4 纪育斌,兰兰,王大勇,等.中国非综合征型聋患者GJB2基因突变流行病学文献荟萃分析[J].听力学及言语疾病杂志,2011,19(4): 323-327.
Ji YB,Lan L,Wang DY,et al.The Meta Analysis of Epidemiological Studies in Chinese NSHL Population with GJB2 Mutation[J].Journal of Audiology and Speech Pathology,2011,19(4):323-327.
5 朱庆文,刘新,韩东一,等.西北五省573例非综合征型耳聋患者线粒体DNA A1555G突变分析[J].临床耳鼻咽喉头颈外科杂志, 2007,21(10):460-462.
Zhu QW,Liu X,Han DY,et al.Molecular etiology of 573 patients with nonsyndromic hearing loss in 5 provinces of northwest region of China[J].Journal of Clinical Otorhinolaryngology Head and Neck Surgery(China),2007,21(10):460-462.
6 王国建,袁永一,李荣,等.不同听力学表型人群中常见耳聋基因突变检出率的分析[J].临床耳鼻咽喉头颈外科杂志,2011,25 (10):445-448.
Wang GJ,Yuan YY,Li R,et al.Analysis of positive rate of common genetic mutations in 1448 cases with different hearing phenotype[J]. Journal of Clinical Otorhinolaryngology Head and Neck Surgery(Chi⁃na),2011,25(10):445-448.
7 Denoyelle F,Marlin S,Weil D,et al.Clinical features of the preva⁃lent form of childhood deafness,DFNB1,due to a connexin-26 gene defect:implications for genetic counselling[J].Lancet,1999,353 (9161):1298-303.
8 代志瑶,孙宝春,黄莎莎,等.GJB2基因听力学表型与基因型关系分析[J].中华耳科学杂志,2014,12(1):34-36.
Dai ZY,Sun BC,Hang SS,et al.Audiological Features/Genotype Correlations in GJB2 Mutation[J].Chinese Journal of Otology,2014, 12(1):34-36.
9 欧启水,陈添彬.线粒体耳聋及其临床表型多样性的分子诊断[J].临床检验杂志,2012(10):787-792. Ou QS,Chen TB.Molecular diagnosis of mitochondrial deafness and its clinical phenotypic diversity[J].Chinese Journal of Clinical Labo⁃ratory Science,2012(10):787-792.
10 刘畅,高国凤,胡玉华,等.线粒体DNA突变致聋家系检测及单倍型分析[J].中华耳科学杂志,2010,08(04):402-406.
Liu C,Gao GF,Hu YH,et al.Mitochondrial DNA 1555G mutation detection and haplotype analysis in pedigrees with deafness[J].Chi⁃nese Journal of Otology,2010,08(04):402-406.
11 刘日渊,刘琪,郝青青,等.核修饰基因与氨基糖甙类药物在母系遗传性聋发病机制及功能研究[J].中华耳科学杂志,2013,11(3): 345-352.
Liu RY,Liu Q,Hao QQ,et al.Mechanism and Functional Research on Nuclear Modified Gene Associated with Maternally InheritedAminoglycoside-Induced Deafness[J].Chinese Journal of Otology, 2013,11(3):345-352.
12 Yan X,Wang X,Wang Z,et al.Maternally transmitted late-onset non-syndromic deafness is associated with the novel heteroplasmic T12201C mutation in the mitochondrial tRNA(His)gene[J].Journal of Medical Genetics,2011,48(10):682-90.
13 朱玉华,翟所强,戴朴.线粒体12SrRNAA1555G突变耳聋家系的异质率研究[J].中华耳科学杂志,2014,12(1):50-53.
Zhu YH,Zhai SQ,Dai P.Heteroplasmy Levels of Mitochondrial 12S rRNA A1555G Mutation in Pedigrees with Aminoglycoside-Induced and Non-Syndromic Hearing Loss as Detected Using SNaPshot Technique[J].Chinese Journal of Otology,2014,12(1):50-53.
14 程祖建,杨滨,江凌,等.非综合征型耳聋患者mtDNA A1555G异质性突变比例与临床表型的关系[J].中华耳科学杂志,2008,6(4): 381-384.
Cheng ZJ,Yang B,Jiang L,et al.Correlation between the percentage of mitochondrial DNA copies with the A1555G mutation and the phenotype of mitochondrial deafness[J].Chinese Journal of Otology, 2008,6(4):381-384.
15 Morales A C,Gallo T J,Del C I,et al.[Audiometric features of famil⁃ial hearing impairment transmitted by mitochondrial inheritance (A1555G)][J].Acta Otorrinolaringológica Espaola,2002,53(9): 641-8.
16 Guan M X.Molecular pathogenetic mechanism of maternally inherit⁃ed deafness[J].Annals of the New York Academy of Sciences,2003, 1(1011):259-71.
17 Morales A C,Gallo T J,Del C I,et al.Audiometric features of famil⁃ial hearing impairment transmitted by mitochondrial inheritance (A1555G)[J].Acta Otorrinolaringológica Espaola,2002,53(9):641-8.
18 丁立才,刘玉和,马祎楠,等.线粒体基因组A1555G突变致非综合征性聋患者的临床表型分析[J].中国听力语言康复科学杂志, 2008(3):30-32.
Ding LC,Liu YH,Ma YN,et al.Analysis of clinical characteristics of patients with non-syndromic hearing impairment induced by mtD⁃NA A1 555G mutation[J].Chinese Scientific Journal of Hearing and Speech Rehabilitation,2008(3):30-32.
19 轩贵平,郭紫芬,李天平,等.氨基糖苷类抗生素性耳聋的研究进展[J].实用医学杂志,2013,29(23):3830-3831.
Xuan GP,Guo ZF,Li TP,et al.Research progress in the study of the properties of amino glycosides in the deaf[J].Journal of Practical Medicine,2013,29(23):3830-3831.
Analysis of Genotypes and Clinical Phenotypes in 2,598 Patients with Non-Syndromic Deafness
WANG Fang1,CHEN Xiaowan2,XU Baicheng1,LIU Xiaowen1,ZHU Yiming1,CHEN Xingjian1,GUO Yufen1
1 Department of Otolaryngology Head and Neck Surgery,the Second Hospital of Lanzhou University(Lanzhou,730030)
2 Department of Otolaryngology Head and Neck Surgery,the First Hospital of Lanzhou University(Lanzhou,730030)
ObjectiveTo investigate the correlation between GJB2 gene and mitochondrial DNAA1555G mutation and clinical audiology and age of onset in non-syndromic deafness.MethodsGJB2 and mitochondrial DNAA1555G mutations were tested in 2,598 patients with non-syndrome deafness and the results analyzed.ResultsHearing loss caused by GJB2 homozygous mutations was different from that caused by GJB2 compound heterozygous mutations(χ2=10.064,P= 0.007).The rate of GJB2 pathogenic mutations was highest in patients with profound hearing loss(10.43%),followed by patients with severe(8.81%)and moderate hearing(8.03%)(χ2=8.32,P=0.04).No GJB2 pathogenic mutation was found in patients with mild hearing loss.The mtDNAA1555G detection rate showed no significant difference among patients with different degrees of hearing loss(χ2=6.901,P=0.068).The prevalence of GJB2 pathogenic mutations was higher in patients with pre-lingual deafness(11.96%)than those with post-lingual deafness(3.83%)(χ2=13.434,P=0.000),while the prevalence of mtDNAA1555G mutation showed no significant difference(χ2=0.089,P=0.766).The age of deafness onset was dif-ferent in patients with GJB2 mutations than those with mtDNAA1555G mutation(χ2=9.901,P=0.019).ConclusionsOur study shows that hearing loss in patients with GJB2 homozygous mutations is more severe than those with compound mutations,and is in the profound loss category in most cases.Hearing loss in patients with mtDNAA1555G mutation is relatively mild.GJB2 mutations tend to cause pre-lingual onset deafness,while mtDNAA1555G mutation seems to affect patient of various ages.
GJB2、mitochondrial DNAA1555G、hearing loss、age
R764.43
A
1672-2922(2016)06-747-6
2016-09-03审核人:翟所强)
10.3969/j.issn.1672-2922.2016.06.010
国家自然科学基金项目(编号:81570926)、甘肃省省青年科技基金计划(编号:1606RJYA227)
王芳,硕士研究生,研究方向:耳聋基因型与相关临床表型
郭玉芬,Email:gyflhmm@163.com

