MTs在肝癌发生和发展中的作用及中医药防治机制*
方肇勤,梁 超,卢文丽,张园园,彭 磊
(上海中医药大学基础医学院 上海 201203)
MTs在肝癌发生和发展中的作用及中医药防治机制*
方肇勤**,梁 超,卢文丽,张园园,彭 磊
(上海中医药大学基础医学院 上海 201203)
本文简要综述了近十多年来,本项目组探索金属硫蛋白家族(Metallothioneins,MTs)在肝癌发生与发展中的作用及其中医药防治机制。研究发现,MTs对于肝癌细胞恶性增殖是必要的,在不同应激状态下肝癌细胞MTs表达会显著增加,MTs可能通过上调肝癌细胞核糖体蛋白等基因的表达发挥促进其恶性增殖的作用。MTs在肝癌细胞中的过表达,可能直接改变了细胞核内离子的平衡,并通过与多基因的相互作用,发挥促进肝癌细胞恶性增殖基因表达的作用。中医药防治肝癌常用治法方药可以不同程度地减轻和缓解由二乙基亚硝胺(Diethylnitrosamine,DEN)所造成的肝毒性和损伤作用,降低MTs表达,提示在肝脏保护、抑制其异常增生和肝癌发展方面十分重要。
原发性肝癌 金属硫蛋白 基因表达 RNA干扰 治法 中药
原发性肝癌(Hepatocellular Carcinoma,Hcc,简称肝癌)是中国重大疾病,居恶性肿瘤死亡率前位,发病人数约占全球的55%。由于肝癌的发生机制十分复杂,以及临床前基础与应用研究相对薄弱,近年来肝癌各种疗法的5年生存率已接近极限,因而对基础研究提出了愈来愈迫切的要求。
在肝癌防治方面,中医药一直发挥着十分重要的作用,其优势在对肝脏保护、副作用小、症状改善和延长带瘤生存期等方面。中医药讲究辨证论治,针对肝癌患者常见脾气虚弱、气滞血瘀、痰热邪毒等证候,给予健脾益气、行气活血、清热解毒等治法方药。我们采用这些代表性治法方药开展了大量的大鼠、小鼠肝癌防治研究,验证了其疗效和特点。
2003年,在自然基金的资助下,本课题组研究发现,采用DEN诱导大鼠肝癌,至肝脏恶性增殖及肝癌形成阶段MT2表达显著增加,提示MT2与肝癌恶性增殖密切相关。与肝癌模型组比较,中药不同治法复方给药后,对其均呈不同程度的下调(图1、图2)。
本课题组研究还发现,伴随MT2上调,大鼠肝癌(含肝组织)中表达增加的还有结构蛋白、转录、DNA结合等信号通路的基因群,提示MT2可能直接或间接促进了这些通路基因的表达。
MTs是一种普遍存在的一种低分子量、富含半胱氨酸的金属结合蛋白,在其集团中存在两个天然锌(2+),在整个进化过程中高度保守。MTs分为MT1-4类,如:MT2。人类MTs基因位于染色体16q13,含有MT1E、MT1F、MT1G、MT1H、MT1X、MT2A等10个亚型的编码区,有18亚型的多种异构体;不同类型的细胞表达不同的MT亚型。MTs在细胞的细胞浆和细胞核中均有分布。
因此,课题组将MTs在肝癌发生与发展中的作用作为研究方向,经多年探索,一些问题开始明朗起来。简要介绍如下。
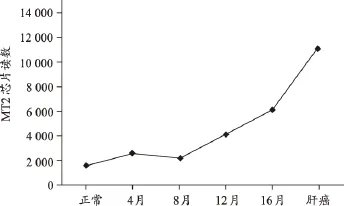
图1 MT2在DEN诱导大鼠肝癌不同阶段的表达
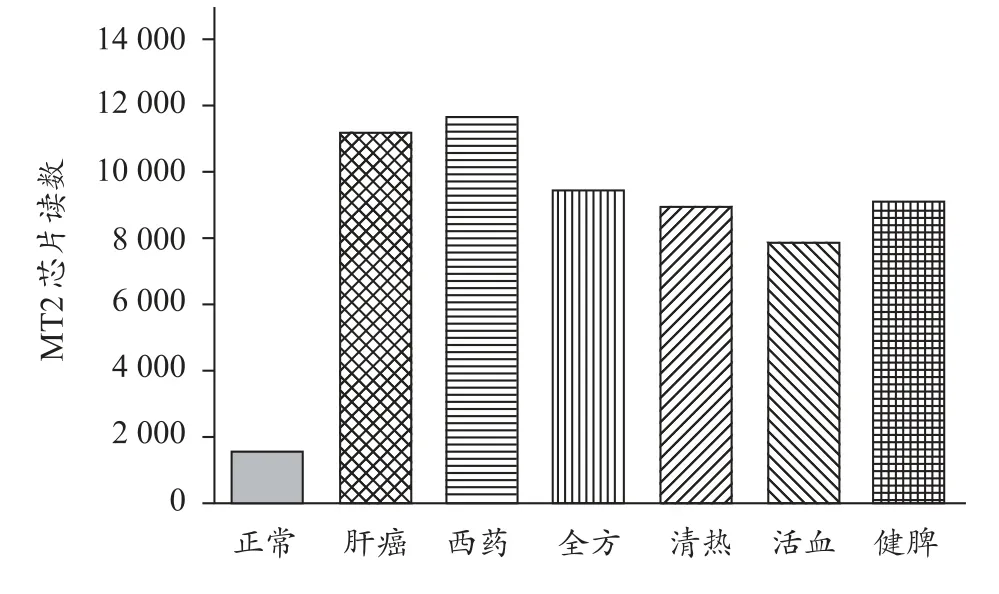
图2 不同治法对大鼠肝癌MT2的调节作用
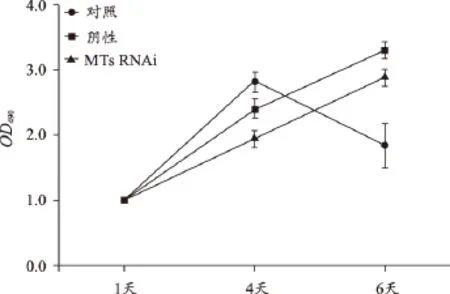
图3 MTs RNAi后SMMC7721细胞增殖减缓
1 MTs对于肝癌细胞恶性增殖是必须的
采用RNAi令MTs表达后沉默,会引发细胞增殖变缓,提示SMMC7721肝癌细胞的恶性增殖依赖该基因(图3)。
筛选并获得了稳定的转染MTs shRNA质粒的单克隆细胞(图4)。该细胞增殖减缓、贴壁差(图5),冻存后难以复苏。再次表明MTs对于肝癌细胞恶性增殖是必须的。
2 MTs促进肝癌细胞增殖活跃
在SMMC7721细胞培养中,较之增殖不活跃的细胞,增殖活跃细胞的金属硫蛋白2A(MT2A,MTs的成员之一,是SMMC7721肝癌细胞中高表达的MTs的成员)表达增加,亦提示MT2A对于肝癌细胞恶性增殖是重要的。

图4 常规培养的SMMC7721肝癌细胞
图5 转染MTs RNAi质粒的单克隆肝癌细胞
3 MTs具有促进肝癌细胞抵御不同应激因子的作用
研究发现,多数不同应激因子作用体外培养的肝癌细胞,会引发肝癌细胞的应激反应,其时MT2A表达显著增加。表明MT2A在肝癌细胞抵御不同应激方面均发挥着重要的作用。例如:①转染质粒扩增后,细胞处于转染后应激状态,MT2A表达增加;②脂质体转染应激,可令MT2A轻度上调;③氯化钙应激,可令MT2A表达严重上调。
4 MTs对中药有效成分也具有抵御作用
本课题组观察了预知子种子乙醇提物、正丁醇萃取物,以及其诱导内质网应激的主要成分皂苷E等对体外肝癌细胞MTs的表达作用,发现MTs一致出现上调[1-3];而非象整体实验那样,中药复方令大鼠肝癌组织MTs表达下调。
5 肝癌细胞具有复杂的抵御应激网络,相互补偿
当MTs敲除后,另一些抵御应激的途径会激活,如:胆固醇生物合成通路,以及G1到S期、G蛋白信号、炎症反应、糖原代谢、脂肪酸降解通路等。以上表明,肝癌细胞内存在复杂的抵御应激因子的网络,一些分子或通路被抑制,如MTs,另一些分子或通路便会活跃,进行补偿。这也是肿瘤难治的机制之一。
6 MTs还可能通过上调多基因来抵御应激因子
表达谱芯片检测表明,在质粒过表达等应激条件下,MTs过表达可能会促进核糖体蛋白、DNA复制、mRNA加工结合、细胞周期等通路基因的表达,诸如RPS10、RPS20、RPS23、RPL19、RPL31,CDC2;促进包括HSP、ATF在内的一些抵御应激基因的表达;以及促进包括eIF2、RPL在内的一些参与基因翻译基因的表达。而当MTs表达后沉默,这些通路基因的表达便会下调。
在G418诱导的细胞应激时,MTs具有促进细胞周期、G1至S细胞周期反应、核糖体蛋白、RNA转录、核受体等通路基因的表达。而当MTs表达后沉默,这些通路基因的表达量会发生下调。这些现象均表明,MTs还可能通过上调多基因来抵御应激。
7 MTs确有上调核糖体蛋白等基因表达的作用
在多次的重复实验中,当MTs表达沉默后,一些基因,如若干核糖体蛋白RPL4、RPL11、RPL12、RPL19、RPS23等会出现较为恒定的下调,表明MTs确有直接或间接地促进这些基因的表达作用。那么,是不是MTs通过促进这些基因的表达来实现促进肝癌细胞的恶性增殖呢?
8 MTs可能通过上调核糖体蛋白等基因发挥促进肝癌细胞恶性增殖的作用
本课题组采用RNAi方法,检测RPL4、RPL11、RPL12、RPL19、RPS23等5个基因对细胞恶性增殖的作用。发现当分别令这些基因表达沉默后,细胞增殖确被抑制;而且这些基因的表达沉默,或对其它一些基因的表达发生影响。
RPL4敲除后细胞增殖减缓,提示RPL4有助于细胞增殖(图6);RPL4敲除后,伴随的是MT2A、RPL11、RPL12、RPL19、RPS23等不同程度下调,提示RPL4还有助于这些基因的表达(图7)。
RPL11敲除后细胞增殖减缓,提示该基因有助于细胞增殖(图8);RPL11敲除后,伴随的是几乎所有基因上调(图9)。
RPL12敲除后细胞增殖减缓,提示该基因有助于细胞增殖(图10);RPL12敲除后对MT2A、RPL19、RPL11、RPS23等基因的表达,没有显著的影响;RPL4例外(图11)。
RPL19敲除后细胞增殖放缓,提示该基因有助于细胞增殖(图12);RPL19敲除后伴随的是MT2A、RPL11下调,提示RPL19可能会促进MT2A、RPL11的表达(图13)。
RPS23敲除后细胞增殖放缓,提示该基因有助于细胞增殖(图14);RPS23敲除后伴随的是RPL11下调,其余上调;提示RPS23具有促进RPL11的表达;而抑制MT2A、RPL12、RPL19等基因的表达(图15)。
以上研究结果表明:RPL4、RPL11、RPL12、RPL19、RPS23等基因表达确有促进肿瘤细胞恶性增殖的作用,亦即这些基因对于肿瘤细胞恶性增殖是必须的。其中,RPL4、RPL19还显示出对多基因具有促进其表达的作用,即还可能具有调节有关基因表达调节的作用。
9 MTs可能的复杂作用机制
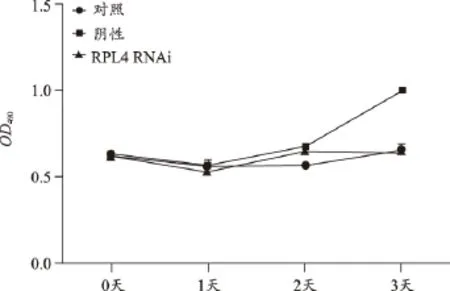
图6 RPL4表达沉默后对细胞增殖的影响
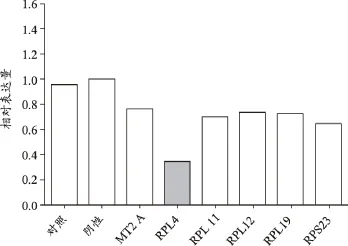
图7 RPL4表达沉默后对有关基因表达的影响
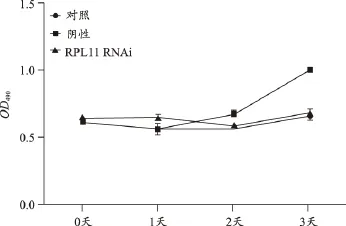
图8 RPL11表达沉默后对细胞增殖的影响
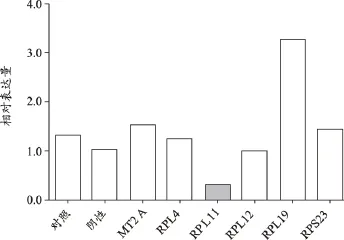
图9 RPL11表达沉默后对有关基因表达的影响
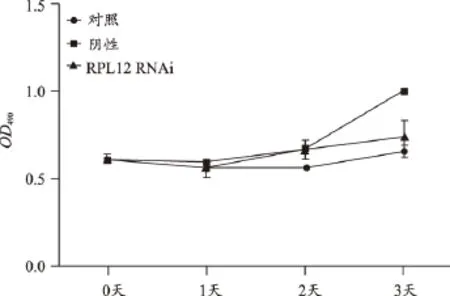
图10 RPL12表达沉默后对细胞增殖的影响
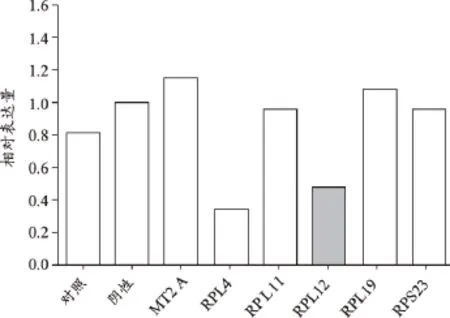
图11 RPL12表达沉默后对有关基因表达的影响
期间,我们还不断跟踪国内外有关MTs研究的进展[4-22],观察到:①MTs参与了细胞内金属稳态和代谢,其表达改变与金属毒性和代谢、许多疾病有关;②MTs作为锌指转录调节子的金属库,在炎症和细胞增殖等过程中起到重要作用等,负调节细胞凋亡;③大多数MT亚型的表达可以被各种物质所诱导,例如:金属、细胞因子和激素等。MTs基因敲除小鼠研究发现,MTs为不仅对金属的毒性和氧化应激具有保护作用,而且对化学和辐射致癌等因素均具有重要的保护作用;④MTs还与其它蛋白发生互作用。业已发现,MT2与巨蛋白和相关受体相互作用,与中枢神经系统蛋白质相互作用,通过与巨蛋白或/和脂蛋白受体相关蛋白受体互作用,与铁蛋白和牛血清白蛋白相互作用。有实验证据表明,哺乳动物MT与3种蛋白间存在互作用,而已知这3种蛋白突变结构和故障是直接与肿瘤发生相关的:两个转录因子(p53和NF-κB)和PKC μ蛋白激酶信号转导。⑤MTs在癌证增殖和耐药性中发挥作用,并已被广泛地作为多种肿瘤进展和耐药性的分子标记。
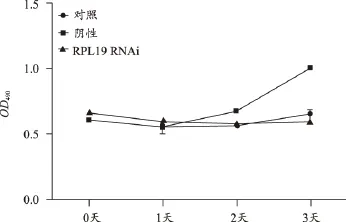
图12 RPL19表达沉默后对细胞增殖的影响
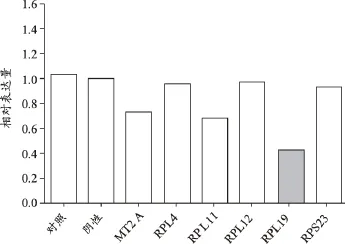
图13 RPL19表达沉默后对有关基因表达的影响
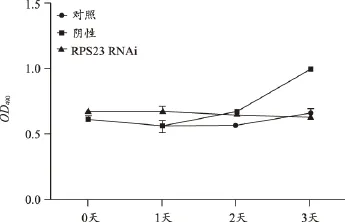
图14 RPS23表达沉默后对细胞增殖的影响
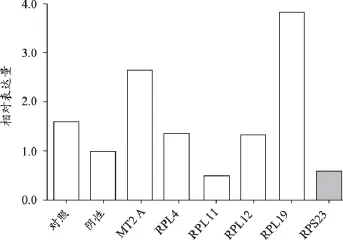
图15 RPS23表达沉默后对有关基因表达的影响
10 结论和思考
在肝癌细胞处于应激状态时,如:各种治疗、变性、修复等,MTs会表达增加,并向细胞核内迁移,直接改变了细胞核内离子的浓度与平衡,发挥其对基因表达的调节作用。MTs可能还通过与多基因的互作用,发挥其对基因表达的调节作用。MTs直接或间接地促进了包括核糖体蛋白在内的多基因、多通路相关基因的表达,进而促进了肝癌细胞的恶性增殖。整体动物实验中,中药常用治法方药可以不同程度地减轻和部分缓解由DEN所造成的肝毒性和损伤作用,从而使得大多肝细胞的应激得到一定程度地缓解,MTs表达下降;而并非直接下调肝癌细胞的MTs表达。这一实验结果还提示,在临床肝癌的防治过程中,应重视肝脏的保护和炎症的控制,以杜绝其由慢性炎症向异常增生、肝癌转变和发展,且提高患者的生存质量;这对改善和纠正肝癌组织周边微环境,提高肝癌疗效也是十分重要的;这也表明,中药在肝癌综合治疗中具有十分重要的作用。
1 Lu W L, Ren H Y, Liang C, et al. Akebia trifoliate (Thunb.) koidz seed extract (ATSE) inhibits the proliferation of human hepatocellular carcinoma cell lines via inducing endoplasmic reticulum stress. Evid Based Complement Alternat Med, 2014, 2014:192749.
2 任红艳,方肇勤,梁超.预知子籽及预知子抑制肝癌细胞恶性增殖的研究.中华中医药学刊,2014,32(6):1310-1312,插图Ⅵ,Ⅶ.
3 任红艳,方肇勤,梁超.预知子籽对多种肝癌细胞恶性增殖的抑制作用研究.辽宁中医杂志,2015,42(3):459-461,插图I,II.
4 Laukens D, Waeytens A, De Bleser P, et al. Human metallothionein expression under normal and pathological conditions: mechanisms of gene regulation based on in silico promoter analysis. Crit Rev Eukaryot Gene Expr, 2009, 19(4):301-317.
5 Thirumoorthy N, Shyam Sunder A, Manisenthil Kumar K, et al. A review of metallothionein isoforms and their role in pathophysiology. World J Surg Oncol, 2011, 9:54.
6 Mehus A A, Muhonen W W, Garrett S H, et al. Quantitation of human metallothionein isoforms: a family of small, highly conserved, cysteinerich proteins. Mol Cell Proteomics, 2014, 13(4):1020-1033.
7 Eckschlager T, Adam V, Hrabeta J, et al. Metallothioneins and cancer. Curr Protein Pept Sci, 2009, 10(4):360-375.
8 Raudenska M, Gumulec J, Podlaha O, et al. Metallothionein polymorphisms in pathological processes. Metallomics, 2014, 6(1):55-68.
9 Jagielski L, Jelen M, Kobierzycki C, et al. Increase of nuclear expression of metallothionein I/II in neoplastic transformation of the endomnetrium. Ginekol Pol, 2015, 86(3):182-187.
10 Surowiak P, Materna V, Györffy B, et al. Multivariate analysis of oestrogen receptor alpha, pS2, metallothionein and CD24 expression in invasive breast cancers. Br J Cancer, 2006, 95(3):339-346.
11 Fan L Z, Cherian M G. Potential role of p53 on metallothionein induction in human epithelial breast cancer cells. Br J Cancer, 2002, 87(9):1019-1026.
12 Saito C, Yan H M, Artigues A, et al. Mechanism of protection by metallothionein against acetaminophen hepatotoxicity. Toxicol Appl Pharmacol, 2010, 242(2):182-190.
13 Gumulec J, Raudenska M, Adam V, et al. Metallothioneinimmunohistochemical cancer biomarker: a meta-analysis. PLoS One, 2014, 9(1):e85346.
14 Takahashi S. Molecular functions of metallothionein and its role in hematological malignancies. J Hematol Oncol, 2012, 5:41.
15 Jadhav R R, Ye Z, Huang R L, et al. Genome-wide DNA methylation analysis reveals estrogen-mediated epigenetic repression of metallothionein-1 gene cluster in breast cancer. Clin Epigenetics, 2015, 7(1):13.
16 Starska K, Bryś M, Forma E, et al. Metallothionein 2A core promoter region genetic polymorphism and its impact on the risk, tumor behavior, and recurrences of sinonasal inverted papilloma (Schneiderian papilloma). Tumour Biol, 2015,36(11):8559-8571.
17 Ruttkay-Nedecky B, Nejdl L, Gumulec J, et al. The Role of Metallothionein in Oxidative Stress. Int J Mol Sci, 2013, 14(3):6044-6066.
18 Fujiwara Y, Satoh M. Protective role of metallothionein in chemical and radiation carcinogenesis. Curr Pharm Biotechnol, 2013, 14(4):394-399.
19 McGee H M, Woods G M, Bennett B, et al. The two faces of metallothionein in carcinogenesis: photoprotection against UVR-induced cancer and promotion of tumour survival. Photochem Photobiol Sci, 2010, 9(4):586-596.
20 Atrian S, Capdevila M. Metallothionein-protein interactions. Biomol Concepts, 2013, 4(2):143-160.
21 Isani G, Carpenè E. Metallothioneins, unconventional proteins from unconventional animals: a long journey from nematodes to mammals. Biomolecules, 2014, 4(2):435-457.
22 Alam S, Kelleher S L. Cellular mechanisms of zinc dysregulation: a perspective on zinc homeostasis as an etiological factor in the development and progression of breast cancer. Nutrients, 2012, 4(8):875-903.
Abstract:It is a brief review of our research on the role of metallothioneins (MTs) in the occurrence and development of hepatocellular carcinoma (Hcc) in more than a decade, and the mechanism of prevention and treatment for Hcc in the field of TCM. It was found that MTs were required for the malignant proliferation of Hcc cells and their expressions significantly increased under different levels of stress. MTs may exert their effects on promoting proliferation via increasing ribosomal protein gene or other gene expressions. The over-expressions of MTs directly altered the balance of ions in the cell nucleus, and interacted on the genes promoting malignant proliferation. Hepatotoxicity and hepatic damage caused by DEN were reduced and relieved to different extents by the representative formula or constitute, which under the common therapeutic principle, by which MTs expressions were down-regulated as well. In conclusion, both effects above are important in the liver protection, inhibition of hyperplasia and carcinogenesis.
The Role of Metallothioneins (MTs) in the Occurrence and Development of Hepatocellular Carcinoma and Mechanism Behind the Prevention and Treatment of Traditional Chinese Medicine
Fang Zhaoqin, Liang Chao, Lu Wenli, Zhang Yuanyuan, Peng Lei
(School of Basic Medical Sciences, Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China)
Hepatocellular carcinoma, metallothionein, gene expression, RNAi, therapy, traditional Chinese medicine
10.11842/wst.2016.12.004
R2-03
A
(责任编辑:朱黎婷,责任译审:朱黎婷)
2016-11-16
修回日期:2016-12-15
* 国家自然科学基金委面上项目(81273641):MTs在肝癌细胞应激反应中的作用及不同治法调节机制的研究,负责人:方肇勤;国家自然科学基金委面上项目(30973703):若干中医治法下调基因沉默后肝癌细胞动力学基因表达谱分析,负责人:方肇勤;国家自然科学基金委面上项目(30672574):采用RNAi检测若干与中医治法相关肝癌高表达新基因的作用,负责人:方肇勤;国家自然科学基金委面上项目(30271576):不同治法对大鼠肝癌后基因组转录调控的进一步研究,负责人:方肇勤。
** 通讯作者:方肇勤,教授,博士生导师,主要研究方向:中医证候与辨证论治基础研究。

