中药注射剂安全性医院集中监测研究数据管理内容与要点*
刘 智,郑文科,张俊华,翟静波,曹红波,刘春香,王 辉
(天津中医药大学循证医学中心/临床评价研究所 天津 300193)
中药注射剂安全性医院集中监测研究数据管理内容与要点*
刘 智,郑文科,张俊华**,翟静波,曹红波,刘春香,王 辉
(天津中医药大学循证医学中心/临床评价研究所 天津 300193)
按照中药注射剂安全性再评价相关要求,中药注射剂安全性医院集中监测研究陆续展开。安全性集中监测研究属于大规模真实世界研究,涉及到大量数据的采集、传递、核查和分析。数据采集和数据核查的质量,直接影响数据分析和研究结果的真实性和可靠性。因此,数据管理是中药注射剂安全性集中监测研究的重要环节。在分析前期相关研究的基础上,结合项目实施的经验和体会,本文探讨了中药注射剂安全性集中监测研究数据管理实施内容、环节及常出现的问题及相应的解决方法。
中药注射剂 安全性 集中监测 数据管理
中药注射剂是一种现代中药剂型,在危重症防治中发挥了重要作用[1]。随着其临床用量的增长,其安全性问题也越发突出。与化学药不同,中药注射剂以往的安全性研究基础薄弱,其临床风险的可知性差[2]。自国家食品药品监督管理局(CFDA)启动中药注射剂安全性再评价工作以来,围绕中药注射剂安全性的研究不断增多,特别是安全性医院集中监测研究,成为现阶段研究中药注射剂临床风险的重要方法,已开展多个研究项目[3]。安全性医院集中监测研究具有样本量大、中心多、范围广等特点,虽然研究方案相对简单,但数据采集和数据管理的难度却比有效性试验的大。如果没有规范的数据管理办法和管理平台,难以保证获取研究数据的质量。基于《中医临床研究实施过程与管理》的质控要求[4],结合前期同类研究的实施经验,本文介绍中药注射剂安全性医院集中监测研究不同环节数据管理的要点和措施。
1 数据管理的定义和内容
1.1 临床研究数据管理
数据管理的目的是用及时、高效的方法为临床研究结果提供真实、完整的高质量的临床数据[5]。具体步骤:临床医生根据临床研究方案规范、有序地将临床研究数据输入临床试验管理系统;由临床数据管理员建立标准化的临床研究数据库,并在临床研究期间内对临床数据进行严格的逻辑审核、医学编码、数据质疑及处理、数据盲态审核和数据库锁定等研究工作。
1.2 临床数据管理的组成内容
中药注射剂安全性集中监测研究数据管理由计划阶段、进行中、结束后数据管理3个阶段组成,主要包括由数据管理方案设计、数据库设计、数据采集、数据逻辑核查、药品编码审核、数据库锁定、数据导出等7个部分[6]。
1.3 安全性集中监测研究和既往研究数据管理的异同点
众所周知,中药注射剂安全性集中监测研究与新药临床研究有着本质区别(表1)。因此,中药注射剂安全性集中监测研究数据管理的方式和内容与新药研究也存在明显差异。前者的数据管理既要遵循新药临床试验数据管理规范的要求,也要考虑安全性研究的特点,以形成一套新的数据管理模式。
2 集中监测研究数据管理的关键环节(图1)和要求(图2)

表1 中药注射剂安全性集中监测研究数据管理的特点
2.1 集中监测研究准备阶段的数据管理工作
2.1.1 制定数据管理计划(Data Management Plan,DMP)
为保证安全性集中监测研究数据的及时性、完整性和真实性,研究开始前需要制定包括数据采集及数据核查在内的一系列工作步骤和具体要求[7]。在中药注射剂安全性监测中,数据管理计划中要明确涉及数据相关角色的工作职责的操作规程,明确任务和责任,以保障数据相关人员的工作效率和质量,为获得高质量的安全监测数据提供制度保障。
2.1.2 优化研究数据管理流程
在研究的设计阶段,临床数据管理员应该尽早参与,对数据管理流程进行优化,减轻研究者的负担[8]。例如,研究数据可以从监测点直接通过数据管理系统报告给数据管理中心,而不必通过分中心转交。
2.1.3 数据管理系统的搭建
安全性集中监测远程电子数据获取已经成为常态。由于实施监测中心多、招募病人数量大,参与获取监测数据的研究人员多,数据库设计必须要考虑预留足够的研究中心,对不同的角色分配相应的权限,同时注重操作界面的友好性和数据提交的通畅性,这需要选择合适的电子数据管理系统。电子病例报告表(Electronic Case Report Form,eCRF)设计是数据管理系统搭建的重要内容,高质量的eCRF对提高研究者依从性、减少数据错误、提高数据质量等具有重要作用[9]。因此,eCRF的设计和优化非常重要,要求做到逻辑清晰、结构简单、重点突出 。
2.1.4 编写逻辑核查程序
逻辑核查是指利用计算机编写程序,对已录入的数据进行核查,发现数据异常,以实现及时质询和修订。通过编译好的逻辑核查程序对关键数据界值进行限定,实现数据采集过程中的动态提示,可以减少后期异常数据产生的数量,也能减少数据核查工作量,从而可以提高临床数据质量。
2.2 集中监测进行阶段的数据管理工作
2.2.1 数据采集
数据采集是数据产生的源头,也是容易出现问题的阶段,数据的准确性、及时性和完整性直接影响后续的数据管理工作[10]。为了保证数据采集的质量,需要对研究者进行多次方案和操作的培训,做到执行一致,减少偏差;强化研究者的依从性,减少缺失值,减少误报、错报等现象。
2.2.2 数据核查和审查
为了保证数据的质量,为统计分析提供真实、有效、准确、完整的数据,需要对研究者填报的数据进行核查(监查员)和审查(数据管理员)。由于安全性监测研究样本量大、地域覆盖广、单位多、数据信息复杂等因素,一旦出现缺失和异常数据应该及时处理,否则到后期数据清理的任务量极大,不仅影响纠正错误的时机,也会耽误整个研究的进度[11]。所以,及时、严格进行数据核查和审核,对于中药注射剂安全性监测研究至关重要。数据核查的基本原则是真实、完整、一致。数据清理是落实数据核查的步骤,主要包括原始数据清理和过程数据清理,数据清理的基本原则是准确、留痕、可溯源[12]。
2.2.3 数据锁定与解锁
完成既定数据采集要求,并解决所有数据疑问后,需要锁定数据库。通常,锁库后的数据是真实、准确、可靠的数据。锁库是开始统计分析的前提,然而,中药注射剂安全性集中监测研究数据极其复杂,数据库锁定后,在统计分析阶段依然可能发现一些数据问题,有些可能需要进一步修正,这就涉及到数据库解锁。然而解锁数据库需要完成一定的审批流程,保证过程留痕,确保数据的真实。
2.3 集中监测结束阶段的数据管理工作
2.3.1 数据传输
在集中监测数据管理中,监测过程就是数据在不断收集、审核与清理的过程。在整个过程中,新录入的数据问题被不断的发现,并不断审核清理,直到最后清理完所有录入的数据。这些最终用于统计分析的数据都关系着临床研究中药物的安全性与有效性,因此数据本身的安全、顺畅传输也很重要。
一般来说,数据传输中经常遇到以下问题:①文件名不规范,变量名没有统计的命名,传送者容易误传文件信息;②数据编写程序无验证,被导出的数据不论是一次性传输还是多次导出都需要对所编写的导出程序进行验证,以保证数据的完整性和安全性;④缺少数据传输清单。
常用的安全性监测数据传输的方法:①建立数据传输变量名规范清单;②建立数据导出验证机制;③建立传送数据集传送文件清单。
2.3.2 数据存档
在集中监测研究中,数据的完整与安全是保证集中监测项目顺利实施的基本保障,主要是指防止数据可能受到的物理破坏或恶意销毁。因此,数据如何进行安全储存是集中监测研究需要考虑的问题。国家食品药品监督管理局颁布的《药品临床试验管理规范》第49条明确规定:临床研究中的资料需要按规定保存及管理,临床研究者需要保存临床资料至研究终止5年后。申办机构需要保存临床资料至批准上市后5年[13]。该法规虽没有明确要求存档时间,但大规模的集中监测由于地域广、病人多、数据量大等特点,更是要保证海量数据的安全。
数据存档一般分为临床数据存档与临床数据文件存档两种类型。主要包括以下7项内容:①原始文件:纸质临床病例报告(CRF)、电子化临床试验病例报告数据库(eCRF)、实验室数据;②数据元数据:CRF数据变量名编码表、词典编码(Meddra编码和WHO编码表);③实验室参考范围:各个研究中心实验室参考范围表;④程序核查表:编写的数据核查程序内容;⑤数据质疑核查表:在试验过程中发现的数据质疑,及修改反馈清单;⑥数据管理计划:在研究开始前编写的管理计划;⑦数据管理报告:总结集中监测研究过程中数据管理相关内容。

图1 中药安全性医院集中监测研究数据管理关键技术流程图
4 讨论
4.1 缺乏数据管理的标准与规范
临床试验数据是药物临床研究的关键信息[14]。不论新药临床研究还是安全性监测研究,临床试验数据的质量是关系临床研究成败的决定性因素。目前,中药注射剂安全性研究缺乏标准、规范的大样本集中性数据采集、管理与分析的操作方法。现在,大部分项目安全性研究数据管理依然采用的方法有2种:①手工记录、纸质病历数据采集(Paper Data Capture,PDC):研究者与受试者不能及时处理不良事件等数据的采集、核查、反馈等数据管理流程,数据的真实性、安全性、有效性、完整性问题都不能得到有效的保证[15];②传统EDC方法(Electronic Data Capture,EDC)。由于安全性研究具有受试人群多、地域广、参与单位数量大、受试者参与研究的时间密集、数据量庞大等特点,传统新药EDC方法不能满足安全性研究的需求(表1),不适用于目前的药物上市后安全性医院集中监测研究。因此,建立良好的符合临床监测流程和安全性数据标准管理方法,完善的操作规程,是把控中药注射剂安全性研究质量风险的重要环节。
4.2 规范的安全性研究数据管理方法拟解决的问题
随着网络与计算机的普及应用,临床数据管理也正逐步走向数字化、网络化。与新药研究、上市后再评价等数据管理过程类似,中药注射剂安全性医院集中监测数据管理方法与流程现在正处于起步阶段。因此,安全性研究电子数据管理方法(Safety-Electronic Data Capture,S-EDC)可解决以下问题:①解决纸质病例数据采集(PDC,Paper Data Capture)方法中对不良事件等安全数据采集与核查反馈不及时的问题,可及时录入信息,数据质疑可在线提交并可快速反馈结果,数据核查与审查及时,不论任何地点与时间,使数据管理便捷化;②解决传统电子化数据管理方法(EDC)对数据核查和清理耗时,容易遗漏数据点,不良事件(AE)、联合用药数据核查不清、网络并发高易掉线的问题。
综上所述,中药注射剂安全性集中监测数据管理是安全性研究中的一项重要内容,缺乏数据保障的安全性研究将无法解决临床用药高风险的现实问题。2016年7月29日,国家食品药品监督管理总局颁布了《规范药物临床试验数据管理工作的实施方案》、《临床试验数据管理工作指南》、《临床试验的电子数据采集技术指导原则》等多个临床数据管理的技术规范。以上文件的发布,将有效促进中国中药注射剂安全性研究数据管理方法的标准化与规范化。
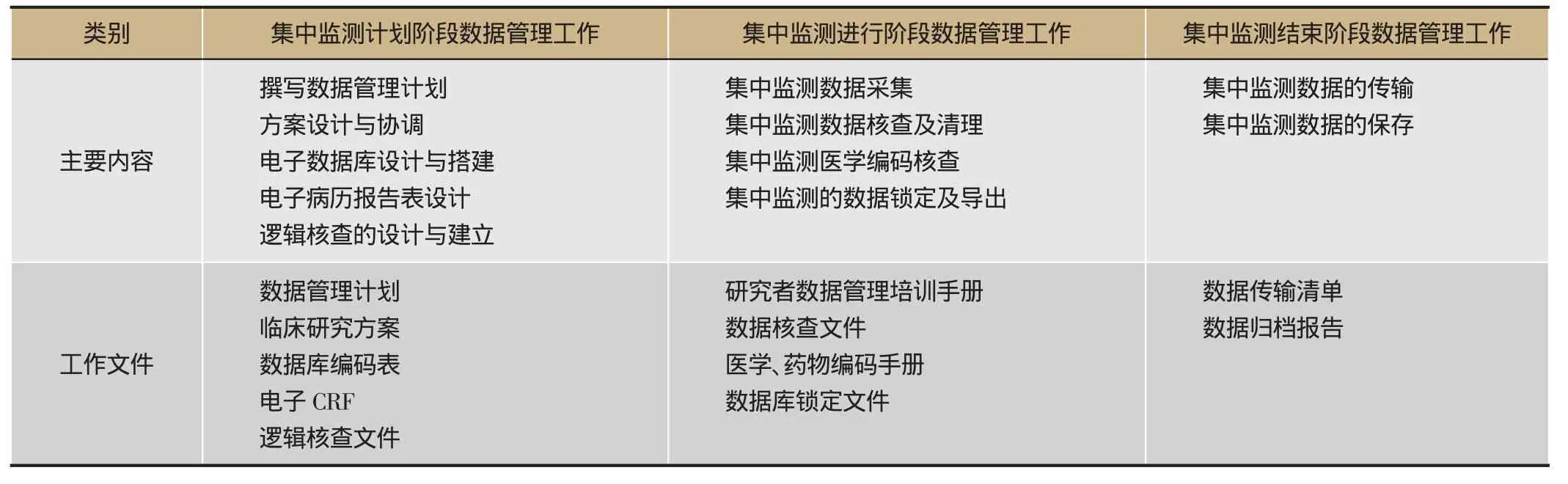
表2 中药注射剂安全性集中监测数据管理内容
1 刘兆平,李忠港,汪怀山,等. 中药注射剂安全性现状与挑战. 临床药物治疗杂志, 2009,7(2):18-22.
2 李金玲,薛强,张聪聪,等. 中药注射剂的现状分析及发展前景.中药与临床, 2012,3(3):60-62.
3 阎博华,彭成,谢雁鸣,等. 中药注射剂临床安全性评价方法比较与分析. 中国中药杂志,2013,38(18):2979-2982.
4 孙塑伦,翁维良,杨龙会. 中医临床研究实施过程质控与管理. 北京:中国中医药出版社, 2010.
5 何丽云,刘保延,梁志伟,等. 临床研究中数据管理及其质量评价.中国新药与临床杂志,2005,24(11):916-919.
6 颜崇超. 医药临床研究中的数据管理. 北京:科学出版社, 2011:165.
7 李庆娜,黄秀玲,高蕊,等. 基于电子数据获取的临床研究数据管理计划的制定及其关键因素探讨. 中西医结合学报,2018,10(8):841-846.
8 卜擎燕,熊宁宁,邹建东,等. 从临床研究数据管理角度设计病例报告表. 中国新药杂志,2007,16(5):339-343.
9 梁伟雄,温泽淮,王奇,等. 中药临床试验数据电子化管理的建设与展望. 中药新药与临床药理,2006,17(3):233-236.
10 刘建平. 临床试验与临床试验中心(CTU). 中国循证医学, 2001,1(4):202-204.
11 谢高强,姚晨. 数据管理在临床研究中的地位和作用. 北京大学学报, 2010, 42(6):641-643.
12 吴美京,吴骋,王睿,等. 临床试验数据管理培训—现状、经验与展望. 西北医学教育,2009,17(5):857-858 .
13 国家药品监督管理总局. 药品临床试验管理规范(GCP). 中国医药导刊, 1999, 1(1):5-9.
14 黄钦,王骏. 加强临床数据管理对药品审评的重要作用. 药学学报,2015,50(11):1408-1409.
15 李伟,熊宁宁,卜擎燕,等. 电子数据获取系统在临床试验质量控制中应用的优势与讨论. 中国新药杂志,2009,18(12):1081-1083,1086.
Contents and Key Points of Data Management During Hospital Centralized Monitoring of the Safety of Traditional Chinese Medical (TCM) Injections
Liu Zhi, Zheng Wenke, Zhang Junhua, Zhai Jingbo, Cao Hongbo, Liu Chunxiang, Wang Hui
(Evidence Based Medicine Center, Tianjin Institute of Clinical Evaluation of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China)
According to the related requirements of safety reevaluation of TCM injections, hospital centralized monitoring of the safety of TCM injection was consecutively pressed ahead. Centralized security monitoring was a large-scale real world research involving numerous data acquisition, transmission, verification and analysis. The quality of data acquisition and data verification directly affected the authenticity and reliability of research data and results. Therefore, data management played a significant role in the safety monitoring of TCM injections. Based on the analysis of previous researches, this paper discussed the implementation content, links and the frequent problems and corresponding solutions of data management during the safety monitoring of TCM injections, combining with the experience in the implementation of projects.
Traditional Chinese medical injection, safety, centralized monitoring, data management
10.11842/wst.2016.12.009
R288
A
(责任编辑:马雅静,责任译审:朱黎婷)
2016-12-19
修回日期:2016-12-20
* 国家自然科学基金委青年项目(81503456):基于移动医疗技术的中医药临床研究者依从性多维度测控与评价方法的建立,负责人:刘智;教育部新世纪优秀人才项目(NCET-13-0936),负责人:张俊华。
** 通讯作者:张俊华,副研究员,博士生导师,主要研究方向:中医药临床循证评价方法学研究。

