高温刺激导致虾夷扇贝死亡因素的探究
刘 超1, 2, 3, 4, 吴富村1, 3, 4, 林思恒1, 2, 3, 4, 阙华勇1, 3, 4, 张国范1, 3, 4
(1. 中国科学院 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266071; 4. 中国科学院 海洋研究所 海洋生态养殖技术国家地方联合工程实验室, 山东 青岛 266071)
高温刺激导致虾夷扇贝死亡因素的探究
刘 超1, 2, 3, 4, 吴富村1, 3, 4, 林思恒1, 2, 3, 4, 阙华勇1, 3, 4, 张国范1, 3, 4
(1. 中国科学院 实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室, 山东 青岛 266071; 4. 中国科学院 海洋研究所 海洋生态养殖技术国家地方联合工程实验室, 山东 青岛 266071)
本文探究了高温刺激导致一龄和二龄虾夷扇贝死亡的原因。在高温刺激以及恢复过程中, 两种贝龄的扇贝存活率存在显著差异(P<0.05), 同时两者的谷丙转氨酶(glutamic-pyruvic transaminase, GPT)活性、p53蛋白含量、总抗氧化能力(total antioxidant capacity, TAOC)以及HSP70 (heat shock protein 70)含量在高温刺激以及恢复过程中的变化均存在显著差异。而且这些酶的活性(TAOC活性除外)以及蛋白质含量(p53以及HSP70)均受到贝龄、处理时间以及两者综合作用的显著影响。经过Cox模型分析可知, 虾夷扇贝受到高温刺激后的存活受到贝龄、GPT活性、TAOC活性、p53含量以及HSP70含量的显著影响。此外, 高温刺激会影响扇贝的心跳频率以及心输出量, 从而影响心脏对机体的供氧供血能力, 影响扇贝对高温的适应能力。
虾夷扇贝(Patinopecten yessoensis); 存活曲线; 谷丙转氨酶; 总抗氧化能力; HSP70; p53; 心率
虾夷扇贝(Patinopecten yessoensis)是一种冷水性双壳贝类。自20世纪80年代引入中国以来, 虾夷扇贝的养殖业取得了迅猛发展。但是随着养殖规模的扩大, 养殖虾夷扇贝的夏季死亡等问题也不断出现[1]。1997~1998年, 虾夷扇贝养殖在山东半岛出现了大面积的死亡情况, 累计经济损失达到30亿元[2]。2009年, 大连市长海县虾夷扇贝在5月份死亡率超过50%, 7月份之后死亡率更是高达80%, 给养殖业带来巨大损失[3]。据相关文献报道, 双壳贝类夏季大规模死亡的原因是多方面的, 是自身生理机能、外界环境以及外界病原综合作用的结果[4]。虽然导致扇贝夏季死亡的具体原因尚无定论, 但是温度变化是一个重要因素[5-6]。
温度是影响海洋生物分布、生理状态、形态以及行为的重要环境因子[7]。温度变化会影响海洋生物的生长发育、能量代谢以及免疫能力[8-9]。较低的升温对许多海洋无脊椎动物是有益的, 可能会导致生长加快[10-12], 而过高的升温幅度一般会引起生物的应激反应, 进而会对生物产生广泛的危害[12-13]。对于贝类而言, 过高的温度变化导致的应激反应主要包括作为分子伴侣的热激蛋白(heat shock protein, HSP)家族的大量产生以及起防卫功能的细胞黏附蛋白的增加。伴随高温往往出现低氧, 低氧会引起抗氧化蛋白、Reactive Oxygen Species(ROS)解毒相关蛋白例如超氧化物歧化酶(superoxide dismutase, SOD)等的产生以及DNA损伤等现象的出现。高温和低氧伴随出现导致扇贝对温度耐受过程中的应激反应往往是两方面综合作用的结果[14-16]。
虾夷扇贝在夏季出现大规模死亡现象报道较多,但是关于温度刺激如何影响其生理活性并导致其死亡, 以及为何一龄贝比二龄贝更能耐受夏季高温的原因等方面的报道较少。本研究检测了虾夷扇贝在高温刺激以及恢复过程中虾夷扇贝部分免疫、代谢相关指标并测定了其存活率。利用Cox模型分析扇贝存活率同这些生理因素之间的关系。同时利用扇贝在高温条件下心率的变化进行扇贝能量代谢方面的预测。
1 材料和方法
1.1 实验用扇贝
实验用虾夷扇贝取自獐子岛集团海洋生物技术研发部培育的家系。将800枚二龄贝(体质量78.14 g± 15.54 g, 壳长79.79 mm±5.28 mm)和1000枚一龄贝(体质量8.37 g±1.77 g, 壳长40.22 mm±5.28 mm)暂养于16℃曝气海水中, 每天10: 00全部换水, 11: 00和23: 00投喂螺旋藻粉(2 g/m3)。待个体状态稳定后进行以下实验。
1.2 高温刺激
取一龄贝和二龄贝各300枚均平均分为3组由16℃直接放入28℃海水中, 统计虾夷扇贝在28℃刺激1 h和2 h后的存活数目。刺激2 h后, 将存活的一龄贝和二龄贝转移进入16℃海水中, 统计3、24、30、48、72 h时虾夷扇贝的存活数目。实验期间不投饵, 只进行曝气与换水, 并用YSI型多参数水质检测仪精确监控水温变化。
1.3 扇贝生理指标测定
另取一龄和二龄虾夷扇贝各300枚也均平均分为3组, 进行如1.2所述的高温刺激过程。同时分别在未刺激、刺激1 h, 刺激2 h(结束刺激), 以及转入16℃海水后的3、24、30和48 h, 每组取5只扇贝剪取鳃组织, 液氮冷冻后存于-80, ℃用于以下指标的测定。
将同一时间点取样的5只同龄扇贝鳃组织等量混合后加入10倍体积的0.9%生理盐水, 在冰上匀浆, 4℃下, 2000 r/min离心10 min, 取上清液用于总抗氧化能力(TAOC)、谷丙转氨酶(GPT)、热激蛋白(HSP70)与p53蛋白等生理指标的测定。其中TAOC、GPT使用南京建成科技有限公司的试剂盒测定, HSP70以及p53蛋白含量使用相应的酶联免疫反应试剂盒进行测定。
1.4 心率测定
利用powerlab信号放大器结合Labchart软件采集虾夷扇贝的心率数据。将5只一龄或者二龄虾夷扇贝放入16℃海水中, 用蓝丁胶将信号探头黏附于扇贝心脏上方的贝壳之上, 待扇贝的心跳曲线稳定后保存扇贝的心跳频率(beats per minutes, BPM)数据, 数据采集时间为1分钟。保存完毕后, 继续以0.5/min℃速度升温至18, ℃待扇贝心跳稳定后保存心跳频率数据, 同样的操作依次测定20、22、24、26、28℃以及30℃条件下虾夷扇贝的心跳频率数据。每次选取5只同龄扇贝作为1个平行组, 将其在不同温度条件下的心跳频率(BPM)数据进行混合, 并依据阿伦尼乌斯定律作出1000/K-ln BPM散点图, 求出扇贝的阿伦尼乌斯点(Arrhenius break temperature, ABT)[17]。一龄贝和二龄贝均设置3组平行, 分别计算得到一龄贝和二龄贝的ABT均值。
1.5 数据分析
利用SPSS 19.0 软件进行扇贝的生存分析。利用单因素方差分析比较同龄扇贝的各项生理指标在不同温度刺激处理时间点的差异。利用独立样本T检验比较不同贝龄扇贝在同一处理时间处差异是否显著, 若P<0.05, 则认为差异显著。用多因素方差分析比较贝龄、处理时间以及两者交互作用对扇贝各项生理指标的影响的差异。并利用Cox模型分析存活率与生理指标之间的关系。
2 实验结果
2.1 存活分析
将刺激开始时间作为生存曲线的计时起点。高温刺激2 h之后进入16℃海水中进行恢复, 观察恢复72 h之内虾夷扇贝的存活状况。得到一龄贝和二龄贝的生存曲线如图1所示。经过28℃高温刺激2 h以及后续的恢复过程中, 一龄贝和二龄贝的存活率差异显著(P =0.034 < 0.05)。
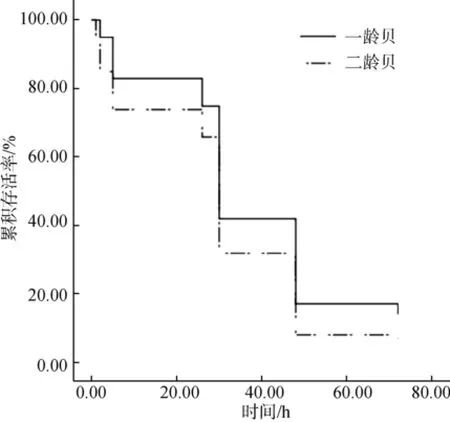
图1 一龄贝和二龄贝生存曲线Fig. 1 Survival curve of one- and two-year old yesso scallops
2.2 代谢及免疫指标活性变化
由图2可知, 两贝龄扇贝的GPT活性随着处理时间的变化规律并不相同。一龄贝的GPT活性在高温处理2 h与恢复后3 h时达到最高, 显著高于其他时间点(P<0.05); 二龄贝的GPT活性在高温处理2 h以及恢复后3 h最低, 要显著低于其它时间点。此外,在同一时间点, 二龄贝的GPT活性显著高于一龄贝(P<0.05)。
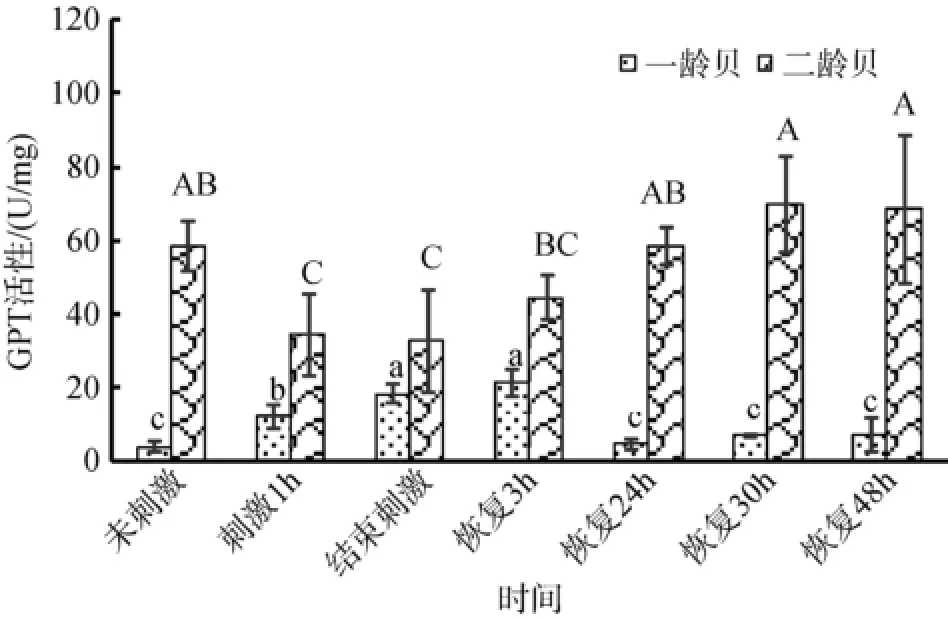
图2 一龄贝和二龄贝中谷丙转氨酶(GPT)活性Fig. 2 GPT activity in one- and two-year old yesso scallops
p53含量在两贝龄贝体内随处理时间的变化均表现出先升高后降低的变化规律, p53含量最高值均出现在恢复3 h (图3)。从结束刺激到恢复48 h时间内,一龄贝体内的p53质量比显著高于二龄贝(P<0.05)。
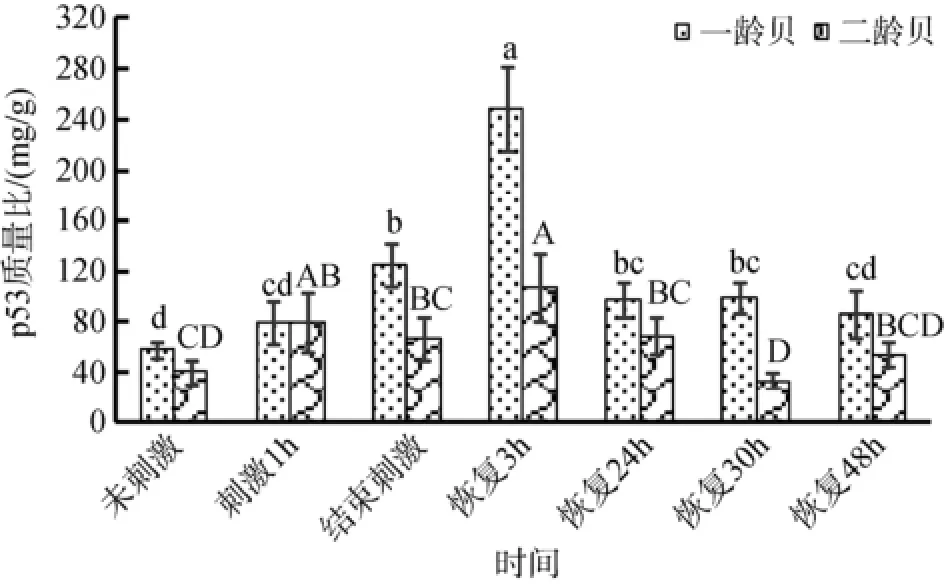
图3 一龄贝和二龄贝中p53蛋白含量变化Fig. 3 Concentration of p53 in one- and two-year old yesso scallops
两贝龄扇贝的TAOC活性随着处理时间的变化不明显, 并且在一龄贝与二龄贝之间差异不显著(图4)。高温刺激后, 一龄贝的TAOC活性相对于未刺激阶段没有显著变化, 但是在恢复至30 h和48 h时, TAOC活性较刺激结束时显著降低。二龄贝的TAOC活性则在恢复至24 h以及48 h时显著降低。
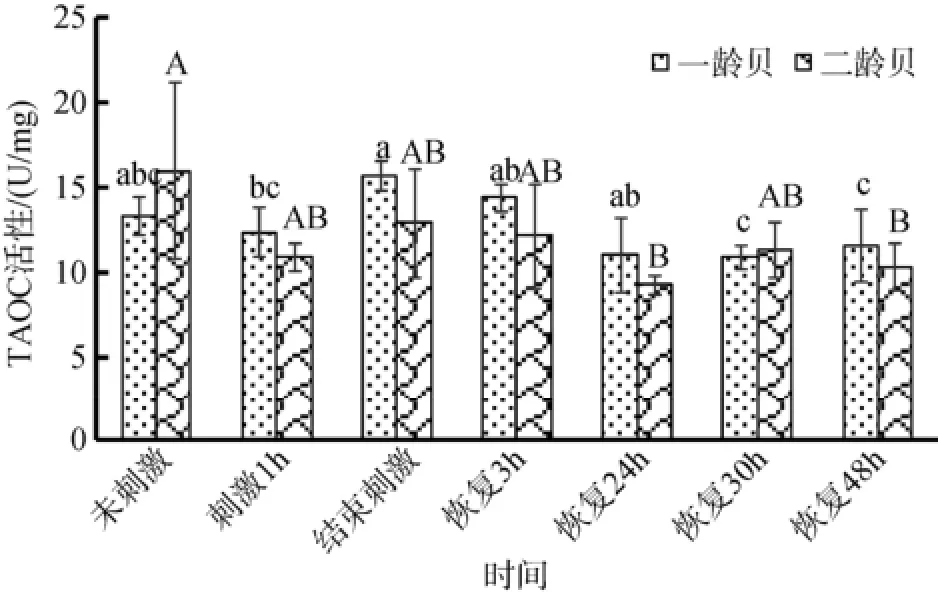
图4 一龄贝和二龄贝中TAOC活性变化Fig. 4 TAOC activity in one- and two-year old yesso scallops
由图5可知, 一龄贝的HSP70含量受到高温刺激后迅速升高, 在刺激2 h后达到最高值, 一直维持到恢复24 h, 并且在恢复48 h后仍显著高于未受刺激时的HSP70含量。高温刺激并未导致二龄贝的HSP70含量显著升高, 只是在恢复30 h后显著高于其他时间点(P<0.05)。高温刺激后, 一龄贝体内HSP70含量显著高于二龄贝, 但是未受高温刺激以及恢复30 h时,二龄贝体内HSP70含量显著高于一龄贝。
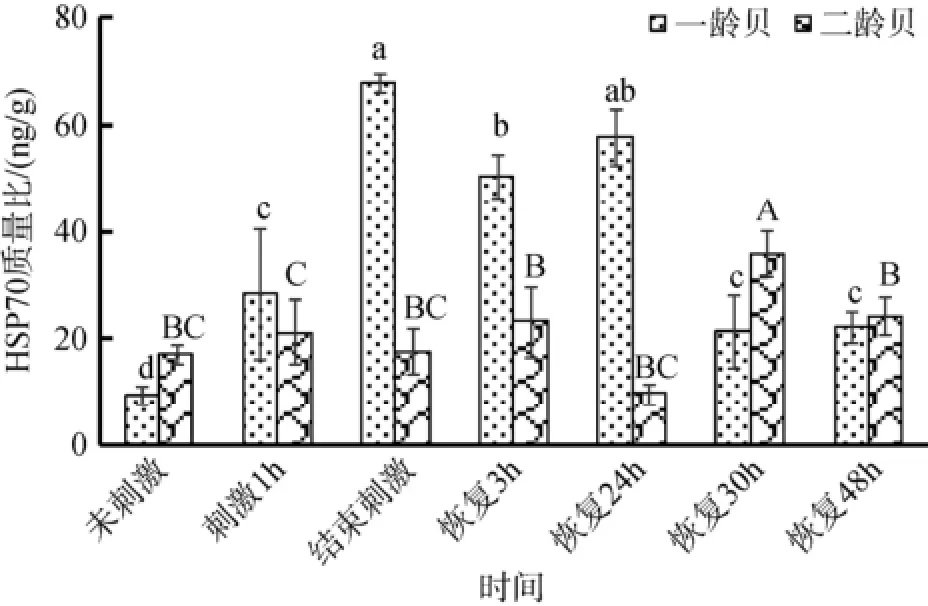
图5 一龄贝和二龄贝HSP70蛋白含量Fig. 5 Concentration of HSP70 in one- and two-year old yesso scallops
多因素方差分析结果显示, 贝龄、处理时间以及两者的交互作用对GPT活性、p53含量以及HSP70含量变化的有显著影响(P<0.05), 而TAOC活性只受到处理时间的显著影响(表 1)。
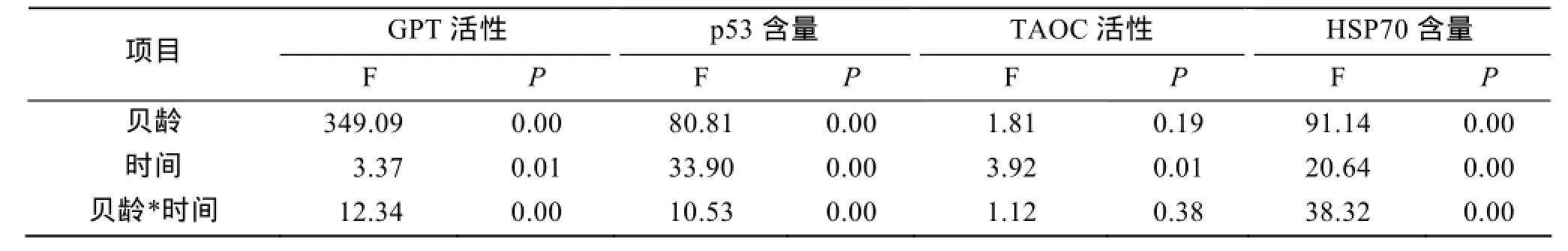
表1 各项生理指标同贝龄、处理时间的相关性Tab. 1 Relationship between physiology index, age, and challenge time
2.3 扇贝生存同各项生理指标的Cox模型分析
Cox模型分析结果显示, 高温处理后虾夷扇贝的存活率同贝龄、GPT活性、p53含量、TAOC活性以及HSP70含量变化均显著相关(P<0.05), 其中GPT活性同扇贝的存活负相关(B<0), 其余因素同扇贝存活呈显著正相关(B>0, 表2)。
2.4 心率变化
由图6可知, 一龄和二龄虾夷扇贝在20℃条件下均具有明显的心跳节律, 随着温度升高, 至30℃时, 扇贝的心跳已经没有规律, 心脏基本停止跳动。
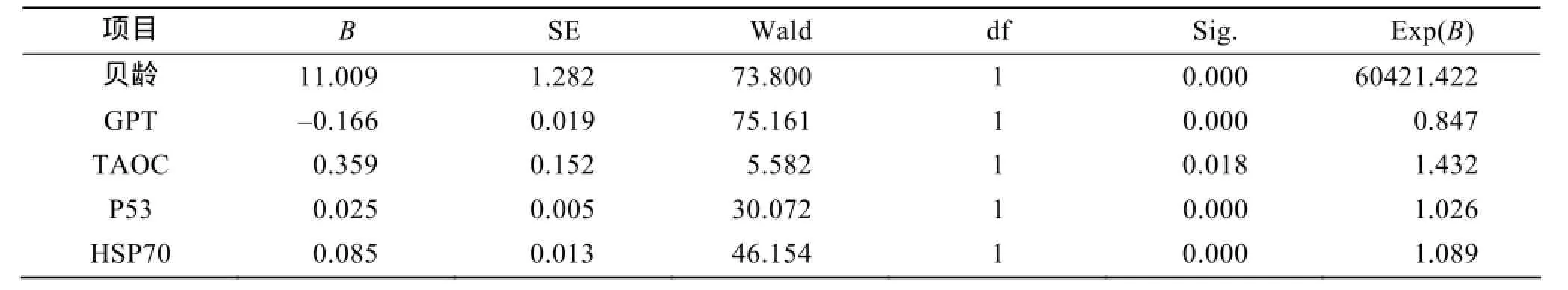
表2 Cox模型分析中各项系数以及显著性Tab. 2 Coefficients and significant factors in the Cox model
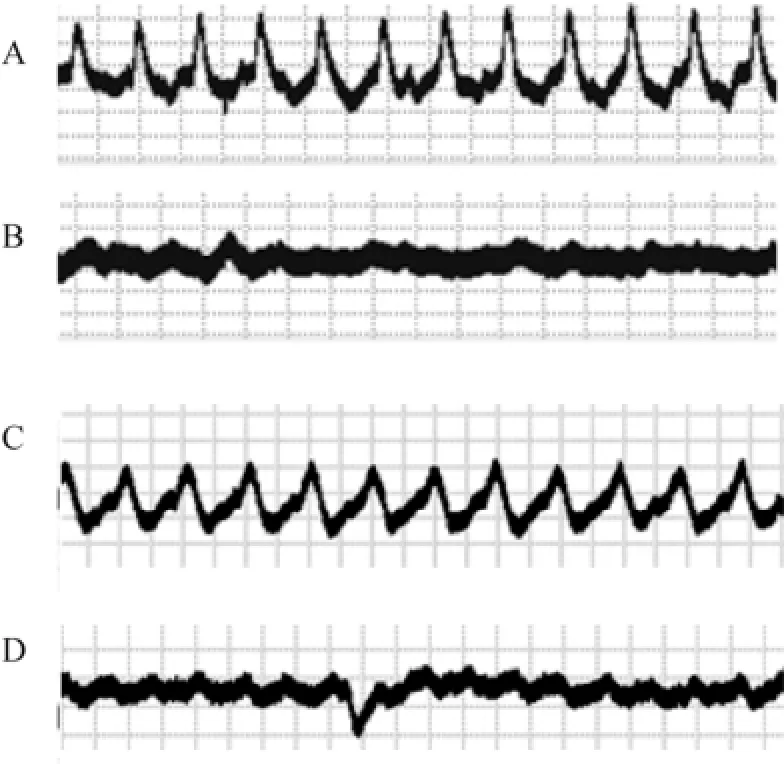
图6 扇贝心跳曲线的变化Fig. 6 Yesso scallop’s electrocardiogram
由图7可知道, 在一定温度范围内, 扇贝的心率随着温度的升高而升高。待达到一定温度(阿伦尼乌斯点, ABT)后, 心率开始逐渐降低, 最后心脏失去节律性, 停止跳动。经计算, 图7中一龄和二龄贝的阿伦尼乌斯点分别为25.49℃和26.55℃。经过3个平行组计算得到一龄虾夷扇贝的阿伦尼乌斯点为25.37℃± 0.08℃, 二龄贝的阿伦尼乌斯点为26.47℃±0.07℃,两者差异显著(P<0.05)。
3 讨论
高温刺激会影响虾夷扇贝的生理、生长、存活等[18]方面。从图1可以看出, 高温刺激之后, 扇贝在恢复过程中仍然存在死亡情况。所以, 高温对扇贝存活的影响有滞后效应。而且扇贝的贝龄严重影响扇贝对高温的适应能力: 二龄贝对高温的适应能力不如一龄贝, 两者的累计存活率存在显著差异(P<0.05)。这表明在同样的温度刺激条件下, 一龄贝在恢复过程中存活率更高, 其对高温的耐受能力更强。高温对生物存活的影响主要通过对其生理、生化因素的影响进而影响其存活[19]。
GPT是一种与氨基酸代谢相关的转氨酶, 主要分布于细胞线粒体中, 其活性越高蛋白质的氧化分解作用越迅速, 其代谢能力越强[20]。此外血淋巴中GPT活性较低, 当血淋巴中GPT活性上升往往是由于细胞完整性受到破坏而释放导致的[21], 因此GPT活性的增强通常用来作为指示细胞代谢活性以及组织损伤的诊断指标[22-23]。本研究测定的是鳃组织中的GPT活性变化, 故GPT活性代表的是虾夷扇贝对蛋白质的氧化分解能力。由图2可知一龄贝和二龄贝体内GPT活性随着处理时间的变化呈现完全相反的变化过程。这一相反过程说明, 一龄贝在受到高温刺激的时候能够通过提高GPT的活性加速新陈代谢能力来提高对高温的适应能力, 而二龄贝受到高温刺激后, GPT活性会受到损害, 导致扇贝对高温的适应能力降低, 导致其死亡率偏高。对于GPT活性在恢复处理中的活性恢复速度而言, 一龄贝的GPT活性在恢复3~24 h时迅速恢复到未刺激之时的水平,而二龄贝的GPT活性则需要在刺激结束到恢复30 h之间缓慢恢复到未刺激之时的水平。从而也说明一龄贝GPT活性变化更迅速, 有更强的对逆境的适应能力和自我修复能力。连珊珊研究证实, 二龄栉孔扇贝(Chlamys farreri)外套膜、性腺、闭壳肌以及鳃中GPT活性显著高于一龄贝[20], 这与本文章的结论相吻合, 据此可以推断正常状态下(未刺激)二龄虾夷扇贝具有更强的蛋白质代谢活性, 处于快速生长阶段。
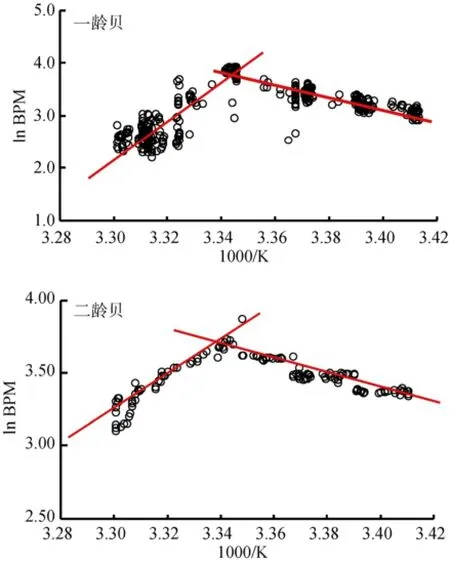
图7 一龄贝与二龄贝的1000/K-lnBPM 图Fig. 7 One- and two-year old yesso scallop heart rates in 1000/K-lnBPM
p53又被称作肿瘤抑制因子, 它在细胞凋亡中起着重要作用。DNA损伤以及不正常的细胞增殖信号都会引起p53蛋白的激活, 若DNA损伤程度达到一定阈值, p53蛋白会激活caspase蛋白, 促使细胞凋亡[24-25]。如果DNA损伤在阈值之内, 那么p53会激活p21等蛋白, 使细胞周期停滞进而对损伤的DNA进行修复[26]。如图3所示, 一龄贝和二龄贝体内, p53蛋白含量均在恢复3h时达到最高。这说明高温刺激后3 h是扇贝进行自我修复或者凋亡的高峰期。此外, 一龄贝体内p53含量显著高于或者等于二龄贝, 说明一龄贝对高温刺激的适应能力更强, 这也为一龄贝的存活率高于二龄贝提供了证据。在两种贻贝(Mytilus californianus和M. galloprovincialis)的高温应激实验中, 其p53含量均在受到28℃刺激8h后达到最高, 分别为对照组的1.6倍和2.1倍[27]。本研究中一龄贝含量最高时的p53含量是未刺激之时的4.3倍, 二龄贝则为2.7倍,这在一定程度上说明虾夷扇贝比贻贝具有更强通过控制p53含量来适应高温刺激的能力, 也更进一步说明了一龄贝具有比二龄贝更强的自我修复能力。
生物体内的氧化防御系统分为酶类和非酶类两种。前者包括过氧化氢酶(Catalase, CAT)、超氧化物歧化酶(SOD)等, 非酶类包括维生素E、半胱氨酸等。他们在消除生物体内活性氧(ROS)的过程中起着重要作用。TAOC是反映生物体内抗氧化能力的总体指标, 是酶类和非酶类抗氧化物的总体水平[28]。对于一龄贝, 在高温刺激以及恢复过程中的TAOC活性同未刺激之时活性相比均没有显著变化。在二龄贝体内, 其TAOC活性并没有随着处理时间而出现明显变化, 但是恢复至24 h以及48 h时的TAOC活性明显低于未刺激之时的TAOC活性, 这说明一龄贝中TAOC活性对高温刺激的能力更强。据报道, 两种规格的虾夷扇贝(P. yessoensis)体腔液中TAOC活性在24℃升至30℃的变化过程中均显著降低[29], 由此推断虾夷扇贝体腔液中TAOC较鳃中TAOC更容易受到高温刺激的影响而较低活性。这也为底播扇贝在8月份(高温)TAOC活性低而12月(低温)TAOC活性高(本实验室未发表的实验数据)提供了解释。原因可能是持续的高温会使生物体内酶类和非酶类的氧化防御物质失活, 从而导致TAOC活性降低[30]。
热激蛋白家族(HSPs)是变温动物抵御高温危害的一种重要的蛋白质家族。这一家族的蛋白在维持蛋白质的稳态以及防止高温引起的蛋白质的聚集和降解方面起着关键作用, 从而提高生物体对高温的耐受能力[31-32]。此外, HSP家族蛋白还可以维持溶酶体的稳定性, 防止细胞死亡[33]。如图5所示, 一龄虾夷扇贝的HSP70含量在受到高温刺激后迅速升高,在刺激结束时达到最高值。而对于二龄贝, HSP70含量没有显著变化, 直到恢复30 h时含量较其他时期显著提高。所以, 二龄贝通过调节HSP70含量来适应高温刺激的能力不如一龄贝。据曲凌云报道[34], 受到高温刺激后栉孔扇贝鳃组织中HSP70的表达明显升高, 这与本研究的结果相同。此外长牡蛎(Crassostrea gigas)在受到27℃高温刺激1 h之后的2~14 d内, 鳃中HSP70含量呈现先上升后下降趋势[35], 这与本研究中虾夷扇贝鳃中HSP70含量变化趋势相一致但是虾夷扇贝HSP70含量变化受到高温刺激之后的变化更迅速。
为了分析GPT活性、p53含量、TAOC活性以及HSP70含量变化是否受到贝龄、处理时间以及两者交互作用的显著影响, 进行多因素方差分析检验。如表1所示分析结果可知, GPT活性、p53蛋白含量以及HSP70含量均受到贝龄、处理时间以及两者综合作用的显著影响(P<0.05), 而TAOC活性仅仅受到处理时间的显著影响。这与作者上面的分析相一致。Cox模型又称Cox比例风险回归模型, 是一种能够定量筛选和综合分析各种因素的多因素分析方法, 从而克服混杂因素的干扰[36]。本研究利用Cox模型分析了影响虾夷扇贝存活的因素, 由表2可知, 影响虾夷扇贝存活的因素中, 贝龄、TAOC活性、GPT活性、HSP70含量以及p53含量均会显著影响虾夷扇贝的存活。
心跳曲线体现的是扇贝心脏的收缩和舒张的频率变化, 进而体现心脏对生物体各组织器官的供血供氧能力。据Ritto等[37]报道, 美洲牡蛎(Crassostrea virginica)的心跳曲线有三个特征: (1)高度的不稳定性; (2)无周期性; (3)心跳曲线不规则。而在本研究中,虾夷扇贝的心跳曲线的特点是: (1)同一个体心跳曲线具有周期性、规律性; (2)不同个体的心跳曲线往往具有不同的波形, 如图6中A、C的差异。当温度升高到一定数值时, 扇贝的心跳逐渐失去节律性, 心跳出现紊乱直至停止跳动, 如图6中B、D所示。依据Giomi的stroke volume proxy(SVP)理论[16], 将心跳曲线同横轴围成的面积当做心输出量进行讨论,并结合图6可知, 当温度升高到一定程度时, 扇贝的心输出量在减少直至为0。从而严重影响扇贝心脏的供氧供血能力, 导致扇贝机体的死亡。经过计算可知,一龄扇贝的阿伦尼乌斯点显著低于二龄扇贝的阿伦尼乌斯点。扇贝等软体动物的无氧呼吸温度往往出现在阿伦尼乌斯点之后[38], 由此推断, 一龄扇贝出现无氧呼吸的温度或许会低于二龄扇贝, 这一观点还有待于进一步的实验研究。
总之, 虾夷扇贝受到高温刺激后的存活受到贝龄、GPT活性、TAOC活性、p53含量以及HSP70含量的显著影响。这些酶活性(TAOC活性除外)以及蛋白质含量均受到贝龄、处理时间以及两者综合作用的显著影响。这些酶的活性以及蛋白质含量在不同贝龄扇贝体内的差异, 导致了不同贝龄扇贝对高温刺激的耐受能力的差异, 进而导致了存活率的差异。此外, 温度会影响扇贝的心率以及心输出量, 从而影响心脏对机体的供氧供血能力, 影响扇贝对高温的适应能力。
[1] 常亚青, 陈晓霞, 丁君, 等. 虾夷扇贝(Patinopecten yessoensis)5个群体的遗传多样性[J]. 生态学报, 2007, 27(3): 1145-1152. Chang Yaqing , Chen Xiaoxia, Ding Jun, et al. Genetic diversity in five scallop populations of the Japanese scallop (Patinopecten yessoensis)[J]. Acta Ecologica Sinica, 2007, 27(3): 1145-1152.
[2] 王远隆, 李美真, 邱兆星, 等. 养殖扇贝大面积死亡的原因及对策[C]//第二届全国海珍品养殖研讨会论文集. 北京: 海洋出版社, 2000: 63-69. Wang Longyuan, Li Meizhen, Qiu Zhaoxing, et al. The reasons and tragedy for the mass mortality of cultured scallops[C]//The 2nd Rare Marine Animals Aquaculture Conference Proceedings.Beijing: Ocean Press, China, 2000: 63-69.
[3] 徐东, 张继红, 王文琪, 等. 温度变化对虾夷扇贝耗氧率和排氨率的影响[J]. 中国水产科学, 2010, 17(5): 1101-1106. Xu Dong, Zhang Jihong, Wang Wenqi, et al. Effects of temperature elevation on oxygen consumption rate and ammonia excretion rate of Patinopecten yessoensis[J]. Journal of Fishery Sciences of China, 2010, 17(5): 84-93.
[4] Li Q, X Zhao, L Kong, et al. Transcriptomic response to stress in marine bivalves[J]. Isj Invertebrate Survival Journal, 2013, 10(1): 84-93.
[5] 张明明, 赵文. 我国虾夷扇贝死亡原因的探讨及控制对策[J]. 中国水产, 2008, 2: 65-66, 74. Zhang Mingming, Zhao Wen. The discussion on yesso scallops’ mortality and the corresponding control strategy[J]. China Fisheries, 2008(02): 65-66, 74.
[6] 蓝淑芳. 长山岛海区夏季扇贝大批死亡的水文原因分析[J]. 海洋科学, 1990, 2: 60-61. Lan Shufang. Hydrologic analysis of the death of scallops in sea area of Changshan island in summer[J]. Marine Sciences, 1990, 2: 60-61.
[7] Pörtner, H. Ecosystem effects of ocean acidification in times of ocean warming: a physiologist’s view[J]. Marine Ecology Progress Series, 2008, 373: 203-217.
[8] Matozzo V A, Chinellato M M. First Evidence of Immunomodulation in bivalves under seawater acidification and increased temperature[J]. Plos One, 2012, 7(3): e33820.
[9] Matoo O B, Ivanina A V, Ullstad C, et al. Interactive effects of elevated temperature and CO2levels on metabolism and oxidative stress in two common marine bivalves (Crassostrea virginica and Mercenaria mercenaria)[J]. Comparative Biochemistry and Physiology A: Molecular & Integrative Physiology, 2013, 164(4): 545-553.
[10] Putnam H M, Edmunds P J, Fan T Y. Effect of Temperature on the Settlement Choice and Photophysiology of Larvae From the Reef Coral Stylophora pistillata[J]. Biological Bulletin, 2008, 215(2): 135-142.
[11] Whalan S, Ettinger-Epstein P, Renm de N. The effect of temperature on larval pre-settlement duration and metamorphosis for the sponge, Rhopaloeides odorabile[J]. Coral Reefs, 2008, 27(4): 783-786.
[12] Byrne M, Selvakumaraswamy P, Ho M A, et al. Sea urchin development in a global change hotspot, potential for southerly migration of thermotolerant propagules[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2011, 58(5): 712-719.
[13] Parker L M, Ross P M, O’Connor W A. Comparing the effect of elevated pCO2and temperature on the fertilization and early development of two species of oysters[J]. Marine Biology, 2010, 157(11): 2435-2452.
[14] Yun-Wei D, Shan-Shan Y, Qing-Lin W., et al. Physiological Responses in a Variable Environment: Relationships between Metabolism, Hsp and Thermotolerance in an Intertidal-Subtidal Species[J]. Plos One, 2011, 6(10): e26446-e26446.
[15] Sokolova I M, Frederich M, Bagwe R, et al. Energy homeostasis as an integrative tool for assessing limits of environmental stress tolerance in aquatic invertebrates[J]. Marine Environmental Research, 2012, 79: 1-15.
[16] Giomi F, Portner H O. A role for haemolymph oxygen capacity in heat tolerance of eurythermal crabs[J]. Frontiers in Physiology, 2013, 4: 110.
[17] Han G D, Zhang D S, Marshall J, et al. Metabolic energy sensors (AMPK and SIRT1), protein carbonylation and cardiac failure as biomarkers of thermal stress in an intertidal limpet: linking energetic allocation with environmental temperature during aerial emersion[J]. Journal of Experimental Biology, 2013, 216(Pt 17): 3273-3282.
[18] Bozinovic F, Calosi P, Spicer J I. Physiological Correlates of Geographic Range in Animals[J]. Annual Review of Ecology, Evolution, and Systematics. 2011, 42(1): 155-179.
[19] Stillman J H, Somero G N. Adaptation to temperature stress and aerial exposure in congeneric species of intertidal porcelain crabs (Genus Petrolisthes): Correlation of physiology, biochemistry and morphology with vertical distribution[J]. Journal of Experimental Biology, 1996, 199(8): 1845-1855.
[20] 连姗姗. 栉孔扇贝(Chlamys farreri)能量代谢与抗氧化胁迫能力评价指标体系的构建[D]. 青岛: 中国海洋大学, 2013. Lian Shanshan. Construction of assessment indexes for energy metabolism and antioxidant-stress ability of Zhikong scallop (Chlamys farreri)[D]. qingdao: Ocean university of China, 2013.
[21] Sultana M S, Koshio S, Ishikawa M, et al. Effects on Dietary Supplement of Shochu Distillery By-Product (SDBP) on the Growth of Red Sea Bream[J]. Aquaculture Science, 2013, 61.
[22] Sakamoto S, Yone Y. Effect of Starvation on Hematological Characteristics, and the Contents of Chemical Components and Activities of Enzymes in Blood Serum of Red Sea Bream[J]. Journal of the Faculty of Agriculture Kyushu University, 1978, 23: 63-69.
[23] Casillas E, Sundquist J, Ames W E. Optimization of assay conditions for, and the selected tissue distribution of, alanine aminotransferase and aspartate aminotransferase of English sole, Parophrys vetulus Girard[J]. Journal of Fish Biology, 2006, 21(2): 197-204.
[24] Polyak K, Xia Y, Zweier J L, et al. A model for p53-induced apoptosis[J]. Nature, 1997, 389(6648): 300-305.
[25] Benchimol, S. p53-dependent pathways of apoptosis[J]. Cell Death and Differentiation, 2001, 8(11): 1049-1051.
[26] Jiang L, Sheikh M S, Huang Y. Decision Making by p53: Life versus Death[J]. Molecular and Cellular Pharmacology, 2010, 2(2): 69-77.
[27] Yao C L, Somero G N. Thermal stress and cellular signaling processes in hemocytes of native (Mytilus californianus) and invasive (M. galloprovincialis) mussels: cell cycle regulation and DNA repair[J]. Comparative Biochemistry and Physiology. Part A: Molecular and Integrative Physiology, 2013, 165(2): 159-168.
[28] Daniel J W. Metabolic aspects of antioxidants and preservatives[J]. Xenobiotica, 1986, 16: 1073-1078.
[29] 贲月. 虾夷扇贝应答高温变化的相关生理生态学研究[D]. 大连: 大连海洋大学, 2013. Ben Yue. Study on the physiological ecology of the Mizuhopecten yessoensis response to high temperature change[D]. Dalian: Ocean university of Dalian, 2013.
[30] 郝振林, 刘京哲, 唐雪娇, 等. 高温下3种壳色虾夷扇贝存活率、代谢率、免疫酶活力及HSP70表达的比较研究[J]. 海洋科学, 2015, 39(11): 108-115. Hao Zhenlin, Liu Jingzhe, Tang Xuejiao, et al. A comparative study of survival, metabolism, immune indi-cators and HSP70 expression in three kinds of shell colors Japanese scallop Mizuhopecten yessoensis under high temperature stress[J]. Marine Sciences, 2015, 39(11): 108-115.
[31] Gonzalez M. Effect of thermal stress on protein expression in the mussel Mytilus galloprovincialis Lmk[J]. Comparative Biochemistry and Physiology. Part B: Biochemistry and Molecular Biology, 2007, 147(3): 531-540.
[32] Ivanina A V, Taylor C, Sokolova I M. Effects of elevated temperature and cadmium exposure on stress protein response in eastern oysters Crassostrea virginica (Gmelin)[J]. Aquatic Toxicology, 2009, 91(3): 245-254.
[33] Thomas K, Roth A G, Petersen N H T, et al. Hsp70 stabilizes lysosomes and reverts Niemann-Pick disease-associated lysosomal pathology[J]. Nature, 2010, 463(7280): 549-53.
[34] 曲凌云, 相建海, 孙修勤, 等. 温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究[J]. 高技术通讯, 2005, 15(5): 96-100. Qu Lingyun, Xiang Jianhai, Sun Xiuqin, et al. Expression analysis of HSP70 in various tissues of Chlamys farreri under thermal stress[J]. Chinese High Technology Letters, 2015, 15(5): 96-100.
[35] Uhlinger K R, Jackson S A, Cherr G N. Induced thermotolerance and the heat shock protein-70 family in the Pacific oyster Crassostrea gigas[J]. Molecular Marine Biology and Biotechnology, 1998, 7(1): 21-30.
[36] 李有元, 胡志全, 叶章群. 肾细胞癌数据库三年临床资料Cox模型分析[J]. 现代泌尿外科杂志, 2008, 13(4): 294-296. Li Youquan, Hu Zhiquan, Ye Zhangqun. Analysis of 3 years’ clinical data of the renal cell carcinoma database by Cox model[J]. Journal of Modern Urology, 2008, 13(4): 294-296.
[37] Ritto P A, Alvarado-Gil J J, Contreras J G. Scaling and wavelet-based analyses of the long-term heart rate variability of the Eastern Oyster[J]. Physica A Statistical Mechanics & Its Applications, 2004, 349(1): 291-301.
[38] Green J A. The heart rate method for estimating metabolic rate: review and recommendations[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 2011, 158(3): 287-304.
Received: Oct. 8, 2015
Pilot study on reasons for yesso scallop’s (Patinopecten yessoensis) survival after heat shock
LIU Chao1,2,3,4, WU Fu-cun1,3,4, LIN Si-heng1,2,3,4, QUE Hua-yong1,3,4, ZHANG Guo-fan1,3,4
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China; 4. National & Local Joint Engineering Laboratory of Ecological Mariculture, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China)
Yesso scallop (Patinopecten yessoensis); Survival curve; GPT; TAOC; HSP70; p53; Heart beat rate
In this study, one- and two-year old yesso scallops were used to explore the influence of heat shock on scallop survival, physiological activity involved in immunity and metabolism, and heart rate. The differences in the above factors between the two types of scallop were also determined. During heat shock and recovery, the one-year old scallops’ survival rate was significantly higher than that of the two-year scallops. In addition, the GPT activity, p53, and HSP70 were significantly different between the two types of scallops. The multiple factor variance analysis demonstrated that the enzyme activity (TAOC) and protein concentration (p53 and HSP70) were influenced by age, processing time, and the interaction between them significantly. The Cox model showed the significant contribution of age, GPT, TAOC, p53, and HSP70 to scallops’ survival. In addition, heat shock can affect heart rate.
S917.4
A
1000-3096(2016)11-0091-08
10.11759/hykx20151008001
(本文编辑: 梁德海)
2015-10-08;
2016-06-17
现代农业产业技术体系建设专项 (CARS-48); 山东省泰山学者攀登计划项目; 中国科学院科技服务网络计划项目(KFJ-EWSTS-060)
[Foundation: the Earmarked Fund for Modern Agro-industry Technology Research System, No.CARS-48; Taishan Scholars Climbing Program of Shandong; Science and Technology Service Network Initiative of the Chinese Academy of Sciences, No.KFJ-EW-STS-060]
刘超(1984-), 男, 山东潍坊人, 博士研究生, 主要从事海水养殖方面的研究, 电话: 0532-82898726, E-mail: liuchaofighting@ 163.com; 张国范, 通讯作者, 研究员, 电话: 0532-82898701, E-mail: gfzhang@qdio.ac.cn

