热稳定κ-卡拉胶酶产生菌Bacillus sp.Car19的发酵条件优化
谢买胜, 李 江, 林学政, 何培青
(国家海洋局 第一海洋研究所, 山东 青岛 266061)
热稳定κ-卡拉胶酶产生菌Bacillus sp.Car19的发酵条件优化
谢买胜, 李 江, 林学政, 何培青
(国家海洋局 第一海洋研究所, 山东 青岛 266061)
对一株分泌热稳定κ-卡拉胶酶印尼热泉菌进行了种属鉴定, 并采用响应面法对该菌发酵产酶条件进行了优化。鉴定结果表明, 该菌株属于芽孢杆菌属(Bacillus), 命名为Bacillus sp.Car19(GeneBank: KT865196)。发酵条件优化结果显示, 9个环境因子影响Bacillus sp.Car19产酶量。其中影响Bacillus sp.Car19产酶量的三个主要因素分别为培养温度、培养基中Cu2+浓度和培养基中NaCl浓度。综合次要因素对Bacillus sp.Car19产酶影响, Bacillus sp.Car19最佳产酶发酵条件为: 培养温度52.31℃、Cu2+浓度6.93 mmol/L、NaCl浓度37.03 g/L, 培养基pH为6, 接种量1%, 培养时间36 h, 半乳糖浓度0.3 g/L,硝酸铵浓度7 g/L, 卡拉胶浓度0.5 g/L。优化后发酵上清液酶活力达到15.21 U/mL, 与优化前相比提高了1.5倍。
热泉菌; 卡拉胶酶; 优化; 响应面
嗜热微生物由于能合成多种具有应用价值的耐热酶, 已成为近年来科学研究的热点[1]。微生物学家们普遍认为, 能在55℃以上高温环境生长的微生物为嗜热微生物, 包括最低等的古细菌和部分细菌,能在80℃以上环境中生长的为极端嗜热菌, 其中大部分是古细菌[2]。耐热酶是嗜热微生物产生的一类热稳定性酶, 这种酶特点就是在高温下达到最高催化效率。高温能提高底物和产物的溶解度, 减少物质与反应器的贴壁效应, 同时降低染菌风险, 减少产物收集难度, 所以耐热酶有望取代传统常温催化, 广泛用于食品、生物制药、废水处理等生产领域[3-4]。
卡拉胶(carrageenan)是海洋红藻中一种结构性多糖, 由α-1, 3和β-1, 4糖苷键交替连接的D-半乳糖或其衍生物组成。它是一种亲水性胶体, 主要存在于海藻细胞壁中[5]。常见的卡拉胶有κ-, λ-, ι-型, 另外也有α-, β-, θ-, μ-, ν-, γ-, δ-, ξ-, π-, ω-等类型的卡拉胶。卡拉胶的分子质量大、溶解性差、机体不易吸收、利用率低等缺点, 制约了卡拉胶在医药领域的应用[6], 目前卡拉胶主要用于食品相关工业。已有的研究结果表明: 利用卡拉胶制备的卡拉胶寡糖具有多种生物活性, 如抗病毒、抗氧化、抗凝血、免疫调节等[7-9], 因此在医药领域有很高应用价值。如何利用卡拉胶制备卡拉胶寡糖, 提升卡拉胶的应用价值已成为当前卡拉胶研究亟需攻克的技术。制备卡拉胶寡糖的方法主要有三种: 生物酶法、化学法及物理法。传统的化学法和物理法的主要缺陷是反应条件不易控制、产物聚合度很高且分布不均一。利用卡拉胶酶制备卡拉胶寡糖的生物酶法, 具有反应条件温和易控制、底物专一性好等优点, 能克服物理法和化学法的缺陷。因此利用生物酶法, 开发高活性的卡拉胶酶是提升卡拉胶应用价值的关键技术。
卡拉胶酶是能断裂卡拉胶β-1, 4糖苷键的半乳糖苷水解酶。根据底物类型, 可以分为 κ-, ι-, λ-卡拉胶酶[10]。迄今发现的卡拉胶酶大部分为热不稳定酶,当温度高于60℃时就会迅速失活, 严重限制了卡拉胶酶的应用。牟海津[11]研究表明, 卡拉胶降解菌M-2分泌的κ-卡拉胶酶在55℃放置30 min 即丧失全部酶活; Potin等[12]研究显示, Cytophaga菌株分泌的κ-卡拉胶酶在40℃放置1 h, 酶活亦完全丧失。而来源于嗜热微生物的高温酶因其作用温度高、耐热性好等优点, 是生物工程领域具有发展前景的酶资源。本研究以一株分泌热稳定卡拉胶酶的印尼热泉菌为对象, 通过16S rDNA测序的方法鉴定了该菌的种属,用响应面法确定了该菌的最适产酶发酵条件, 以期为生物酶法制备卡拉胶寡糖及卡拉胶寡糖的应用提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株
产卡拉胶酶的菌株分离自印度尼西亚卡利安达岛东海岸的热泉样品(5°44′46″N, 105°35′12″E), 现保存于国家海洋局海洋生物活性物质重点实验室菌种库中(-80)℃。
1.1.2 试剂
蛋白胨、酵母粉(Oxoid公司); 分析纯κ-、λ-、ι-卡拉胶(SIGMA公司); 混合卡拉胶(天津巴斯夫化工有限公司); 3-5二硝基水杨酸(DNS)、氢氧化钠、结晶酚、碘单质、碘化钾、亚硫酸钠、四水合酒石酸钾钠和甘氨酸均为国产分析纯。
1.1.3 培养基
2216E液体培养: 蛋白胨5g, 酵母粉1g, 1000 mL过滤海水配制;
2216E固体培养基: 蛋白胨5g, 酵母粉1g, 卡拉胶15g, 1000 mL过滤海水配制;
2216E斜面培养基: 蛋白胨5g, 酵母粉1g, 琼脂粉 15g, 1000 mL过滤海水配制。
1.2 实验方法
1.2.1 Bacillus sp.Car19菌株16S rDNA的鉴定
以Bacillus sp.Car19菌株基因组为DNA模板,利用通用引物27F、1492R[13]对Bacillus sp.Car19菌株16S rDNA基因进行PCR扩增, 使用3730测序仪对PCR产物进行序列测序并双向测通(南京金斯瑞生物公司)。将所测序列在GenBank数据库(NCBI)用BLAST分析比对并上传序列获得GenBank登录号。
1.2.2 Bacillus sp.Car19产卡拉胶酶的类型的确定
以2216E固体培养基作为基础培养基, 分别加入κ-, λ-, ι-卡拉胶制成筛选平板, 取2 μL含Bacillus sp.Car19的菌液于平板上, 在55℃恒温培养箱中倒置培养36 h, 然后用Lugol氏碘液染色, 观察菌落周围是否有透明圈, 以确定该菌产生的卡拉胶酶的类型。
1.2.3 卡拉胶酶活力的测定方法-DNS法[14]
前期实验表明, Bacillus sp.Car19发酵上清液中粗酶的最适作用条件为60℃、pH=9, 因此, 本次实验取1mL培养36h后的发酵上清液作为粗酶液, 与1mL 0.5%的卡拉胶在60℃、pH=9的甘氨酸-氢氧化钠缓冲液中反应15min后, 测量反应体系中还原糖的含量来表示粗酶的酶活。1个酶活力单位(U)定义为1mL发酵上清液在60℃和pH为9的条件下, 1min内催化产生1μg还原糖所需的酶量。酶活力计算公式[15]:

1.3 Bacillus sp.Car19的发酵条件优化
1.3.1 单因素实验
分别以培养温度、培养基pH、培养时间、接种量、不同碳源、不同氮源、最适碳源浓度、最适氮源浓度、不同金属离子、最适金属离子浓度、卡拉胶浓度及NaCl浓度作为唯一变量, 进行发酵实验,确定各种环境因素对Bacillus sp.Car19产酶的影响。各因素及水平见表1。以发酵液在波长600 nm下的吸光度代表其生物量, 离心发酵上清液酶活力最高时条件为单因素实验下最适产酶条件, 并将该条件下酶活力定义为100%。分别确定影响Bacillus sp.Car19产酶的最适培养温度、最适培养基pH、最适培养时间、最适接种量、最适碳源、最适氮源、最适碳源浓度、最适氮源浓度、最适金属离子、最适金属离子浓度、最适NaCl浓度以及卡拉胶浓度。其中, 确定最适碳源、氮源、金属离子后, 进一步设置不同浓度梯度找出最适碳源、氮源、金属离子的最适浓度。
1.3.2 响应面法优化Bacillus sp. Car19发酵条件
1.3.2.1 Plackett-Burman实验[16]
根据单因素的实验结果, 对上述9个因素进一步考察, 采用Factors=9, Runs=12的Plackett-Burman设计, 选取各因素最高和最低2个水平, 进行50 mL发酵实验, 用每毫升发酵上清液中卡拉胶酶活力表示响应值R1, 确定影响Bacillus sp. Car19发酵产酶的主要因素, 实验因素代码(实验因素对应代码全文不变)及水平见表2。
1.3.2.2 最陡爬坡实验[17]
据Plackett-Burman 实验结果, 利用Designexpert.v8.05软件进行各因素的方差分析, 得到各因素重要性排名顺序, 对排名前三的实验因素, 选择适合的坡度进行梯度实验, 得到发酵上清酶活力逼近最大响应面区域时的条件。
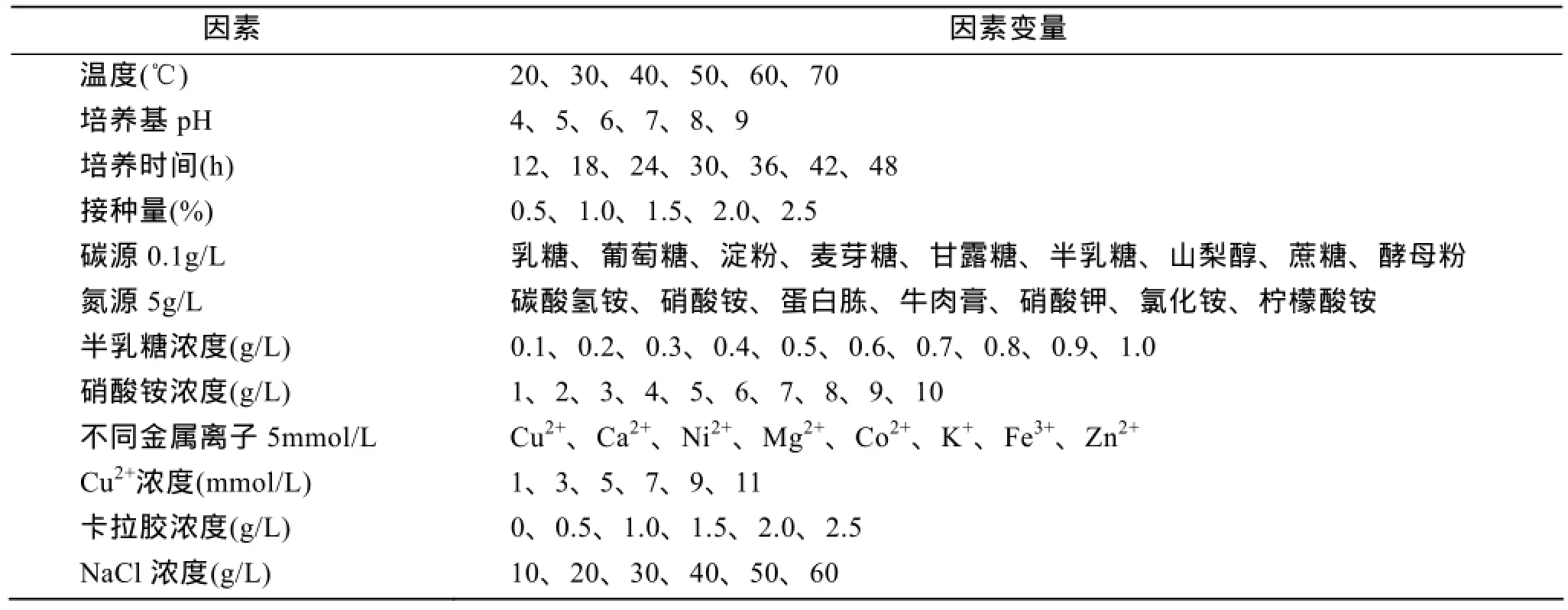
表1 单因素实验设计各因素及水平Tab. 1 Factors and levels in single factor experiment
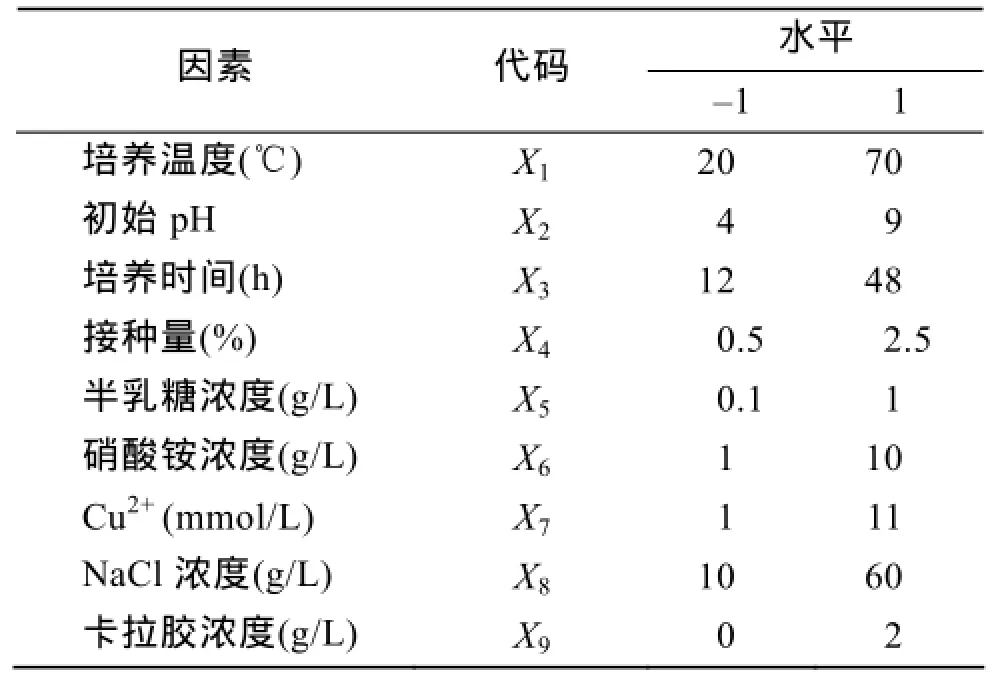
表2 Plackett-Burman实验中影响Bacillus sp.Car19产酶的因素及水平Tab. 2 Factors and levels affecting Bacillus sp. Car19 production of carrageenase in Plackett-Burman experiment
1.3.2.3 响应面Box-Behnken实验设计[18]
利用Design-expert.v8.05软件中Box-Benhnken设计响应面实验, 考察三个显著因素之间的交互作用及获得发酵上清液酶活力最高时的三因素组合。各因素代码及水平见表3, 其中以最陡爬坡实验中酶活力最高时的实验条件, 作为Box-Benhnken实验设计的中心点, 围绕中心点附近取一个最高和最低水平, 进行15个不同条件组合的发酵实验。
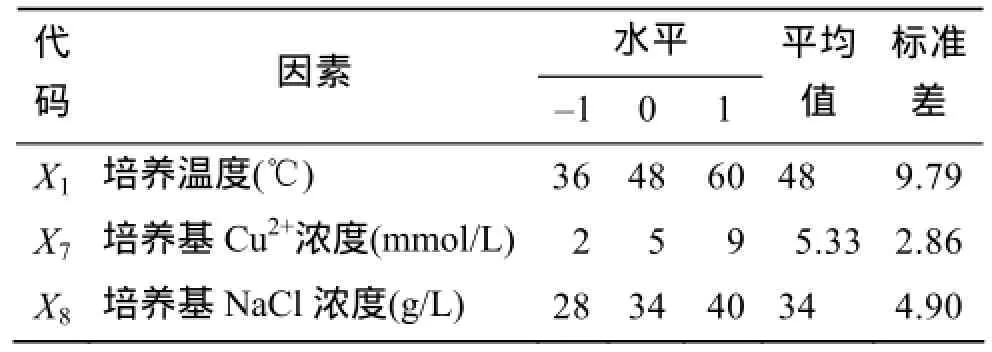
表3 Box-Behnken实验因素及水平Tab. 3 Box-Behnken factors and level values
2 结果与分析
2.1 菌种鉴定
Bacillus sp.Car19菌株16S rDNA经测序拼接后长度为1461 bp, 与NCBI数据库中Bacillus licheniformis DHXJ13菌株16S rDNA基因的相似度为99%, 因此确定该热泉菌属于芽孢杆菌属(Bacillus), 命名为Bacillus sp.Car19。将该序列上传至NCBI数据库, 获得GenBank登录号为(KT865196), 根据 Bacillus sp.Car19菌株16S rDNA构建的系统发育树如图1所示。

图1 根据Bacillus sp.Car19菌株16S rDNA基因序列构建的系统发育树Fig. 1 Neighbor-joining tree of Bacillus sp.Car19 based on 16S rDNA gene sequence
2.2 Bacillus sp.Car19所产卡拉胶酶的类型
Bacillus sp.Car19在含有不同类型卡拉胶的筛选平板生长36 h后, 只在含有κ-卡拉胶的筛选平板上产生明显的透明圈(图2), 而在其他类型卡拉胶的平板上没有透明圈(图略), 因此确定该酶为κ-卡拉胶酶。

图2 Bacillus sp.Car19在κ-卡拉胶平板上产生的透明圈Fig. 2 Bacillus sp. Car19 produced transparent circle on Kappa-carragenan solid medium
2.3 单因素实验结果
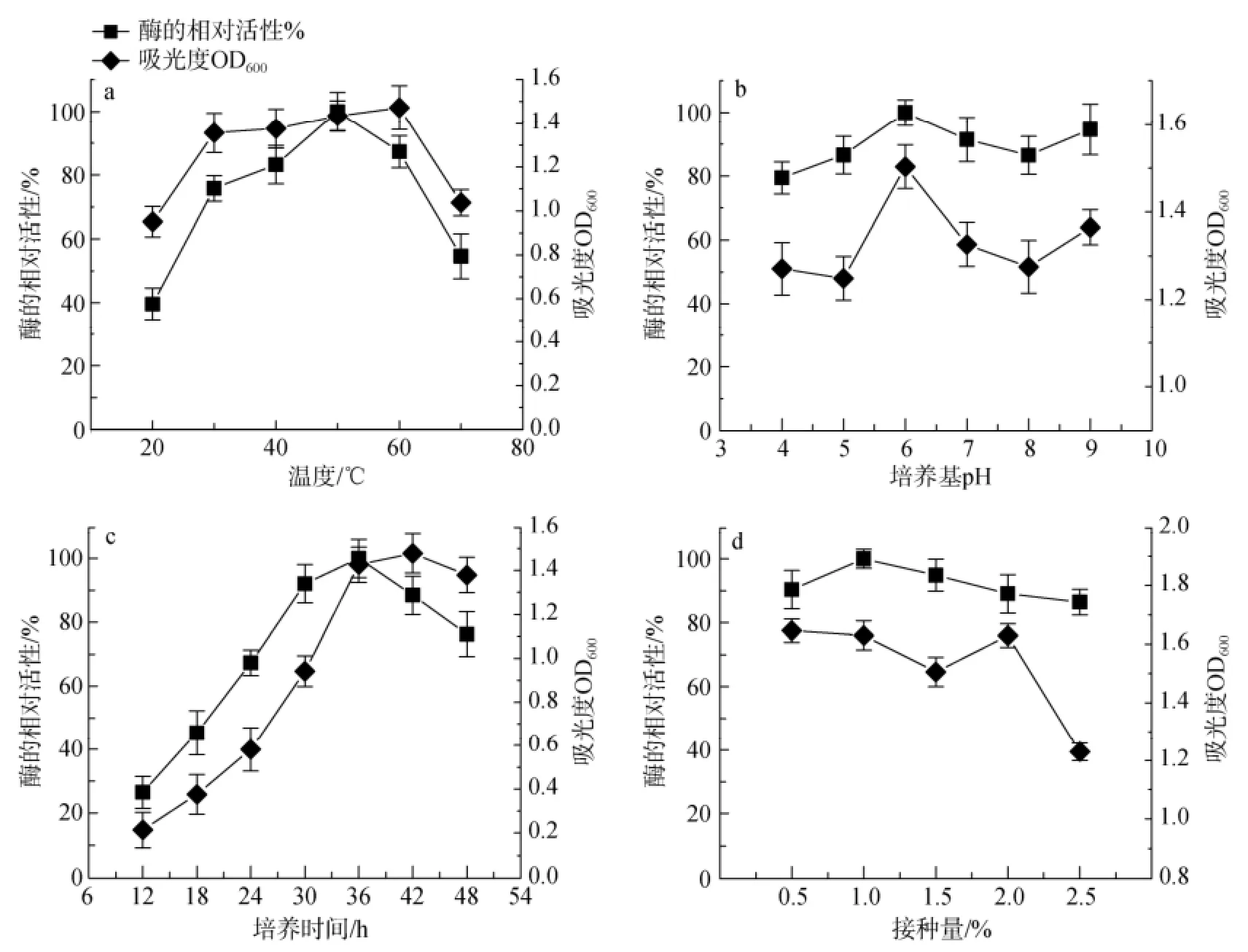
各种环境因素对Bacillus sp.Car19生长及产酶的影响情况见图3。由(图3-a)可以看出该菌在60℃时生物量达到最大值, 但相对酶活力在培养温度为50℃时最高; pH对菌体生长及产酶影响较小, 菌体在培养基pH=6时相对酶活力最高(图3-b); (图3-c)的结果表明最高酶活力出现在培养36 h时, 但菌的生物量还在继续增加, 直到48 h后才开始降低; 接种量在0.5%~1%(图3-d)之间时, 发酵上清液粗酶的酶活力保持增加趋势, 但接种量超过1%后, 发酵上清液粗酶酶活力开始降低, 但接种量过小, 菌体培养时间就会相对延长[19]。同时研究结果也表明, 最佳碳源为0.3 g/L的半乳糖(图3-e和图3-g), 最佳氮源为7 g/L的硝酸铵(图3-f和图3-h), 培养基中卡拉胶最佳浓度则为0.5 g/L(图3-k); 金属离子对菌体生长及产酶有较明显的影响, 特别是培养基中Cu2+浓度为5 mmol/L(图3-j)以及NaCl浓度为30 g/L时(图3-l)。
2.4 响应面实验结果
2.4.1 Plackett-Burman 实验结果
Plackett-Burman 实验结果见表4。从表4中可以看出: 进行12个不同因素最高最低水平组合的实验时, 发酵上清液最高酶活力为15.08 U/mL, 最低为9.35 U/mL。且不同条件组合下, 发酵液上清酶活力在9~12 U/mL之间比较集中。同时对实验结果进行F检验, 结果见表5, 从表5中可以看出影响Bacillus sp.Car19产酶的三个重要的因素依次是培养温度, 培养基中Cu2+含量, NaCl浓度, P值均小于0.05, 说明这 3 个因素对 Bacillus sp.Car19产酶活力影响显著, 因此选择这 3 个因子作为最陡爬坡实验进一步考察影响Bacillus sp.Car19产酶量的对象。
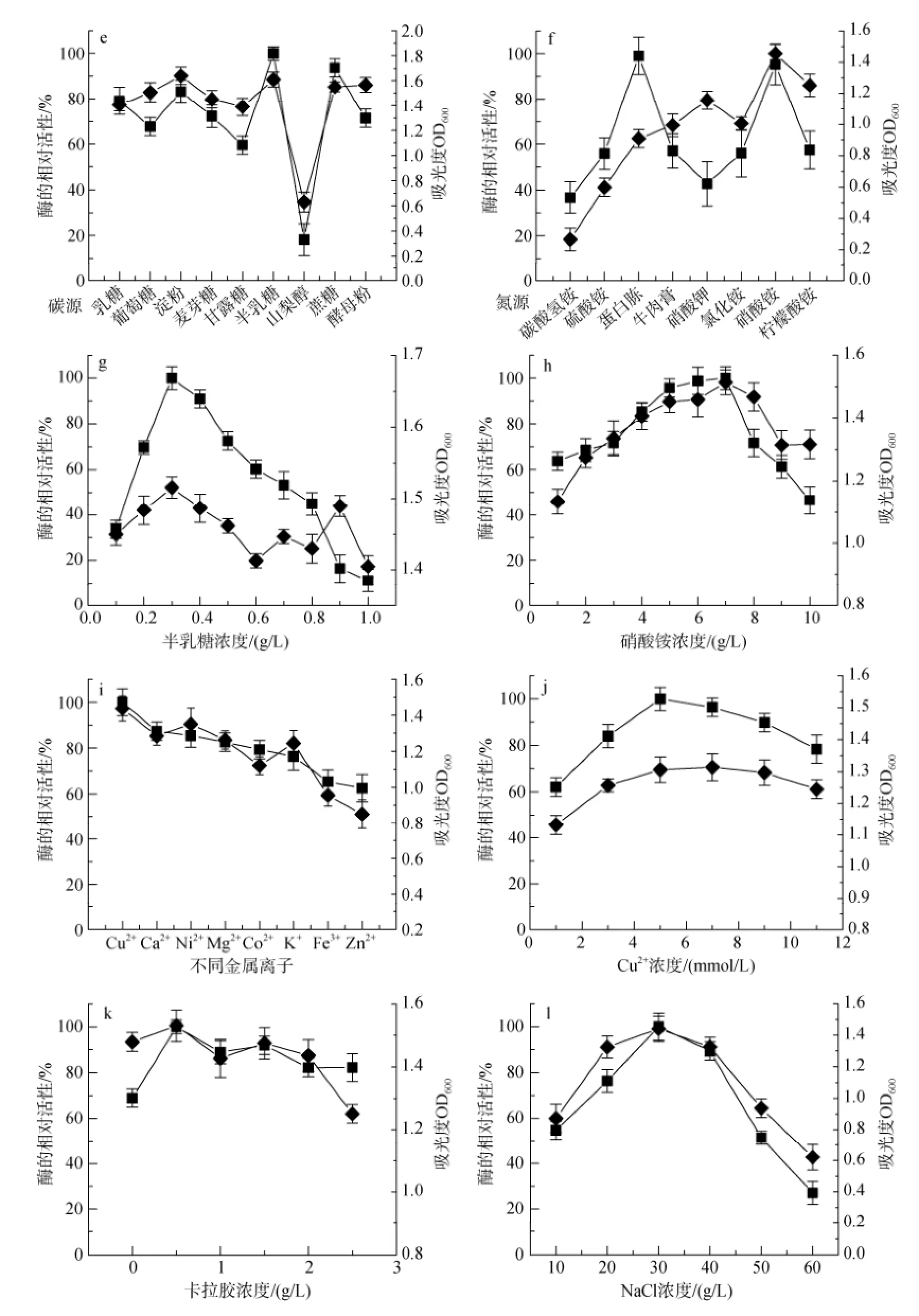
图3 不同培养条件对Bacillus sp. Car19生长及产卡拉胶酶的影响Fig. 3 Influence of different culture conditions on Bacillus sp. Car19 growth and carrageenase production
2.4.2 最陡爬坡实验结果
根据 Plackett-Burman 实验各因素重要性的排列顺序, 选出影响Bacillus sp.Car19产酶前三的因素进行梯度爬坡实验, 实验结果见表6。从表中可以看出在培养温度为54℃、Cu2+7 mmol/L、NaCl浓度36 g/L时发酵上清液的酶活力达到最大值15.07 U/mL, 因此将该条件作为下一步Box-Behnken响应面设计实验的中心点。
2.4.3 响应面Box-Behnken法获得最优发酵条件结果
以最陡爬坡实验得到的发酵上清酶活力最高实验条件为中心值, 分别取离中心值附近的各对称条件为最高最低水平, 采用factors=3, run=15进行Box-Behnken响应面实验设计, 实验设计及结果见表7。对实验结果进行二次多元回归方差分析, 得到发酵上清液酶活力R1与自变量培养温度X1、Cu2+浓度X7、NaCl浓度X8的的多元回归方程为:
R1=12.47+2.61X1+2.67X7+2.86X8-0.24X1X7+2.48 X1X8+1.42X7X8-2.03X12-2.14X72-2.90X82
回归模型方差分析见表8。从表中可以看出模型P=0.0401小于0.05, 说明线性模型回归显著, 模拟得到的方程可信。X1、X7、X8的P值均小于0.05, 对Bacillus sp.Car19产酶影响显著, 交互项和二次项的中X1X8、X82的P值小于0.05, 说明Bacillus sp.Car19卡拉胶酶产量受三因素之间交互作用的影响。决定系数R2=0. 9056, 失拟项CV=27.04%, 表明模型与实验拟合较好, 得到的方程可用。因此通过多元回归得到的方程可以很好的说明Bacillus sp.Car19产酶量与培养温度X1、Cu2+浓度X7、NaCl浓度X8之间的关系。

表4 Plackett-Burman实验设计及响应值结果Tab. 4 Plackett-Burman design and response results
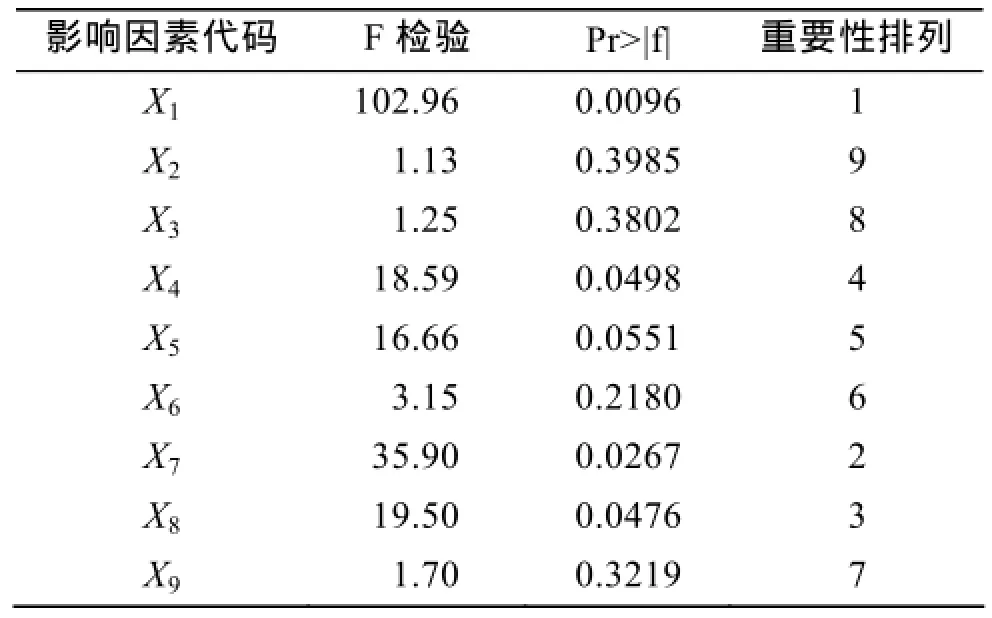
表5 Plackett-Burman实验主效应分析Tab. 5 Analysis of main effects of Plackett-Burman design
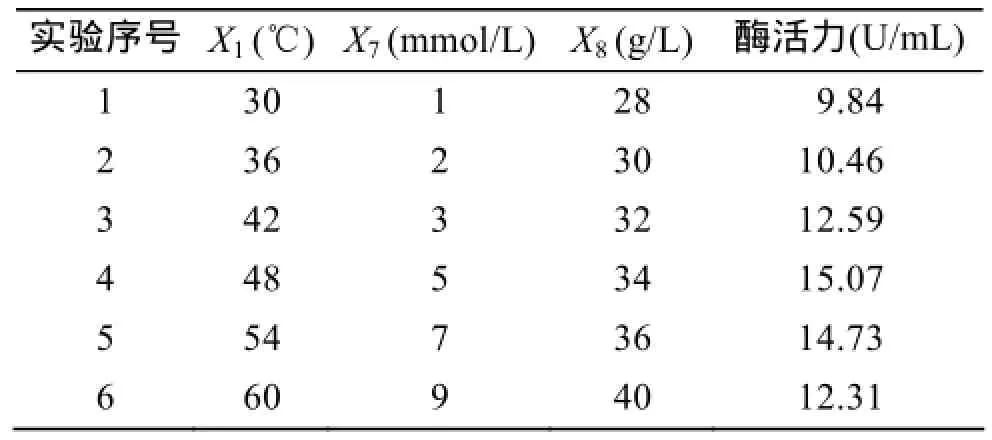
表6 最陡爬坡实验设计及结果Tab. 6 Experimental design and response of steepest ascent
根据多元回归方程(1)绘制的培养温度、Cu2+浓度、NaCl浓度两两交互作用的响应曲面及等高线见图4~图6。从响应曲面图可以看出发酵上清液酶活R1的值在所选因素范围内有最大值, 最大值即为等高面图的中心点。为求出多元回归方程(1)所构建模型的最大值及最大值条件下对应各因素的组合, 对所得的回归拟合方程分别求各自变量的一阶偏导数, 并令其为0, 得到三元一次方程组, 求解此方程组得到模型R1在最大值条件下各因素对应的值[20]: X1=52.31、X7=6.93、X8=37.03, 即当培养温度为52.31℃、Cu2+浓度为6.93 mmol/L、NaCl浓度为37.03 g/L时, 理论发酵上清液酶活力R1的最大值为15.82 U/mL。为进一步验证模型是否正确, 进行三组发酵实验验证, 每组培养基均为优化后得到的最优条件, 用三组数据平均值来表示优化后发酵上清液的酶活力。测得优化后发酵上清液酶活力R1=15.21 U/mL, 接近预测值,表明优化得到的发酵条件可信。发酵后的酶活力是未优化前的1.5倍, 优化后的培养基提高了Bacillus sp. Car19 的产酶量。
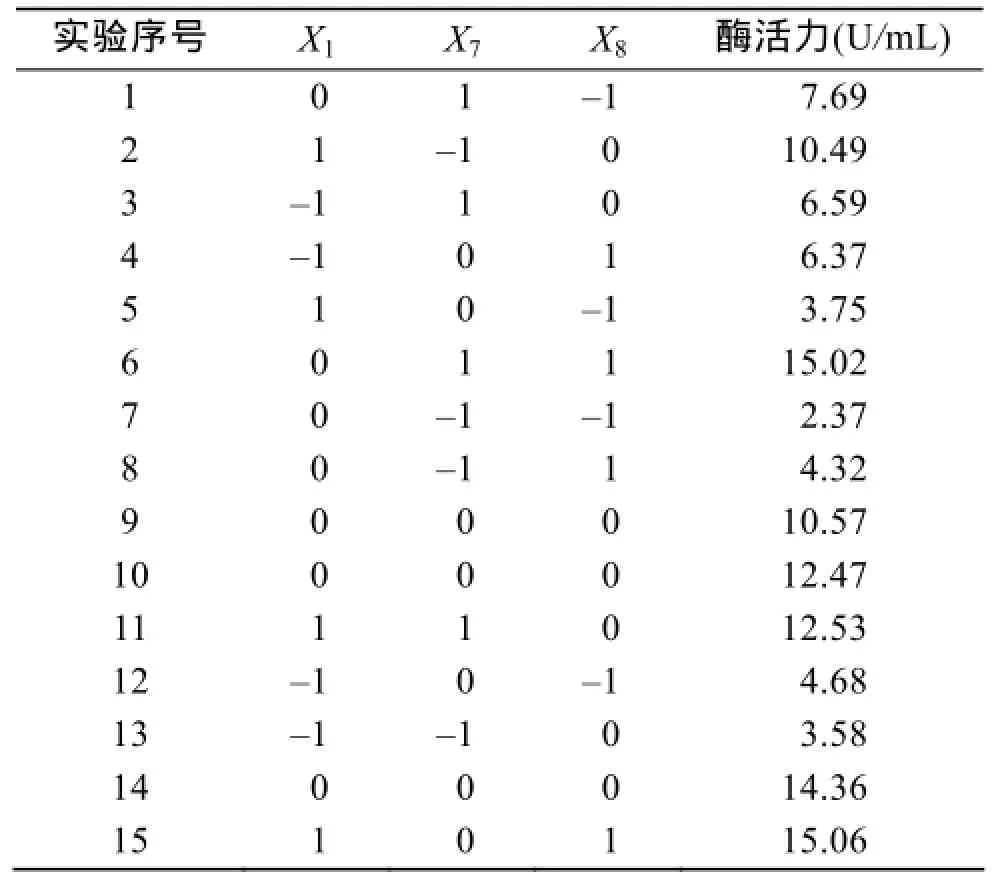
表7 Box-Behnken实验设计及结果Tab. 7 Box-Behnken design and results
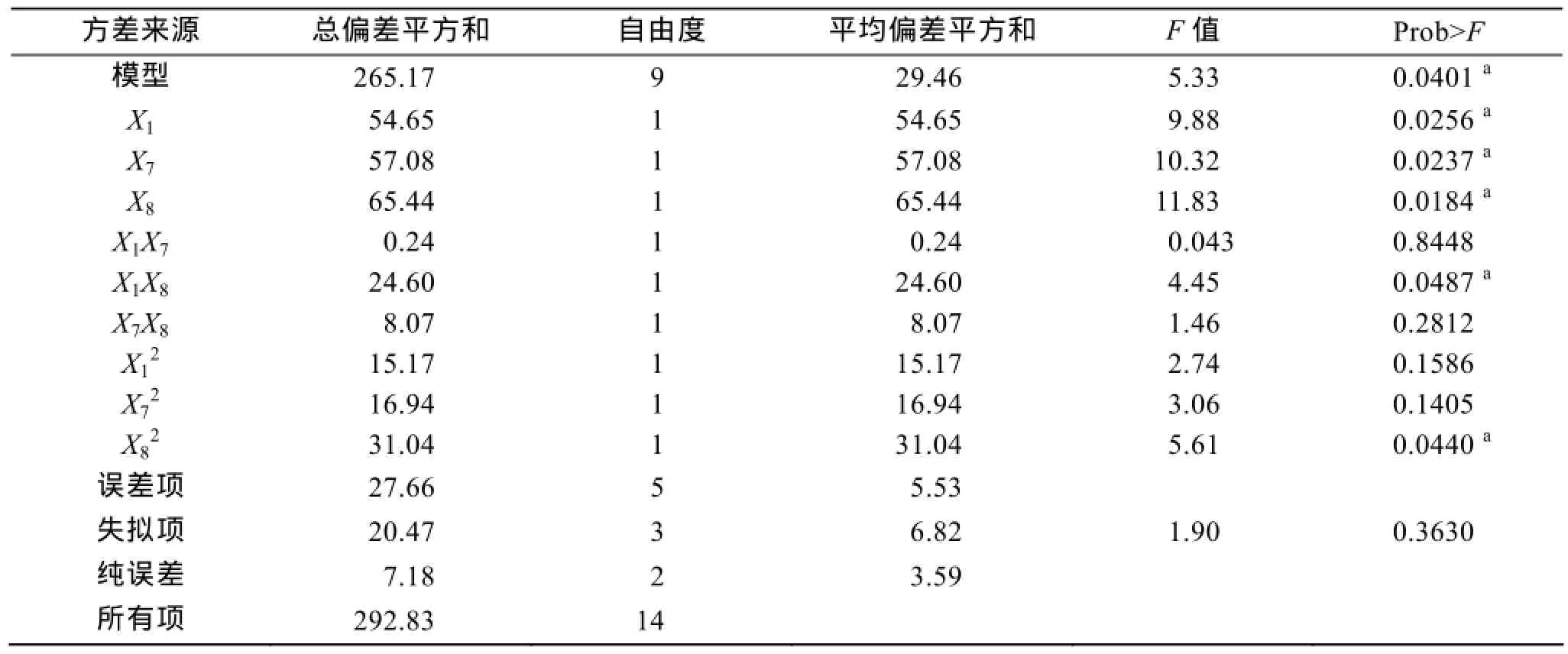
表8 回归方程方差分析Tab. 8 Analysis of variance by regression equation
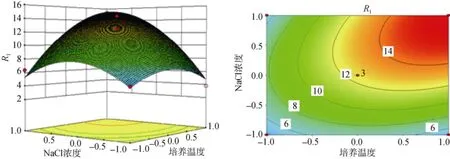
图4 NaCl浓度和培养温度影响Bacillus sp. Car19产卡拉胶酶绘制的响应曲面及等高线图Fig. 4 Response surface and contour plot of NaCl concentration and temperature influence on Bacillus sp. Car19 carrageenase production
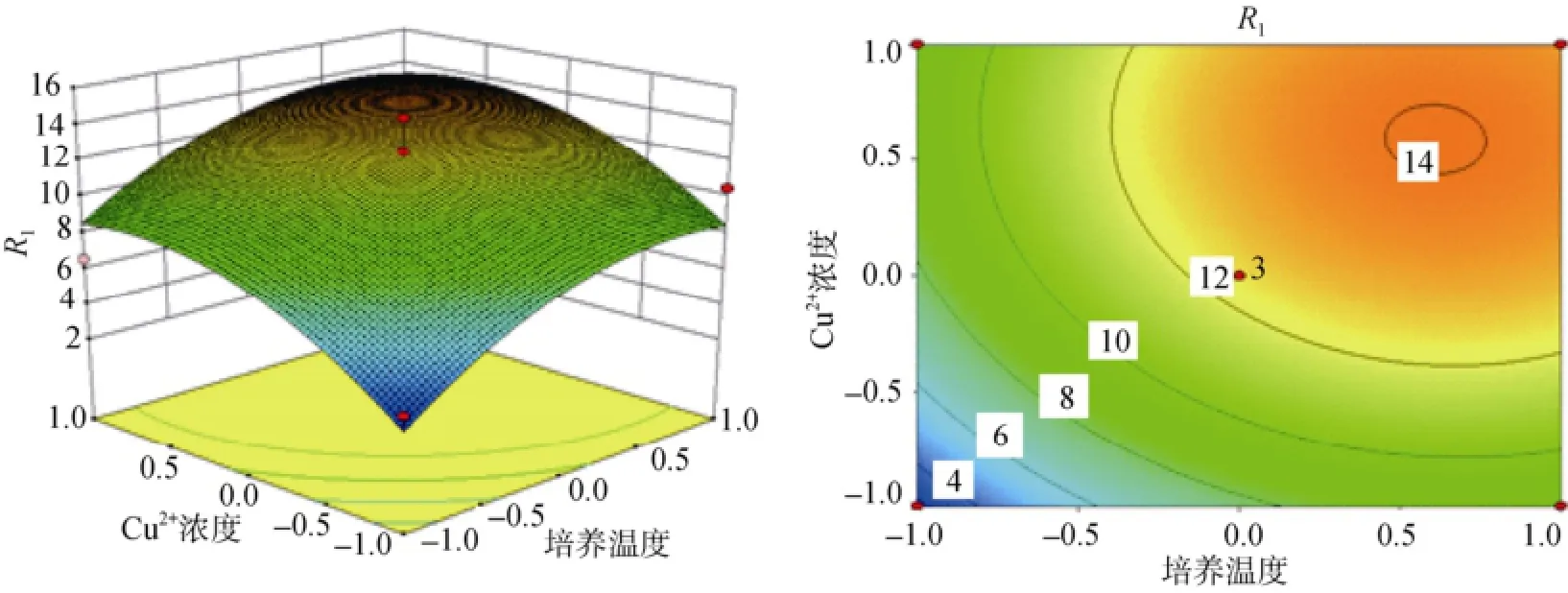
图5 Cu2+浓度和培养温度影响Bacillus sp. Car19产卡拉胶酶绘制的响应曲面及等高线图Fig. 5 Response surface and contour plot of Cu2+concentration and temperature influence Bacillus sp. Car19 carrageenase production
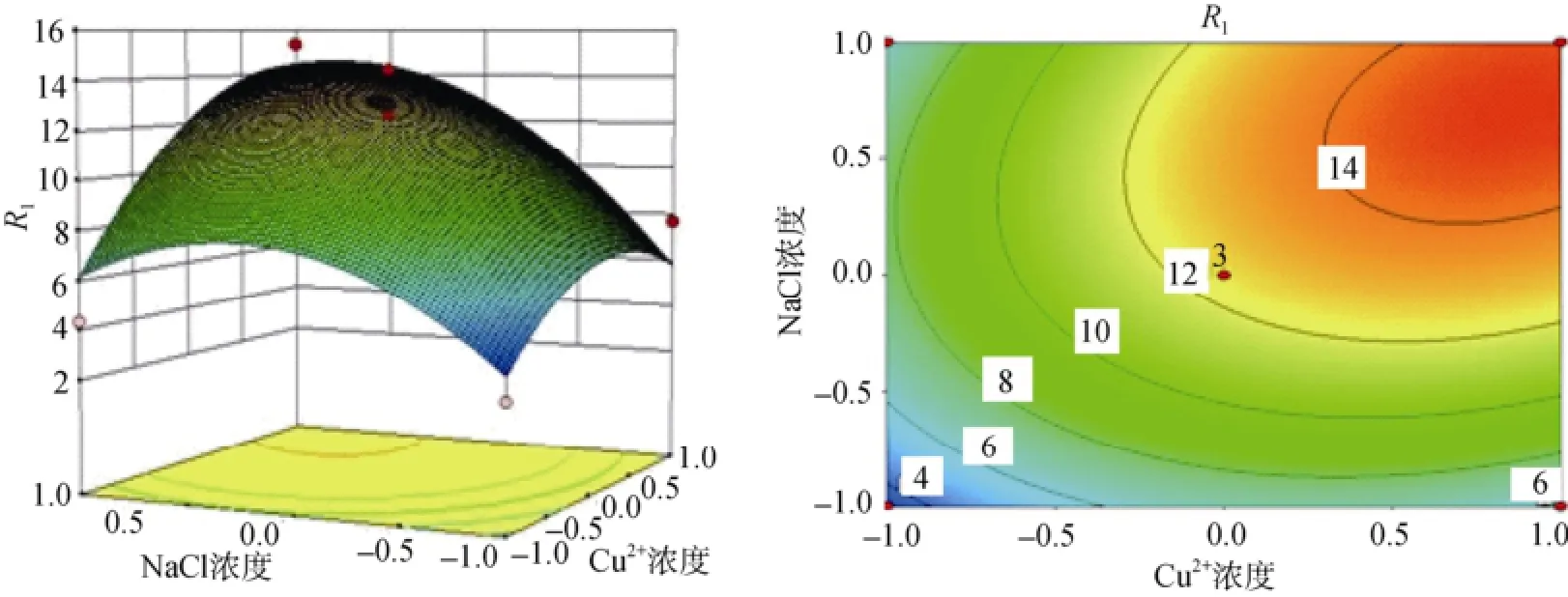
图6 NaCl浓度和Cu2+浓度影响Bacillus sp. Car19产卡拉胶酶绘制的响应曲面及等高线图Fig. 6 Response surface and contour plot of NaCl concentration and Cu2+concentration influence on Bacillus sp. Car19 carrageenase production
3 讨论
自从1966年首次在海洋微生物中发现能分泌卡拉胶酶的假单胞菌 Pseudomonas carrageenovora[21]以来, 已发现多种属的海洋微生物能产生卡拉胶酶,如噬纤维菌属、假单胞菌属、别单胞菌属、弧菌属等[22], 这些细菌多分离自海藻表面或以海藻为食的软体动物, 且多为热不稳定酶。本文研究的产酶菌株分离自印度尼西亚卡利安达岛东海岸的热泉群(5°44′46″N, 105°35′12″E), 热泉水温可达50~97℃[1],周边毗邻大型海藻床, 经鉴定该菌属于Bacillus属,与胡秋实等[23]发现的产卡拉胶酶菌株一致, 但前者为λ-卡拉胶降解菌, 而本研究中的菌株为κ-卡拉胶降解菌, 目前有关热泉菌产卡拉胶酶的报道尚不多见。
培养条件的优化在微生物代谢产物的研究中起着重要的作用, 与传统的单次单因子法和正交实验相比, 响应面法实验次数少、周期短, 不仅能够评价各因素对生物过程的影响, 并且还能体现各因素之间的交互作用得到最佳条件, 是优化培养条件的有效方法[24]。为了提高Bacillus sp. Car19产卡拉胶酶的能力, 本文采用响应面法对其培养条件经行了优化, 发现影响Bacillus sp. Car19产卡拉胶酶的三个主要因素分别为培养温度、NaCl浓度和Cu2+浓度。培养温度是微生物生长和代谢的关键因素, 由于Bacillus sp. Car19来源于热泉, 因此较高的培养温度也与其生长环境相一致, 较高的培养温度不仅能够缩短培养周期, 而且也可有效的避免杂菌的生长;李俊等[19]对HC4菌株产卡拉胶酶条件优化时发现, NaCl浓度对其产卡拉胶酶能力有较大影响, 且NaCl的最适浓度在20 g/L左右, 而本研究中NaCl浓度达到37.03g/L, 比普通海水的浓度略高; 至于Cu2+浓度对产酶能力的影响机制目前尚不清楚, 有待今后结合热泉样品的组成成分进行综合分析。
经过优化后, 发酵上清液的酶活力达到15.21 U /mL,比优化前提高了1.5倍, 加之Bacillus sp. Car19所产的卡拉胶酶作用温度高, 在后续制备产物的过程中杂菌很难生存, 能减少杂菌代谢物对产物的污染,同时减少物质的贴壁效应, 使得收集卡拉胶寡糖相对容易, 因而具有一定的应用潜力。
[1] 王帅, 林学政, 黄晓航, 等. 印尼热泉中产嗜热碱性蛋白酶菌株筛选及酶学性质研究[J]. 海洋科学进展, 2012, 30(2): 244-251. Wang Shuai, Lin Xuezheng, Huang Xiaohang, et al.Screening and Characterization of a Crude Thermophilic Alkaline Protease From an Isolated Strain of Brevibacillus PBI in Indonesia’s Hot Spring[J]. Advance In Marine Scince.2012, 30(2): 244-251.
[2] 刘艳, 黄晓航 何培青, 等. 印度洋深海热液区可培养细菌的分子鉴定与系统发育分析[J]. 海洋科学进展, 2009, 27(2): 193-200. Liu Yan, Huang Xiaohang, He Peiqing, et al. Molecular identification and phylogenetic analysis of cultivable bacteria from Indian ocean hydrothermal Ventsr[J]. Advances in Marine Science, 2009, 27(2): 193-200.
[3] Wu J, Bian Y, Tang B, et al. Cloning and analysis of WF146 protease, a novel thermophilic subtilisin-like protease with four inserted surface loops[J]. Fems Microbiology Letters, 2004, 230(2): 251-258.
[4] Huang G G, Ying T J, Huo P, et al. Purification and characterization of a protease from Thermophilic bacillus strain HS08[J]. African Journal of Biotechnology, 2006, 5(24): 347-356.
[5] Guibet M, Kervarec N, Génicot S, et al. Complete assignment of 1 H and 13 C NMR spectra of Gigartina skottsbergii, λ-carrageenan using carrabiose oligosaccharides prepared by enzymatic hydrolysis[J]. Carbohydrate Research, 2006, 341(11): 1859-1869.
[6] Kataoka T, Teraoka J, Sakoda A, et al. Erratum to: Protective Effects of Radon Inhalation on Carrageenan-Induced Inflammatory Paw Edema in Mice[J]. Inflammation, 2012, 35(35): 713-722.
[7] Zhou G, Sun Y P, Xin H, et al. In vivo antitumor and immunomodulation activities of different molecular weight lambda-carrageenans from Chondrus ocellatus[J]. Pharmacological Research, 2004, 50(1): 47-53.
[8] Cáceres P J, Carlucci M J, Damonte E B, et al. Carrageenans from chilean samples of Stenogramme interrupta, (Phyllophoraceae): structural analysis and biological activity[J]. Phytochemistry, 2000, 53(1): 81-86.
[9] 刘哲民. κ-卡拉胶酶基因克隆表达及酶法制备卡拉胶低聚糖工艺研究[D]. 青岛: 中国海洋大学, 2014. Liu Zhemin Kappa - carrageenan predominate enzyme gene cloning and enzymatic preparation of carrageenan oligosaccharides research process[D]. Qingdao: Ocean University of China, 2014.
[10] 上官巧灵. λ-卡拉胶寡糖的降解特征及其生物活性研究[D]. 宁波: 宁波大学, 2013. Shang Guan Qiaoling. Research on the degradation pattern of λ-carrageenan and the biological activities of λ-carrageenan oligosaccharides[D]. Ningbo: Ningbo University, 2013.
[11] 牟海津, 江晓路, 蒋萱, 等. 卡拉胶降解菌M-2的筛选与产酶性质[J]. 中国水产科学, 2002, 9(3): 251-254. Mou Haijin, Jiang Xiaolu, Jiang Xuan, et al Selection and enzymatic study of carrageenan-decomposing strain[J]. Journal of Fishery Sciences of China, 2002, 9(3): 251-254.
[12] Potin P , Sanseau A , Gall Y L, et al. Purification and characterization of a new kappa-carrageenase from a marine Cytophaga-like bacterium.[J]. European Journal of Biochemistry, 1991, 201(1): 241-247.
[13] Wolfgang L. Nucleic acid techniques in bacterial systematics and identification.[J]. International Journal of Food Microbiology, 2007, 120(3): 225-236.
[14] Shoemaker S P, Brown R D Jr. Characterization of endo-1, 4-beta-D-glucanases purified from Trichoderma viride.[J]. Biochimica Et Biophysica Acta, 1978, 523(1): 147-161.
[15] 沙玉杰, 杨平平, 何培青, 等. 印尼热泉菌Bacillus sp.BI-3产琼胶酶的发酵条件优化[J]. 海洋与湖沼, 2013, 44(5): 1358-1364. Sha Yujie, Yang Pingping, He Peiqing, et al. Optimization of fermentation condition for agarase production of strain Bacillus sp. BI-3 from Indonesian hot spring[J]. Oceanologia et Limnologia Sinica, 2013, 44(5): 1358- 1364.
[16] 唐志红, 刘苹, 吕家森, 等. 利用响应面法优化海洋细菌YDX-1产纤维素酶的发酵条件[J]. 食品科技, 2011, 36(3): 6-9. Tang Zhihong, Liu Ping, Lü Jiasen, et al, Optimization of cellulase production condition by marine bacteria YDX-1 using response surface methodology[J]. Food Scince And Technology, 2011, 36(3): 6-9.
[17] 张大皓, 谭天伟, 王炳武. 响应面实验设计优化脂肪酶发酵培养基[J]. 北京化工大学学报: 自然科学版, 2006, 33(2): 41-45. Zhang Dahao, Tan Tianwei, Wang Bingwu. Response surface analysis of lipase production by Penicillium camembertii Thom[J]. Journal of Beijing university chemical technology, 2006, 33(2): 41-45.
[18] 胡娜, 许杨. Box-Behnken法模拟黄曲霉AS3.4408最适产毒条件的研究[J]. 食品科技, 2006, 31(7): 43-47. Hu Na, Xu Yang.Study on cultivation conditions for aflatoxin producing by aspergillus flavus AS3.4408using Box- Behnken des ign[J]. Food Scince And Technology, 2006, 31(7): 43-47.
[19] 李俊, 马悦欣, 冯兵, 等. 产κ-卡拉胶酶菌株的筛选及其发酵条件的优化[J]. 大连海洋大学学报, 2009, 24(1): 24-29. Li Jun, Mai Yuexin, Feng Bing, et al .Screening and optimization of fermentation conditions by a κ-carrageenase producing bacteriu[J]. Journal of Dalian Fisheries University, 2009, 24(1): 24-29.
[20] 刘玉佩, 汪立平, 赵勇, 等. 解淀粉芽孢杆菌产褐藻胶裂解酶的发酵条件优化[J]. 湖南农业科学, 2010(5): 17-20. Liu Yupei, Wang Liping, Zhao Yong, et al.Optimization of fermentation conditions of Bacillus amyloliquefaciens producing alginate lyase[J]. Hunan Agricultural Scinece, 2010(5): 17-20.
[21] Weigl, W, Yaphe. Glycosulfatase of pseudomonas carrageenovora desulfation of dsiaccharide κ-carrageenan[J]. Canadian Journal of Microbiology, 1966, 12(12): 874-876.
[22] Greer C W, Yaphe W. Purification and properties of ι-carrageenanse from a marine bacterium[J]. Canadian Journal of Microbiology, 1984, 30: 1500-1506.
[23] 胡秋实, 苏忠亮, 何培青, 等. 响应面法优化热泉菌Bacillus sp.Lc50-1的发酵产卡拉胶酶条件[J]. 海洋科学进展, 2014, 32(2): 259-267. Hu Qiushi, Su Zhongliang, He Peiqing, et al. Optimization of carrageenase fermentation conditions of hot spring bacterium Bacillus sp. Lc-501 by response surface methodology[J]. Advances in Marine Science, 2014, 32(2): 259-267.
[24] 杜沛, 朱丽娟, 陈双喜, 响应面法优化Bacillus subtilis HD-F9产γ-聚谷氨酸发酵培养基. 河南大学学报, 2010, 40(5): 498-502. Du Pei, Zhu Lijuan, Chen Shuangxi. Fermentation medium optimization for γ-PGA production of Bacillus subtilis HD-F9 by response surface methodology[J]. Journal of Henan university, 2010, 40(5): 498-502.
Received: Jan. 25, 2016
Optimization of fermentation conditions for thermostable κ-carrageenase production of strain Bacillus sp. Car19
XIE Mai-sheng, LI Jiang, LIN Xue-zheng, HE Pei-qing
(First Institute of Oceanography, SOA, Qingdao 266061, China)
Hot spring bacterium; Carrageenase; Optimization; Response surface
In this study, we identified a high-yield κ-carrageenase bacteria strain by its 16S rDNA sequence and optimized the fermentation conditions using a response surface methodology. The results show that the hot-spring bacterium was 99% identical to Bacillus sp. and therefore we assigned it to the Bacillus genus and named it Bacillus sp. Car19 (GenBank accession number: KT865196). The optimized fermentation conditions of Bacillus sp. Car19 involve nine factors that affect Bacillus sp. Car19 carrageenase production, and the three main factors are culture temperature, Cu2+concentration, and NaCl concentration. Combined with subordinate factors, the final optimized fermentation conditions for maximal activity, as determined by regression analysis are as follows: a culture temperature of 52.31℃, a Cu2+concentration of 6.93 mmol/L, an NaCl concentration of 37.03 g/L, medium pH = 6, 1% inoculation quantity, 36 h incubation time, a galactose concentration of 0.3 g/L, an ammonium nitrate concentration of 7 g/L, and a carrageenan concentration of 0.5 g/L. The supernatant carrageenase activity after optimized fermentation can reach 15.82 U/mL, which is 1.5 times that without optimization.
Q178.53
A
1000-3096(2016)11-0007-10
10.11759/hykx20160125001
(本文编辑: 康亦兼)
2016-01-25;
2016-04-26
海洋公益性行业科研专项项目(201505026); 青岛市应用基础研究计划项目(14-2-4-14-jch); 国家海洋局海洋生物活性物质与现代分析技术重点实验室开放基金(MBSMAT-2015-06)
[Foundation: Public Science and Technology Research Funds Project of Ocean (201505026); Qingdao Fundamental and Applied Research Project (14-2-4-14-jch); Key Lab of Marine Bioactive Substance and Modern Analytical Technique, SOA (MBSMAT-2015-06)]
谢买胜(1992-), 男, 江西九江人, 硕士研究生, 研究方向:极地微生物学, E-mail: 903741992 @qq.com 电话: 13127057267; 李江, 通信作者, 副研究员, 博士, 研究方向: 极端微生物环境适应性及其活性物质研究, Email: lijiang@fio.org.cn

