常压室温等离子体技术诱变选育鲅鱼抗氧化肽发酵菌株
艾冰花, 艾丽花, 李秉钧, 冯俊荣, 韩龚文, 于本淑
(1. 烟台大学 海洋学院, 山东 烟台 264005; 2. 烟台大学 生命科学学院, 山东 烟台 264005; 3. 龙口市水产技术推广站, 山东 龙口 265700; 4. 山东省水生生物资源养护管理中心, 山东 烟台 264003)
常压室温等离子体技术诱变选育鲅鱼抗氧化肽发酵菌株
艾冰花1, 艾丽花2, 李秉钧1, 冯俊荣1, 韩龚文3, 于本淑4
(1. 烟台大学 海洋学院, 山东 烟台 264005; 2. 烟台大学 生命科学学院, 山东 烟台 264005; 3. 龙口市水产技术推广站, 山东 龙口 265700; 4. 山东省水生生物资源养护管理中心, 山东 烟台 264003)
鲅鱼(Spanish mackerel)加工后的废弃物富含蛋白质, 为了提高蛋白质的利用率并减少环境污染,可以采用微生物发酵的方法酶解这部分蛋白质制取抗氧化活性肽。本实验室已经筛选出一株芽孢杆菌(Bacillus subtilis)Hy-2, 以其发酵水产加工废弃物得到了具有较高抗氧化性的产物。为了进一步提高产物的抗氧化性, 作者以该株产蛋白酶芽孢杆菌Hy-2为出发菌, 采用常压室温等离子体(ARTP)诱变的方法筛选出1株突变菌Hy-23, 以鲅鱼加工后的废弃物为原料, 接种该突变菌株进行发酵, 得到了具有一定抗氧化活性的发酵产物, 酶解物总抗氧化活性提高了12.4%。经遗传稳定性测定, 该芽孢杆菌突变株在传代8次之后其遗传稳定性仍然良好。
常压室温等离子体; 蛋白酶; 抗氧化活性; 遗传稳定性
天然抗氧化剂抗氧化效率高、对机体无毒副作用, 已成为研究的热点[1]。由于海洋生物源蛋白的种类和数量远远大于陆地生物源蛋白, 其蕴藏的活性肽片段也多种多样[2]。因此, 使用海洋水产动物加工废弃物制备抗氧化肽可以提高蛋白质的利用率, 也增加了原料的产值。常压室温等离子体(Atmospheric and Room Temperature Plasma, ARTP)是近几年发展起来的一种等离子体源, 其主要成分是活性离子,与生物大分子和细胞作用效果明显, ARTP诱变技术操作方便, 产生突变的多样性大, 对处理材料损伤较轻, 安全性高, 已经成功实现了30种以上微生物的突变, 成为高效的微生物基因组突变新方法[3-7]。作者采用ARTP诱变的方法筛选出了一株能有效降解鲅鱼(Spanish mackerel)蛋白, 且酶解物具有一定抗氧化活性的菌株Hy-23, 接种该菌的发酵产物总抗氧化活性提高了12.4%。研究结果为以后发酵制取抗氧化肽提供了一定微生物学基础[8]。
1 材料与方法
1.1 原料与供试菌株
鲅鱼粉: 鲅鱼加工后的边角料, 不包含头, 鳍和内脏, 经绞碎, 干燥, 有机溶剂脱脂后烘干并过80目筛网, 蛋白质含量75.07%, 脂肪含量15.90%。
蛋白酶产生菌Hy-2。该菌在室温下于鲅鱼加工废弃物中筛选, 具有一定水解鲅鱼蛋白的蛋白酶活力。
1.2 主要仪器与设备
常压室温等离子体诱变系统(ARTP), ARTP-IIS型(北京思清源生物科技有限公司); 台式高速离心机, H1650-W型(湖南湘仪实验室仪器开发有限公司);数显光照振荡培养箱, 250HG型(金坛市精达仪器制造厂)。可见分光光度计, V-1100D型(上海美谱达仪器有限公司); 立式压力蒸汽灭菌器, LDZM-40KCS型(上海申安医疗器械厂)等。
1.3 培养基与试剂
参考艾冰花等[9]的配方稍作修改。
酪素固体培养基: 蛋白胨1.0%、葡萄糖0.1%、氯化钠0.5%、氯化钙0.01 %、L-酪氨酸0.01%、琼脂2.2%、干酪素0.5%, pH 6.6。
试剂: 牛肉膏、蛋白胨、琼脂、NaCl、Na2HPO4·12H2O、NaH2PO4·2H2O、Na2CO3、三氯乙酸、干酪素、L-酪氨酸、福林酚等; 总抗氧化能力(T-AOC)试剂盒(南京建成生物工程研究所)。
1.4 试验方法
1.4.1 菌株Hy-2生长曲线的测定
参考艾冰花等[9]的试验方法和结果。
1.4.2 ARTP诱变育种步骤
使用无菌生理盐水制备的菌悬液作为ARTP系统的处理对象。优先采用对数期细胞, 为保证处理的均一性, 菌浓度不宜太高, 一般为106~108个/mL。本实验中菌悬液浓度为1.25×107个/mL。
参考范新蕾等[10]的参数设置, 在超净台内, 将载玻片置于酒精灯外焰灼烧30 s, 待冷却后放到已灭菌的培养皿中, 取10 μL菌液均匀涂布在载片表面。将装有样品载片的培养皿移至ARTP诱变育种仪操作室, 用无菌镊子将载片放到对应凹槽。调节手动旋转样品载台旋钮, 使载片与等离子体发生器射流出口间距约为2 mm; 设定功率为120 W、气量为10 L/min,处理时间设定完毕后开始处理样品。全部样品处理完毕, 用无菌镊子将载片分别放至装有1mL无菌溶液的EP管中。将EP管置于振荡器上振荡1 min, 把附着在载片上的微生物洗脱到无菌溶液中, 形成新的菌悬液。最后, 对处理过的菌悬液进行适当稀释, 取100 μL稀释液涂布培养皿, 培养计数。计算致死率。
1.4.3 蛋白酶活力初选
按照最佳照射时间处理菌悬液后, 将菌悬液涂布到酪素固体培养基上, 28℃生长24 h后, 挑选菌落较大的或者透明水解圈直径与菌落直径比值(HE值)大的菌落, 作为总抗氧化性复筛的菌株。
1.4.4 抗氧化活性复筛
将蛋白酶活力初选得到的菌以2%的接种量接种于总抗氧化活性复筛培养基中, 28℃摇瓶发酵, 根据经验, 取发酵48 h的发酵液, 沸水浴灭酶10 min后, 10 000 r/min, 离心10 min, 取上清液测定发酵液总抗氧化活性。
总抗氧化活性的测定使用总抗氧化能力测定试剂盒。机体中有许多抗氧化物质, 能使Fe3+还原成Fe2+, 后者可与菲啉类物质形成稳固的络和物, 通过比色可测出其抗氧化能力的高低。按照说明书的步骤进行加样, 取样量为0.2 mL。计算公式为
式中, MT-AOC为总抗氧化能力(U); A为测定OD值; A0为对照OD值; V1为反应液总量(mL); V2为取样量(mL); N为样本测试前稀释倍数; V3为发酵液体积(mL)。
1.4.5 遗传稳定性测定
将正突变株接种于蛋白酶初选培养基上, 连续传代8次[11], 用每一次传代的菌株进行发酵试验, 均测定酶解物总抗氧化活性。
根据遗传稳定性测定的结果, 确定遗传稳定性较好的突变株, 使用该突变株进行发酵试验, 使用SPSS数据处理软件对发酵液总抗氧化活性进行单因素方差分析, 进一步验证数据的可靠性。
2 结果与分析
2.1 菌株Hy-7生长曲线
如图1所示, 菌株Hy-2的对数生长期为12 h~20 h,因此选择生长14 h的菌即对数中前期的细胞做ARTP诱变[12]。
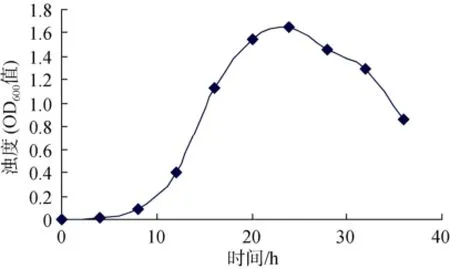
图1 菌株Hy-2生长曲线Fig. 1 Growth curve of bacteria Hy-2
2.2 ARTP诱变时间的选择
由图2可以看出, 随着照射时间的增加, ARTP诱变的致死率增加。根据现代育种理论, 致死率达到90%~95%范围时, 产生正突变的几率较高[13]。因此选择ARTP诱变的时间为120 s, 此时的致死率为91%。稀释倍为105时, 菌落数大小合适, 菌落水解圈清晰可见, 因此ARTP诱变的条件为等离子体照射120s, 稀释倍数为105。
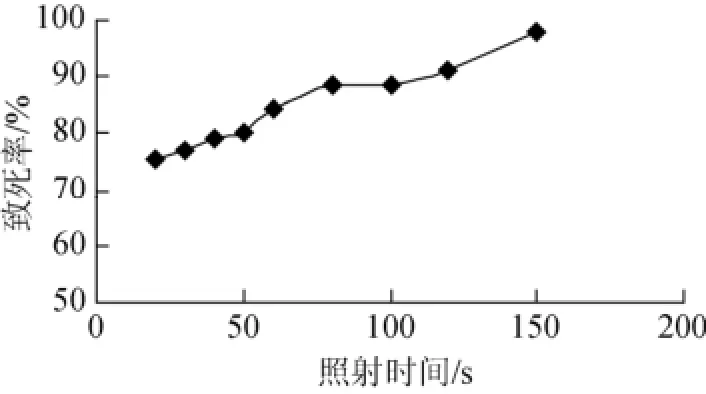
图2 菌株Hy-2在不同时间ARTP照射下的致死率Fig. 2 Lethal rate of bacteria Hy-2 at different times under ARTP
2.3 蛋白酶活力初选
根据菌落大小以及HE值筛选出9个突变株, 其HE值如表1所示。其中菌株Hy-22, Hy-25, Hy-26, Hy-27, Hy-29的HE值较出发菌Hy-2大, 菌株Hy-21, Hy-23, Hy-24, Hy-28的HE值虽然较出发菌小, 但其菌落直径明显比较大[14]。由于这9株突变菌虽具有一定的产酶能力, 但在以鲅鱼加工废弃物蛋白为底物时, 它们分解出来的肽的抗氧化性各不相同, 要选择能够水解鲅鱼蛋白, 且水解物具有较高抗氧化活性的菌株则需要进一步做水解物总抗氧化活性复筛。因此选择这9株突变菌株接种于菌种传代保藏培养基中做下一步筛选。
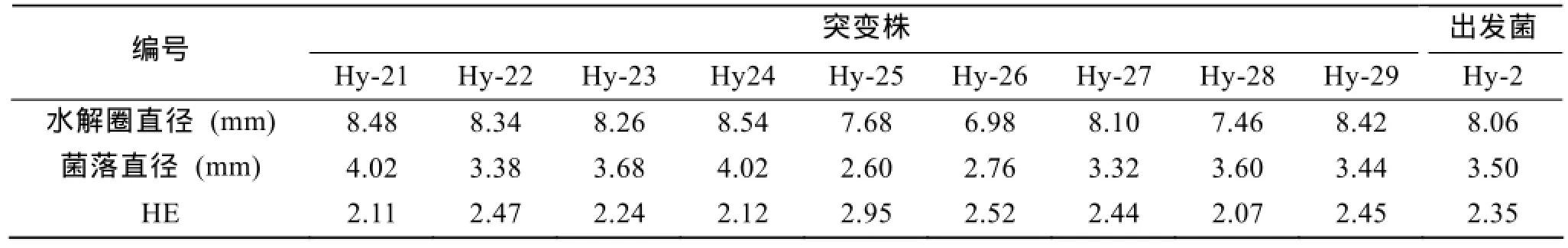
表1 9个突变株蛋白酶活力初选结果Tab.1 HE of nine mutants in the preliminary selection
2.4 总抗氧化活性复筛
分别接种9株蛋白酶活力初选得到的菌株于种子液培养基中, 30℃摇瓶培养26 h作为复筛的种子液, 以2%的接种量将9个突变株种子液接种于总抗氧化活性复筛培养基中。摇瓶发酵48 h后, 取各自的发酵液离心(10 000 r/min, 10 min)澄清后测定总抗氧化活性。结果如表2所示, 只有7个突变株的总抗氧化活性比出发菌高, 选择总抗氧化性增加率大于10%的菌株可以确定为正突变, 分别为Hy-1, Hy-2, Hy-3号菌株。
下一步需要对这3株突变株进行遗传稳定性测定, 以确保其在传代的过程中其产酶是稳定的。
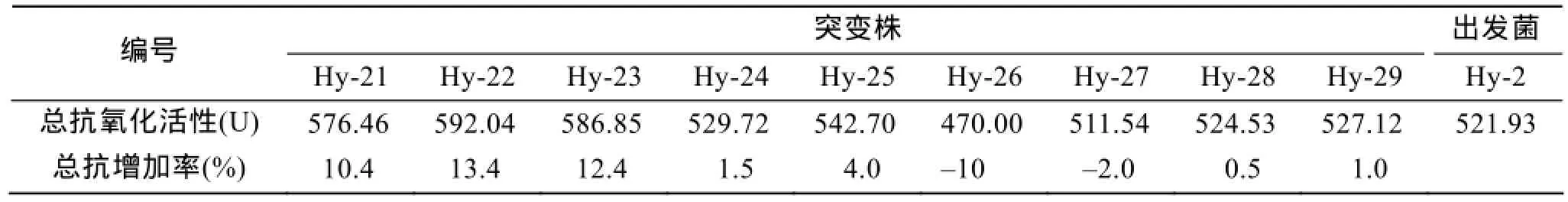
表2 9个突变株总抗氧化活性复筛结果Tab. 2 Total antioxidant activity of nine mutants in the second screening
2.5 遗传稳定性测定
3株突变株的遗传稳定性测定结果如图3所示:在连续传代8次中, 菌株Hy-21发酵的水解物总抗氧化性增加率始终不高, 与筛选时的增加率10.4%相差较大, 且在第七次传代中出现了负值。菌株Hy-22发酵的水解物总抗氧化性增加率在八次传代中与复筛时的增加率相比, 数值的波动较大。菌株Hy-23发酵的水解物总抗氧化性增加率在八次传代中与复筛时的增加率相比数值差别不大, 且数值的稳定性较好, 增加率为11.6%~13.6%(排除了异常值8.7%), 增加率波动在6.4%~9.6%, 波动不超过10%。
突变株Hy-23的单因素方差分析结果如表3所示: P=0.095(>0.05), 说明8次传代过程中, 发酵液的总抗氧化活性变化不显著。说明Hy-23号突变菌的遗传稳定性较好, 可以作为最终的ARTP诱变育种的突变株。
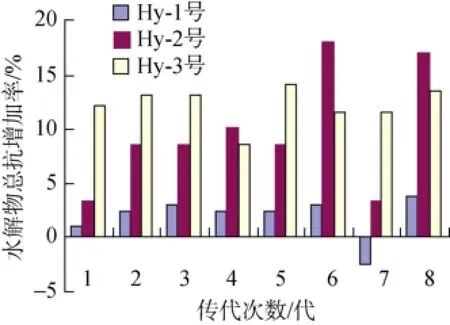
图3 3个突变株遗传稳定性结果Fig. 3 Genetic stability results for three mutant strains
对比艾冰花等[9]的结果, 正突变菌往往是菌落直径较出发菌大的, 相比HE值对正突变的贡献率,菌落直径可能起到更大的作用。说明经过突变后, 正突变菌生长可能更为迅速, 产酶更加活跃, 这一点还有待进一步研究。
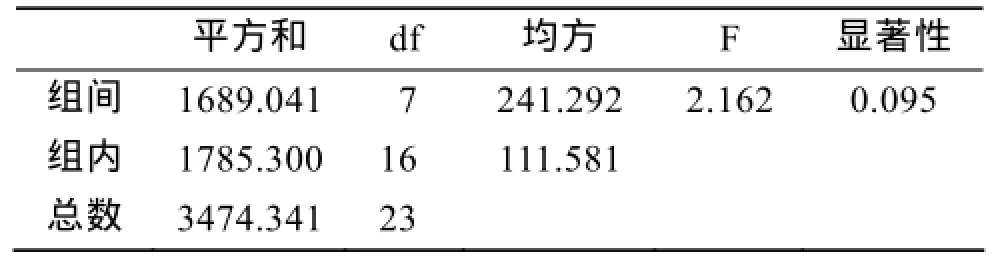
表3 突变株Hy-23单因素方差分析结果Tab. 3 Results of the single-effect analysis of variance of mutant Hy-23
3 讨论
虽然ARTP诱变技术是一种新型的诱变技术,然而利用该技术已经取得了不少成果。柏中中等[15]利用ARTP诱变技术筛选获得了一株D-乳酸高发酵菌株, 其D-乳酸发酵产率比出发菌提高了36.3%。通过ARTP技术对拜氏梭菌(Clostriadium beijerinckii)进行诱变, 其诱变株丁醇产量提高10%, 丙酮/丁醇/乙醇产量提高24%以上[16]。薛刚等[17]利用ARTP诱变技术选育出一株高产蛋白酶菌株, 蛋白酶活力是出发菌的1.56倍。
与艾冰花等[9]利用紫外诱变选育抗氧化肽发酵菌株的结果相对比, 前者利用两次紫外诱变得到发酵产物总抗氧化活性提高了10.2%, 后者只利用一次ARTP诱变即获得总抗氧化性提高12.4%的发酵产物。由此可以推测, ARTP诱变技术作为一种新型的诱变技术可以在一定程度上克服长期使用紫外诱变产生的抗性缺陷。沈小静等[4]利用常压室温等离子体射流诱变(ARTP)和紫外照射对红霉素产生菌进行复合诱变, 得到4株产量明显提高的突变菌株, 4株菌的平均发酵效价较出发菌株提高25.2%。由此可以推测, 本研究今后可以采用紫外诱变结合ARTP诱变选育抗氧化活性肽的发酵菌株, 可期待获得性能更优良的菌株。
本研究前期探索了发酵产物的不同多肽浓度对DPPH自由基的清除率, 对邻苯三酚自氧化的抑制率以及对亚油酸自氧化的抑制率, 结果发现多肽浓度与三者之间均存在较好的线性关系, 因此可以说明发酵产物为抗氧化活性肽。
4 结论
通过等离子体诱变, 得到了可以水解鲅鱼加工废弃蛋白的芽孢杆菌突变株, 利用该突变菌发酵得到的发酵液总抗氧化活性提高了12.4%, 具有较高的工业化应用潜力, 对鲅鱼加工废弃蛋白资源的充分利用和天然抗氧化剂的开发也具有一定的意义。由于传统诱变的方法的反复使用, 使得其作用于微生物时具备了一定的抗性。等离子体诱变技术作为一种新兴有效的诱变方法可以在一定程度上弥补传统方法的缺陷。研究结果也表明利用ARTP诱变技术能够取得较满意的结果。本研究后续还需要对突变株Hy-23进行分子水平的研究, 分析其发酵性能提高的内在原因。
[1] 李小芳, 冯小强, 孙长金, 等. 丁二酰化壳寡糖稀土配合物的抗氧化活性测定[J]. 海洋科学, 2015, 39(8): 47-50. Li Xiaofang, Feng Xiaoqiang, Sun Changjin, et al. Antioxidant activity of succinic-oligochitosan rare earth com-plexes[J]. Marine Sciences, 2015, 39(8): 47-50.
[2] 胡文婷, 张凯. 酶解海洋生物源蛋白制备活性肽研究进展[J]. 海洋科学, 2010, 34(5): 83-88. Hu Wenting, Zhang Kai. Progress in enzymatic preparation of bioactive peptides from marine proteins[J]. Marine Sciences, 2010, 34(5): 83-88.
[3] 姚继承, 王诚, 左正宏, 等.60Co-γ辐照对坛紫菜原生质体诱变的研究[J]. 海洋科学, 2005, 29(11): 48-51. Yao Jicheng, Wang Cheng, Zuo Zhenghong, et al. Mutagenesis on protoplast of Porphyra haitanensis by60Co-γ[J]. Marine Sciences, 2005, 29(11): 48-51.
[4] 沈小静, 张萍, 石彦鹏. 常压室温等离子体结合紫外诱变筛选红霉素高产菌株[J]. 中国兽药杂质, 2015, 49(1): 19-23. Shen Xiaojing, Zhang Ping, Shi Yanpeng. A mutant strain with high erythromycin yield obtained by using novel atmospheric and room temperature plasmas and UV mutation[J]. Chinese Journal of Veterinary Drug, 2015, 49(1): 19-23.
[5] Wang L Y, Huang A L, Li G, et al. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric-pressure glow discharges plasma[J]. Appl Microbiol, 2010, 108(3): 851-858.
[6] 邵千钧, 彭锦星, 徐群芳, 等. 竹制材料热解失重行为及其动力学研究[J]. 太阳能学报, 2006, 27(7): 671-676. Shao Qianjun, Peng Jinxing, Xu Qunfang, et al. Study on pyrolysis characteristics and kinetics of bamboo under liner heating temperature[J]. Acta Energiae Solaris Sinica, 2006, 27(7): 671-676.
[7] 张雪, 张晓菲, 王立言, 等. 常压室温等离子体生物诱变育种及其应用研究进展[J]. 化工学报, 2014, 65(7) : 2666-2684. Zhang Xue, Zhang Xiaofei, Wang Liyan, et al. Recent progress on atmospheric and room temperature plasmamutation breeding technology and its applications[J]. Ciesc Journal, 2014, 65(7) : 2666-2684.
[8] 吕玉珊, 齐树亭, 王晓宇, 等. 用于海水养殖水脱氮的反硝化细菌的诱变及筛选[J]. 海洋科学, 2011, 35(11): 35-40. Lü Yushan, Qi Shuting, Wang Xiaoyu, et al. Screening of efficient denitrobacteria induced by ultraviolet irradiation and lithium chloride[J]. Marine Sciences, 2011, 35(11): 35-40.
[9] 艾冰花, 李秉钧, 冯俊荣. 一株产蛋白酶芽孢杆菌紫外诱变育种的初步研究[J]. 渔业现代化, 2015, 42(4): 39-43. Ai Binghua, Li Bingjun, Feng Junrong. Preliminary study on the ultraviolet mutagenesis of a protease producing strain Bacillus amyloliquefacieus[J]. Fishery Modernization, 2015, 42(4): 39-43.
[10] 范新蕾, 肖成建, 顾秋亚, 等. ARTP诱变选育葡萄糖氧化酶高产菌株及发酵条件优化[J]. 工业微生物, 2015, 45(1): 15-19. Fan Xinlei, Xiao Chengjian, Gu Qiuya, et al. ARTP mutation breeding of glucose oxidase-producing strains and optimization of fermentation conditions[J]. Industrial Microbiology, 2015, 45(1): 15-19.
[11] 郭继平, 马莺. 紫外诱变选育米曲霉高产蛋白酶菌株[J]. 微生物学通报, 2007, 34(2): 246-250. Guo Jiping, Ma Ying. Breeding aspergillus oryzae strain with high protease activity by ultraviolet induced mutation[J]. Microbiology China, 2007, 34(2): 246-250.
[12] 牛春华, 高岩, 李玉秋, 等. 紫外诱变选育高产蛋白酶枯草芽孢杆菌[J]. 中国酿造, 2011, 12: 67-69. Niu Chunhua, Gao Yan, Li Yuqiu, et al. Selection of high protease-producing strain of Bacillus subtilis by UV mutation[J]. China Brewing, 2011, 12: 67-69.
[13] 司晓光, 郭刚, 王小霞, 等. 常压室温等离子体快速诱变选育丙酮酸高产菌株[J]. 食品工业科技, 2014, 35(20): 241-243, 256. Si Xiaoguang, Guo Gang, Wang Xiaoxia. et al. Rapid breeding of a high pyruvate production mutant by atmospheric room temperature plasma[J]. Science and Technology of Food Industry, 2014, 35(20): 241-243, 256.
[14] Sakanaka S, Tachibana Y. Active oxygen scavenging activity of egg- yolk protein hydrolysates and their effects on lipid oxidation in beef and tuna homogenates[J]. Food Chemistry, 2006, 85: 243-249.
[15] 柏中中, 孙家夺, 吴斌. 基于常压室温等离子体技术诱变选育D-乳酸高发酵速率菌株[J]. 食品工业科技, 2013, 34(24): 173-176. Bai Zhongzhong, Sun Jiaduo, Wu Bin. Mutation and selection of high fermentation rate of D-lactic acid producing strain by atmospheric and room temperature plasmas [J]. Science and Technology of Food Industry, 2013, 34(24): 173-176.
[16] Lu Y, Wang L, Ma K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma(ARTP)[J]. Biochemical Engineering Journal, 2011, 55(1): 17-22.
[17] 薛刚, 陈利娟, 吴斌, 等. ARTP诱变选育高温蛋白酶高产菌株及其酶学性质研究[J]. 食品工业科技, 2015, 36(1): 177-180, 206. Xue Gang, Chen Lijuan, Wu Bin. et al. Selection of high-yield thermostable protease producing strain by ARTP and the study on its enzymological properties[J]. Science and Technology of Food Industry, 2015, 36(1): 177-180, 206.
Received: Nov. 9, 2015
A mutant strain of Spanish mackerel antioxidant peptide fermentation obtained by atmospheric and room temperature plasma
AI Bing-hua1, AI Li-hua2, LI Bing-jun1, FENG Jun-rong1, HAN Gong-wen3, YU Ben-shu4
(1. School of Ocean, Yantai University, Yantai 264005, China; 2. School of Life Science, Yantai University, Yantai 264005, China; 3. Longkou Aquaculture Technology Extending Stations, Longkou 265700, China; 4. Shandong Hydrobios Resources Conservation and Management Center, Yantai 264003, China)
Atmospheric and room temperature plasmas(ARTP); protease; antioxidant activity; hereditary stability
The processed waste of Spanish mackerel is rich in proteins. Antioxidant active peptide preparation via microorganism fermentation can efficiently utilize these proteins and reduce the environmental pollution caused by S. mackerel processed waste. One strain of Bacillus Hy-2 was obtained using the processed waste of aquatic products as the substrate; this resulted in the production of protein hydrolysates with high antioxidant activity. The antioxidant activity of protein hydrolysates was further improved via mutation of the original strain of protease producing Bacillus Hy-2 using atmospheric and room temperature plasmas. A strain of Bacillus Hy-23 with a strong hereditary stability was screened from these mutants; this strain continued to allow a stable enzyme production even after eight generations. Using waste proteins obtained from S. mackerel production as the substrate and an inoculating mutant strain Hy-23, the fermentation process allowed the production of protein hydrolysates with a 12.4% increase in antioxidant activity.
Q933
A
1000-3096(2016)11-0028-06
10.11759//hykx 20151109002
(本文编辑: 谭雪静)
2015-11-09;
2016-02-26
山东省科技发展计划项目(2012GHY11515)
[Foundation: Science and Technology Development Projects of Shandong Province, No.2012GHY11515]
艾冰花(1990-), 女, 河南渑池人, 硕士, 主要从事水生生物学和微生物学研究, 电话: 13356903651, E-mail: 963007166@ qq.com; 李秉钧, 通信作者, 教授, E-mail: li6234307@163.com

