托芬那酸注射液在犬体内的生物等效性研究
李龙飞,李宇琛,吴天兴,夏良友,曹杰,王 双,卜仕金*
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
托芬那酸注射液在犬体内的生物等效性研究
李龙飞1,2,李宇琛1,2,吴天兴1,2,夏良友1,2,曹杰1,2,王 双1,2,卜仕金1,2*
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
为研究国产和进口托芬那酸注射液在犬体内的药代动力学和生物等效性,采用双处理、双周期随机交叉试验设计,将20头健康比格犬随机分成2组,按 0.1 mL/kg 体重肌肉分别单剂量注射受试制剂和参比制剂,采用高效液相色谱法测定血浆中托芬那酸的浓度,利用 WinNonlin6.3软件计算主要药动学参数,并评价两种制剂的生物等效性。结果显示,受试制剂和参比制剂的Tmax分别为(0.2±0.1)h和(0.3±0.2)h; Cmax分别为(5.12±1.55) μg/mL和(5.38±2.04) μg/mL;AUC0-t分别为(12.1±2.97) μg·h·mL-1和(12.28±3.24) μg·h·mL-1;AUC0-∞分别为(13.38±3.10)μg·h·mL-1和(13.85±3.40) μg·h·mL-1。托芬那酸注射液受试制剂和参比制剂的AUC0-t、AUC0-∞、Cmax、Tmax均无显著性差异(P>0.05)。双单侧t检验结果显示两种制剂生物等效,临床上可相互替代。该试验为兽医临床给药方案的制定以及合理用药提供参考。
托芬那酸注射液;药代动力学;生物等效性;高效液相色谱
托芬那酸是由丹麦GEA公司开发的一种应用广泛的非甾体抗炎药品(NSAID),具有较强的抗炎作用,副作用小[1]。目前,托芬那酸在国外已上市,主要用于治疗关节炎和偏头疼,也被广泛应用于痛风、滑囊炎和痛经等疾病的治疗。托芬那酸还可作为宠物药用于狗、猫缓解骨关节相关的炎症和疼痛,还可用于犬、牛等家畜上呼吸道疾病的辅助治疗。托芬那酸在动物机体内完全作为托芬那酸的甘氨酸及葡萄糖醛酸结合物形式通过尿液排泄(90%),没有严重的特异性的毒性反应[2],在兽医临床上具有非常广阔的市场前景。目前,对于托芬那酸血药浓度测定方法国内报道的很少。鉴于其药物作用范围广,毒性反应小,具有一定的应用价值。国内青岛农业大学现成功仿制了该产品,为此按照生物等效性试验相关规范要求,以犬为研究对象,按照农业部颁发的《兽药药物动力学试验规范(试行)》的试验要求,在建立一种简单、快速、准确的犬血浆中托芬那酸的含量的测定方法同时,通过对国产托芬那酸注射液在犬体内的药代动力学特征研究,并与国外原创托芬那酸注射液进行比较及生物等效性分析,以便为国产托芬那酸注射的研制提供重要参考依据。
1 材料
1.1 仪器 高效液相色谱仪:Agilent1260型高效液相色谱仪,Agilent公司;色谱柱:ZORBAX Eclipse Plus-C18(250×4.6mm,5μm),Agilent公司;UPH-11-20T型优普超纯水制造系统:成都超纯科技有限公司;RE-52旋转蒸发器:上海亚荣生化仪器厂;N-EVAPTM112型干浴氮吹仪:美Organo-mation公司;KS-250D超声仪:宁波科生仪器厂;WH-1微型漩涡混合仪:上海沪西分析仪器厂有限公司;TGL-16C型高速离心机:上海安亭科学仪器厂。WH-1微型漩涡混合仪:上海沪西分析仪器厂有限公司;TGL-16C型高速离心机:上海安亭科学仪器厂;可调微量移液器:1~10 μL、20~200 μL、100~1000 μL,热电(上海)仪器有限公司。指形管(5 mL及1.5 mL),扬子化工玻璃仪器有限公司。
1.2 药品与试剂 托芬那酸注射液受试品:规格为50 mL:2 g,生产批号:20141221,青岛农业大学提供,生产企业为施维雅(青岛)生物制药有限公司。托芬那酸注射液参比品:规格为30 mL:1.2 g,生产批号:6A1689D,有效期至2018年1月10日,生产商为法国威隆隆制药股份有限公司。托芬那酸标准品:含量100%,批号:BP 907-F67029,货号Y0000154,由青岛农业大学郝智慧教授馈赠。甲醇、乙腈,均为色谱纯,美国TEDIA公司;醋酸,醋酸钠,均为色谱纯,德国CNW公司;超纯水。
2 方法与结果
2.1 试验动物 20头1~2岁内的健康比格犬,平均体重为8.87±0.84 kg,公母各半。受试犬购自扬州四方实验动物科技有限公司,符合国家实验动物标准普通级实验动物微生物学、寄生虫学等等级要求,且在试验前1 d经兽医检查确认是处于良好的健康状况下,试验前1个月内未用过相关药物治疗。试验犬于实验前在新环境经过至少1周的适应期。给药前禁食过夜12 h,2 h后恢复正常饮食。饲料为不添加任何药物的全价饲料。
2.2 实验设计与给药方案 20头体重较一致的犬随机分为2组,每组犬公母各半,采用交叉实验设计。第一阶段1~10号犬单剂量(0.1 mL/kg bw)肌内注射托芬那酸受试品注射液,11~20号犬单剂量(0.1 mL/kg bw)肌内注射托芬那酸参比品注射液;第二阶段1~10号犬单剂量(0.1 mL/kg bw)肌内注射托芬那酸参比品注射液,11~20号犬单剂量(0.1mL/kg bw)肌内注射托芬那酸受试品注射液。两阶段给药间隔期为2周。
2.3 血样采集 犬站立保定后经前肢静脉采血。给药前采空白血,记为0 min。肌内注射给药后分别于5、10、15、30、45 min和1、2、3、4、8、12、24、36、48 h采血。每次采血量约4 mL。血样采集后置于用肝素浸润并烘干的离心管内,4500 r/min离心10 min,分离血浆后于-20 ℃保存备用。
2.4 色谱条件 色谱柱:ZORBAX Eclipse Plus C18(250×4.6 mm,5 μm);流动相为甲醇:乙腈:0.05 mol/L醋酸钠(pH 4.6)=36.5∶36.5∶27,流速1 mL/min;柱温35 ℃;进样量20 μL;紫外检测波长:λ=290 nm[3-4]。
2.5 方法学实验 对托芬那酸标准品进行精密度、回收率和稳定性试验,考察方法的合理性。
2.6 血浆样品处理 将冷冻保存的犬血浆室温下自然解冻,摇匀后精密移取200 μL血浆置于5 mL离心管中,加入2 mL乙腈去蛋白,混合涡旋3 min。超声10 min,4 ℃ 12000 r/min离心10 min,取上清于45 ℃氮气吹干。加入200 μL流动相溶解氮气吹干后残渣,混合涡旋3 min,12000 r/min离心10 min,取上清25 μL进样供HPLC分析。分别测出托芬那酸的峰面积。每批生物样品测定时建立新的标准曲线,并将每批生物样品测定结果(峰面积)采用新建立的标准曲线计算出托芬那酸的含量。每批生物样品测定时随行测定高、中、低三个浓度的质控样品。质控样品测定结果的偏差小于20%。
2.7 数据分析 将实测血药浓度-时间数据采用WINNONLIN 6.3药动学分析软件计算药代动力学
参数,药动学参数根据中国药科大学的杨劲老师编的《人体生物利用度数据处理通用程序,BAPP》软件进行生物等效性检验。釆用SPSS统计学软件对参数Cmax与AUC0-τ(已进行对数处理)进行多因素方差分析,对受试品和参比品进行生物学等效性比较。
2.8 方法学实验结果
2.8.1 标准曲线 托芬那酸的血浆药物浓度在0.05~10.0 μg/mL范围内,血浆药物浓度与峰面积比值呈良好的线性关系(R2=0.999)。以峰面积为横坐标,血药浓度为纵坐标,典型的标准曲线方程为:y=63.65x+0.6054(图1)。
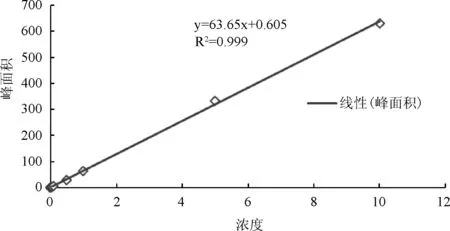
图1 托芬那酸标准曲线图
2.8.2 精密度和回收率 血浆中托芬那酸HPLC测定方法的结果表明,空白血浆添加样品在0.05~10.0 μg/mL范围内,批内和批间系数分别小于11%和6%,精密度良好;空白血浆中托芬那酸添加浓度在0.05、1和10 μg/mL时的回收率均在85%以上,回收率稳定(表1)。
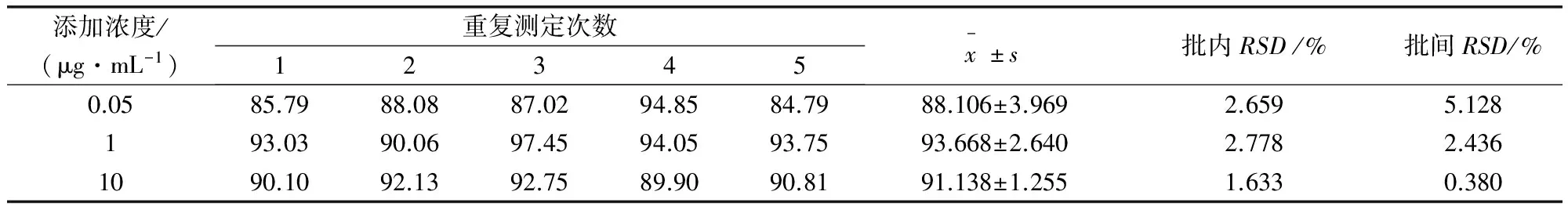
表1 血浆中空白添加托芬那酸相对回收率(%)(n=5)及精密度
注:SD-标准偏差,RSD-相对标准偏差,n-平行数
2.8.3 稳定性试验 对于犬血浆中的托芬那酸而言,于-20 ℃条件下冻存时能够保持稳定1个月,在3个冻融循环之后仍可保持稳定,于室温条件(约22 ℃)下储存时可保持稳定达4 h。2.9 犬单剂量肌内注射托芬那酸受试品与参比品的实测血药浓度及动力学特征 犬单剂量(0.1 mL/kg bw)肌内注射托芬那酸受试品和参比品注射液后,不同时间测得的受试品和参比品对应的平均血药浓度-时间曲线见图2。血药浓度时间数据采用WINNONLIN 6.3版药代参数计算软件进行非房室模型分析计算药动学参数,结果见表2。
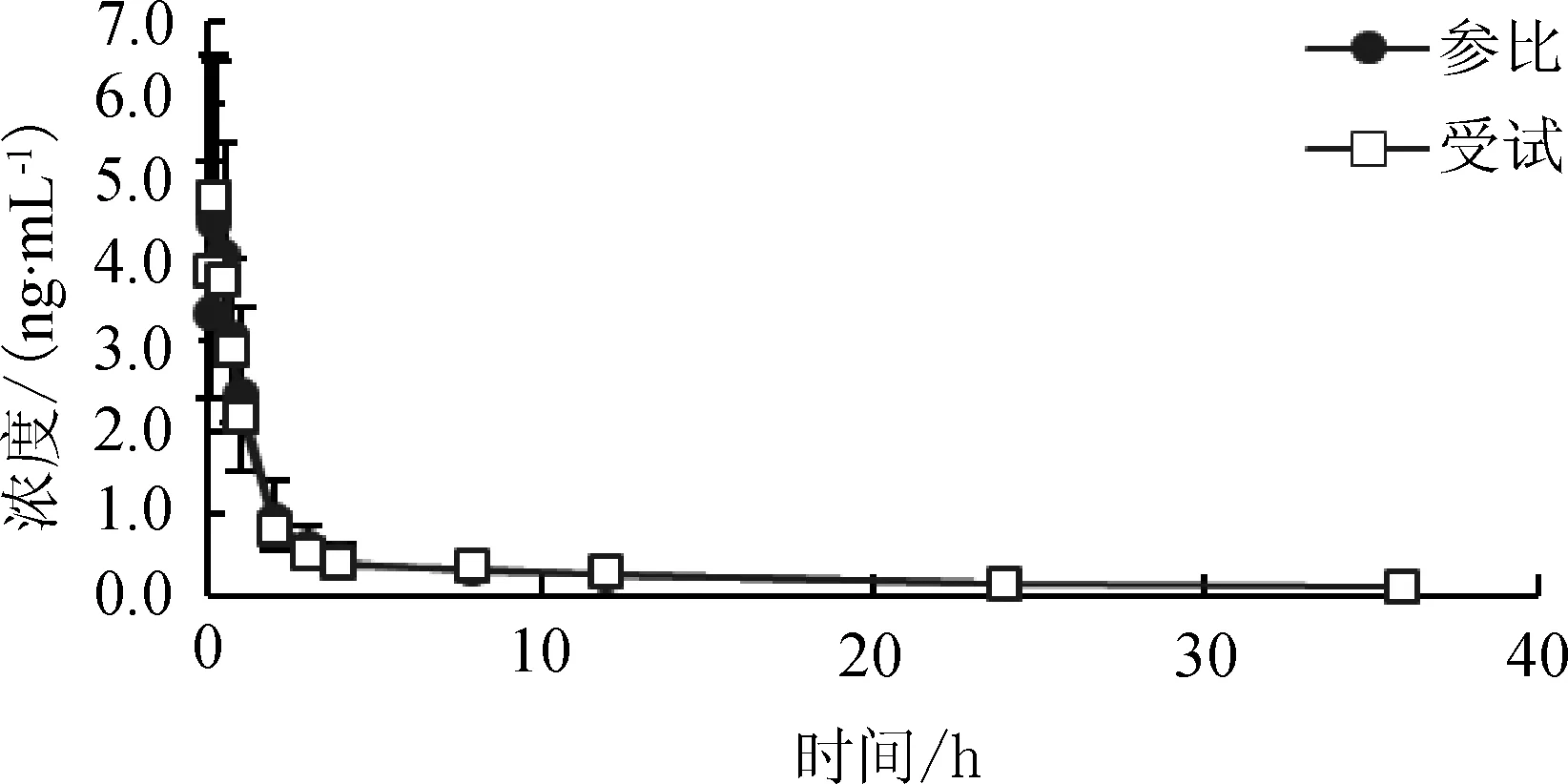
图2 犬单剂量肌内注射(4 mg/kg bw)托芬那酸受试品与参比品平均血药浓度-时间曲线图

参数受试品(x-±s)参比品(x-±s)Tmax(h)0.2±0.10.3±0.2Cmax(μg·h·mL-1)5.12±1.555.38±2.04T1/2(h)13.53±6.1914.52±5.75AUC0-τ(μg·h·mL-1)12.1±2.9712.28±3.24AUC0-∞(μg·h·mL-1)13.38±3.1013.85±3.40MRT(h)13.43±6.7613.58±6.31F101.7%±25.8%103.2±20.7%
T1/2为消除半衰期;Tmax为达峰时间;Cmax为峰浓度;AUC为药时曲线下面积;MRT为平均滞留时间;s为标准差
2.10 托芬那酸注射液受试品和参比品的生物等效性结果 采用中国药科大学的杨劲老师编的《人体生物利用度数据处理通用程序,BAPP》软件进行生物等效性检验。釆用SPSS统计学软件对参数Cmax与AUC0-τ(已进行对数处理)进行多因素方差分析,每个参数在产品间、周期间以及个体间的差异均不显著(P>0.05),无统计学意义;对达峰时间(未进行对数处理)应用非参数检验后,结果显示(表3)两组数据差异不显著(P>0.05),说明两种产品在犬体内的达峰时间存在生物等效。受试产品参数AUC0-τ的对数平均值和参比产品参数AUC0-τ的对数平均值的比值是99.4%,90%置信区间为90.12%~108.31%,介于参比产品80%~125%之间;受试产品参数Cmax的对数平均值和参比产品参数Cmax的对数平均值的比值是97.1%,90%置信区间为81.61%~115.34%,介于参比产品70%~143%之间。综上结果表明,国产托芬那酸注射液与法国威隆制药公司生产的托芬那酸注射液在犬体内存在生物等效。
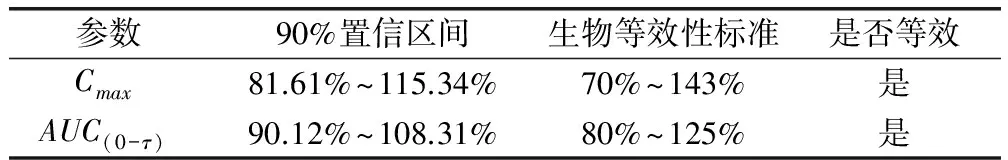
表3 犬单剂量注射托芬那酸注射液受试品与参比品生物等效性分析
3 讨论与小结
肌内注射受试产品和参比产品托芬那酸注射液后,受试产品与参比产品的主要药物动力学参数:药-时曲线下面积AUC0-τ、AUC0-∞、Cmax、Tmax数值接近,无显著性差异。符合生物等效的硬性要求。相对于参比品,受试产品的相对生物利用度F为(101.7±25.8)%。
釆用SPSS统计学软件对参数Cmax与AUC0-τ(已进行对数处理)进行多因素方差分析,每个参数在产品间、周期间以及个体间的差异均不显著(P>0.05),无统计学意义;(未进行对数处理)应用非参数检验后,结果显示两组数据差异不显著(P>0.05),说明两种产品在犬体内的达峰时间存在生物等效。依据制剂生物等效性评价标准[5]:供试制剂和参比制剂的AUC对数比值的90%可信限在80%~125%置信区内;供试制剂和参比制剂的Cmax对数比值的90%可信限在70%~143%置信区内;供试制剂和参比制剂的AUC、Cmax的双向单侧t检验均得到P<0.05的结果,t1≥t1-α(υ)与t2≥t1-α(υ)同时成立;Tmax经非参数法检验无差异,则供试品与参比制剂具有生物等效性。依据上述制剂生物等效性评价标准检验,表明受试品制剂和参比品制剂为生物等效制剂。
托芬那酸注射液因具有较好的解热镇痛、抗炎的临床效果[6],在国外被广泛用于治疗关节炎和偏头疼,并用于宠物犬、猫的骨关节相关的炎症和疼痛。目前,已有托芬那酸在狗、牛、羊、大鼠、犬、人体内的药代动力学研究报道[7-11]。在国内临床应用较少,并且相关文献报道较缺乏。国外相关研究报道[12],托芬那酸在犬体内的吸收较快,皮下注射4 mg/kg 2 h内达到平均最大血药浓度Cmax4 μg/mL(皮下注射)和3 μg/mL(肌肉注射)。本试验中,单剂量肌内注射(4 mg/kg bw)托芬那酸注射液参比品后,参比品的平均消除半衰期(t1/2)为(14.52±5.75)h,AUC为(12.28±3.24)μg·h/mL,Tmax为(0.3±0.2) h,Cmax为(5.38±2.04)μg/mL。单剂量肌内注射托芬那酸受试品后,平均t1/2为(13.53±6.20) h,AUC为(12.10±2.97)μg·h/mL,Tmax为(0.2±0.1) h,Cmax为(5.12±1.55) μg/mL,相对于参比品的平均相对生物利用度为(101.7±25.8)%。药动学研究结果表明,托芬那酸注射液肌内注射给药托芬那酸自注射部位吸收迅速,受试产品和参比产品15 min时均达到最大血药浓度;体内消除较缓慢,24 h均能检测到血液中的药物浓度,达到了长效的目的。
本次实验严格遵守药动学实验要求规范展开,根据生物等效性分析标准,采用常用的双单侧t检验和95%可信区间统计分析方法来评价和判断药物间的生物等效性;结果符合国内仿制药生物等效要求。通过对国产托芬那酸注射液肌内注射给药在犬的药动学特征研究,不仅对指导临床合理用药、新药评价、个体化给药及预测药物在犬体内的消除动态、蓄积特性和残留消除规律等具有重要的参考价值;同时药动学研究成果还可用于指导优选给药方案、新药设计、改进药物剂型,对提供高效、长效、低毒、低副作用的药物制剂具有重要指导意义;为国产托芬那酸注射液的研制以及上市提供重要参考依据。
[1] Anthony P, Kristin M, Scott B. Evaluation of selective inhibition of canine cyclooxygenase 1 and 2 by carprofen and other nonste roidal anti-inflammatory drugs[J]. AJVR, 1998,59(11):1441-1446.
[2] 付海宁,王巧玲,殷生章. 托芬那酸的药理毒理研究[J]. 中国兽药杂志,2010,44(8):52-56.
[3] Yun PyoKang,JinYu,Yoonyoung Huh,etal. Development of high performance liquid chromatography‐ultraviolet detection method for screening mebendazole, clorsulon, diaveridine, and tolfenamic acid in animal‐based food samples[J]. Drug Test. Analysis,2014,6(3):246-256.
[4] 李龙飞,李宇琛,吴天兴,等. 犬血浆中托芬那酸高效液相色谱检测法的建立[J]. 中国兽药杂志,2016,50(6):52-55.
[5] 梁文全. 生物药剂学与药物动力学[M]. 北京:人民卫生出版社,2006.
[6] 李忠生,冯秀娟,王智群. 托芬那酸肌注后在犬体内的药物代谢动力学研究[J]. 畜牧与兽医,2016,2:67-70.
[7] J Stenderup,JEriksen,SBols PedersenL,etal. Pharmacokinetics of tolfenamic acid in patients with cirrhosis of the liver[J]. European Journal of Clinical Pharmacology,1985,28:573-579.
[8] Kruszewska, H, Zareba, T, Tyski, S. Search of antimicrobial activity of selected non-antibiotic drugs[J]. Acta Poloniae Pharmaceutica, 2002, 59: 436-439.
[9] Landonib M. F, Cunningham F. M, Lees P. Pharmacokinetics and pharmacodynamics of tolfenamic acid in calves[J]. Research in Veterinary Science, 1996, 61: 26-32.
[10]Jaussaud P, Guieu D, Bellon C,etal. Pharmacokinetics of tolfenamic acid in the horse[J]. Equine Vet J Suppl, 1992, 11: 69-72.
[11]Sidhu P K, Landoni M F,Lees P. pharmacokinetics and pharmacodynamics interactions of tolfenamic acid and marbofloxacin in goats[J]. Research in Veterinary Science, 2006, 80:79-90.
[12]datasheet. Tolfedine 4% w/v Solution for injection for dogs and cats, App. No: 00604/2008 CRN 7004895, November 2009, Vm 08007/4048 VPA 10983/19/1.
(编辑:侯向辉)
Bioequivalence of Tolfenamic Acid Injection in Dogs
LI Long-fei1,2,LI Yu-chen1,2,WU Tian-xing1,2,XIA Liang-you1,2,CAO Jie1,2,WANG Shuang1,2,BU Shi-jin1,2*
(1.VeterinaryMedicineCollege,YangzhouUnivercity,Yangzhou,Jiangsu225009,China;2.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,Yangzhou,Jiangsu225009,China)
To evaluate the pharmacokinetics and bioequivalence of tolfenamic acid injection in dogs,in arandomized two-way self-crossover study, 20 healthy dogs were randomly divided into two groups, and were given respectively a single dose of test or reference preparations by intramuscular injection(0.1mL/kg). Plasma concentrations of tolfenamic acid were measured by HPLC. The pharmacokinetic parameters were calculated by WinNonlin6.3 software, and the bioequivalence were evaluated. The main pharmacokinetic parameters of the test and reference preparations were asfollows: Tmaxwere(0.2±0.1) h, (0.3±0.2) h; Cmaxwere (5.12±1.55) μg/mL, (5.38±2.04) μg/mL;AUC0-twere(12.1±2.97) μg·h·mL-1,(12.28±3.24) μg·h·mL-1; AUC0-∞were (13.38±3.10)μg·h·mL-1, (13.85±3.40) μg·h·mL-1. The pharmacokinetic parameters (AUC0-t, AUC0-∞, Cmax, Tmax) showed no significant difference between test and reference preparations of tolfenamic acid suspension injections(P>0.05). The test and reference formulations are bioequivalent after two one-sidet-test. Two kinds of injection can replace each otherclinically.This study will provide theoretical basis formaking of veterinary clinical dosage regimen and clinical rational administration.
tolfenamic acid injection; pharmacokinetic;bioequivalence;HPLC
1.江苏高校优势学科建设工程资助项目(PAPD);2.扬州大学"新世纪人才工程"资助
李龙飞,硕士研究生,从事兽医药理,药物代谢与药物残留分析研究。
卜仕金。E-mail:pushijin@aliyun.com
2016-07-11
A
1002-1280 (2016) 08-0053-05
S859.796

