猪肺炎支原体DJ-166株的分离鉴定
车艳杰,于霏,高玉梅,王贵华
(北京大北农科技集团股份有限公司动物医学研究中心,北京100195)
猪肺炎支原体DJ-166株的分离鉴定
车艳杰,于霏,高玉梅,王贵华*
(北京大北农科技集团股份有限公司动物医学研究中心,北京100195)
从山西某猪场采集疑似猪支原体肺炎肺组织病料,接种CH培养基培养,克隆纯化获得一株菌株。该菌株经PCR、培养特性、生化特性和血清学特性试验鉴定为猪肺炎支原体,命名为DJ-166株。该分离菌株在人工合成培养基上传8代稳定后,活菌计数达到108CCU/mL;菌液培养物气管注射猪后,致病性较弱;免疫原性试验证明该分离菌株具有良好的免疫原性,此结论为猪支原体肺炎疫苗的研究提供了必要条件。
猪肺炎支原体;分离鉴定
猪支原体肺炎(Mycoplasmalhyopneumoniaeof swine MPS),又称猪地方流行性肺炎(Swine enzootic pneumonia),俗称猪喘气病[1]。猪支原体肺炎是猪呼吸道疾病综合征的重要病原之一[2],可继发感染PRRSV、PCV2等,从而导致多种疫苗接种失败[3-4]。由于猪肺炎支原体生长要求苛刻,营养要求高,不易分离;在分离过程中还易受猪鼻支原体的影响,给本病的研究工作带来了困难。本试验从山西某猪场中疑似猪肺炎支原体感染的病猪肺脏中成功分离获得一株猪肺炎支原体,以期为猪支原体肺炎的研究提供必要条件和有利数据。
1 材料
1.1 病料来源 2008年山西某猪场出现咳嗽、气喘和腹式呼吸猪支原体肺炎临床症状的猪,采集肺脏组织后,经PCR检测猪肺炎支原体阳性。
1.2 培养基 CH液体培养基和固体培养基,批号为CH01,北京大北农科技集团股份有限公司制备。
1.3 试验动物 2周龄福建黑猪,购自福建莆田黑猪保种场,母猪未注射猪支原体肺炎疫苗,仔猪猪肺炎支原体抗原、抗体阴性,猪圆环病毒(PCV2)、猪繁殖与呼吸障碍综合征病毒(PRRSV)抗原阴性。
1.4 检验用强毒 猪肺炎支原体强毒HB株,批号为DG01,北京大北农科技集团股份有限公司制备。
1.5 猪肺炎支原体阳性血清 本实验室从ATCC引进的猪肺炎支原体27714株制备兔抗猪肺炎支原体特异性血清,琼扩效价为1∶32,批号为080501。
1.6 猪鼻支原体阳性血清 从中国兽医药品监察所菌种保藏中心购进的猪鼻支原体BTS-7株制备兔抗猪鼻支原体特异性血清,琼扩效价为1∶16,批号为080704。
2 方法
2.1 猪肺炎支原体分离、传代 将疑似猪肺炎支原体的病肺组织剪成颗粒型,接入含50%猪鼻支原体特异性血清、800 IU/mL青霉素和0.001%醋酸铊的CH培养基中,每管放入10粒,37 ℃培养。每间隔6 d盲传1次,每天观察培养基pH值变化,前3代均加入50%猪鼻支原体特异性血清。
2.2 猪肺炎支原体克隆纯化 将菌液培养物接种CH培养基,置37 ℃培养,当培养基颜色发生改变,pH值为6.8左右时,收获培养物,将培养物进行10倍系列稀释,取10-3、10-4和10-53个稀释度中各取出0.1 mL接种CH固体培养基平板上,涂匀后置37 ℃ 5%CO2环境下培养10 d,观察菌落形态,并在显微镜下挑取外周质地疏松、中央致密、边缘整齐的单个菌落,接种CH液体培养基。按以上方法对分离株连续重复克隆3次。
2.3 PCR鉴定
2.3.1 PCR鉴定及测序 根据DB32/T1461-2009中猪肺炎支原体P36基因引物序列,合成两条引物,引物序列为P1: 5’-TTACAGCGGGAAGACC-3’;P2:5’- CGGCGAGAAACTGGATA-3’;预计扩增片段长度约为427 bp。将分离菌株按江苏省地方标准[5]方法提取基因组DNA,进行PCR鉴定和测序。
2.3.2 多重PCR鉴定 猪肺炎支原体多重PCR引物序列为mhp-f:5’-TTCAAAGGAGCCTTCAAGCTTC-3’;mhr-f:5’-GGGAAGAAAAAAATTAGGTAGGG-3’;mfl-f:5’-CGGGATGTAGCAATACATTCAG-3’;m-r:5’-AGAGGCATGATGATTTGACGTC-3’;预计猪肺炎支原体扩增片段长度约为1000 bp;猪鼻支原体扩增片段长度约为1129 bp,猪絮状支原体扩增片段长度约为754 bp。将分离菌株按文献[6]方法提取基因组DNA,进行多重PCR鉴定。
2.4 培养特性鉴定 参考文献[7]将分离株培养物接种含800 IU/mL青霉素和0.001%醋酸铊的CH培养基,37 ℃培养5~7 d,观察菌液浊度及有无菌膜产生;将培养物进行10倍系列稀释,取10-3、10-4和10-53个稀释度,每个稀释度分别取0.1 mL滴入CH固体培养基平板上,涂匀后置37 ℃ 5% CO2环境下培养10 d,显微镜下观察菌落形态。
2.5 生化特性鉴定
2.5.1 水解精氨酸试验 将分离株(DJ-166株)培养物接种于含0.5%精氨酸及酚红指示剂的液体培养基中,37 ℃培养,观察培养基颜色是否发生改变。
2.5.2 葡萄糖发酵试验 将分离株(DJ-166株)培养物接种于含0.5%葡萄糖培养基(含酚红指示剂)中,观察pH值变化。
2.5.3 红细胞吸附试验 取0.5%豚鼠红细胞悬液,加入有分离株(DJ-166株)菌落生长的平板上,37 ℃培养30 min,去掉多余的红细胞液,用PBS缓冲液洗涤,显微镜下观察红细胞吸附情况。
2.6 血清学特性鉴定
2.6.1 代谢抑制试验 参考文献[8]取不含血清的CH培养基,按20%比例加入兔抗猪肺炎支原体高免血清,按10%比例接种分离菌株,37 ℃培养10 d进行代谢抑制试验,鉴定分离菌株是否为猪肺炎支原体。2.6.2 生长抑制试验 参考文献[9]将分离株猪肺炎支原体菌液稀释至10-3,接种猪肺炎支原体固体平板,无菌夹取抗猪肺炎支原体血清纸片贴附于平板表面,37℃、5%CO2环境下培养10 d,进行生长抑制试验。同时设猪肺炎支原体27714株为对照。抑制带达到1 mm以上时,判为猪肺炎支原体阳性[10]。2.6.3 菌落免疫荧光试验 将分离株稀释至10-4,接种猪肺炎支原体固体平板,37 ℃、5%CO2环境培养10 d,显微镜下选取典型菌落固定在玻片上,室温干燥,滴加抗猪肺炎支原体血清,覆盖已知菌落玻片,37 ℃孵育30 min,冲洗玻片后干燥,滴加FITC标记的山羊抗兔IgG,37 ℃孵育60 min,冲洗玻片,干燥后滴加甘油,盖上盖玻片,置荧光显微镜下观察菌落荧光。同时设猪鼻支原体为对照。
2.7 致病性试验 将分离株(DJ-166株)培养物气管注射4周龄健康易感猪4头,10 mL/头,同时设对照猪4头,同条件下隔离饲养,饲料中无抗生素。接种后28 d,试验组和对照组猪全部剖杀,根据28分评分法对肺部病变进行打分[11]。
2.8 免疫原性试验 将分离株(DJ-166株)培养物灭活、浓缩纯化后与佐剂混合后制备灭活疫苗,接种2周龄猪支原体肺炎血清抗原抗体阴性的福建黑猪各4头,每头2.0 mL,并设攻毒对照4头。免疫后28 d,免疫组连同条件相同的对照猪各气管注射猪肺炎支原体HB株强毒10 mL,各组猪隔离饲养观察28 d剖杀,按28分评分法对肺部病变打分,计算肺炎病变减少率。
3 结果与分析
3.1 猪肺炎支原体分离、传代 将疑似猪肺炎支原体的病肺组织接种CH液体培养基,连续盲传5代,在传至第5代时,培养基颜色发生改变,pH值由7.6降至7.0,在传至8代后,培养基颜色变化时间稳定,pH规律性下降,生长时间稳定在5~7 d,活菌滴度可达108CCU/mL。3.2 猪肺炎支原体克隆纯化 分离株在固体培养基上可见针尖大小透明菌落,菌落形态多为规则,部分菌落偏小,有些菌落边缘不整齐。在显微镜下挑选质地疏松、中间致密、边缘整齐的圆形中等菌落进行3次克隆纯化获得菌株,命名DJ-166株。
3.3 猪肺炎支原体鉴定
3.3.1 PCR、多重PCR鉴定 结果见图1、图2,同源性分析结果见表1。
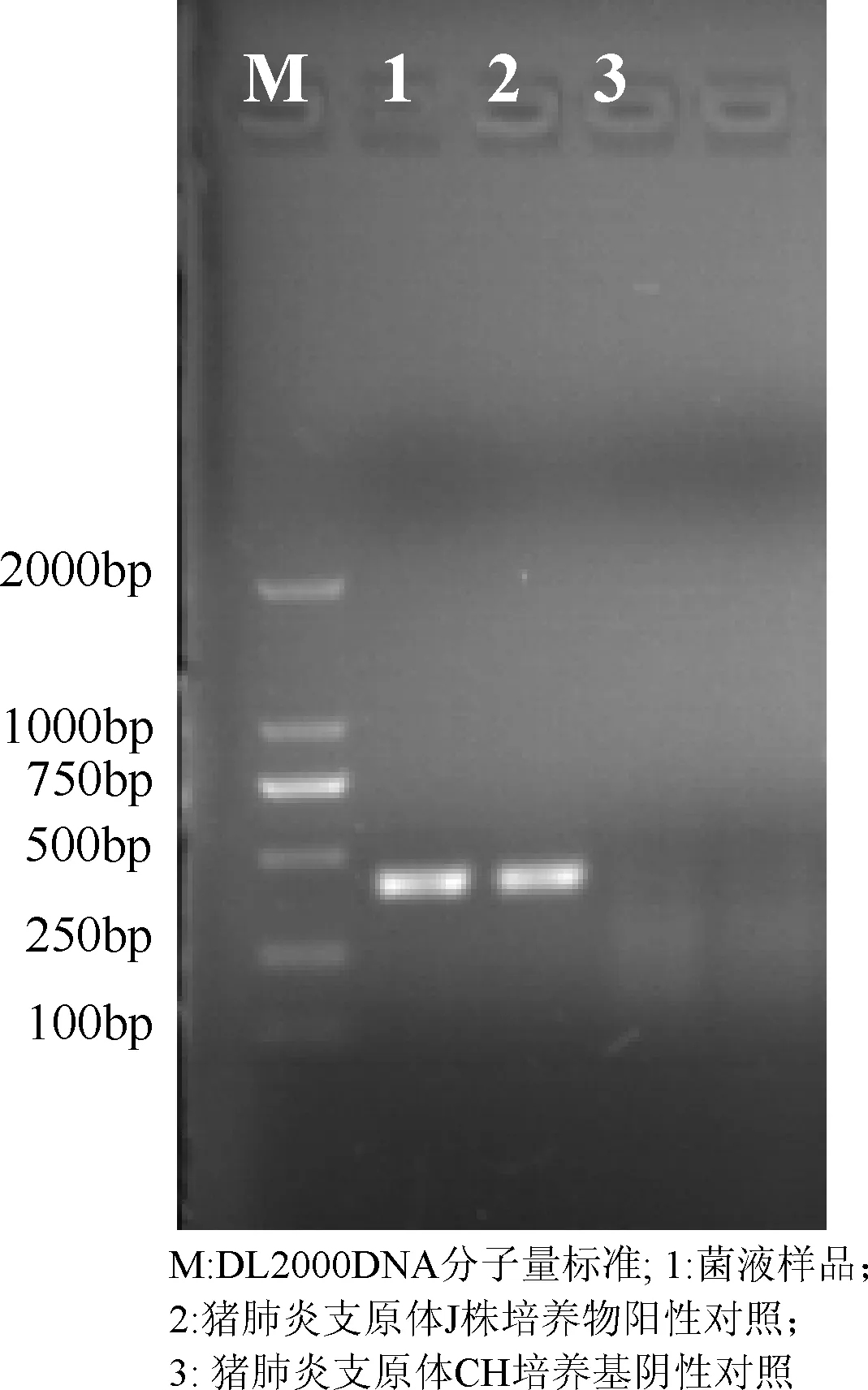
图1 分离株(DJ-166株)PCR扩增结果
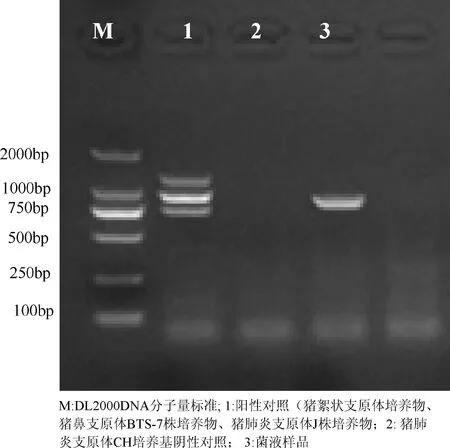
图2 分离株(DJ-166株)多重PCR扩增结果
从图1~图2和表1结果可见,培养物经过PCR扩增出长度约为427 bp的猪肺炎支原体目的片段;多重PCR扩增出长度约1000 bp的猪肺炎支原体目的片段,未检测出猪鼻支原体和猪絮状支原体目的片段,证明分离的菌株为猪肺炎支原体,无猪鼻支原体和猪絮状支原体污染。测序结果通过NCBI BLAST比对,分离株P36基因序列与猪肺炎支原体J株、232株、7448株和168株同源性分别达99%以上,从分子水平上证明了分离的菌株为猪肺炎支原体。
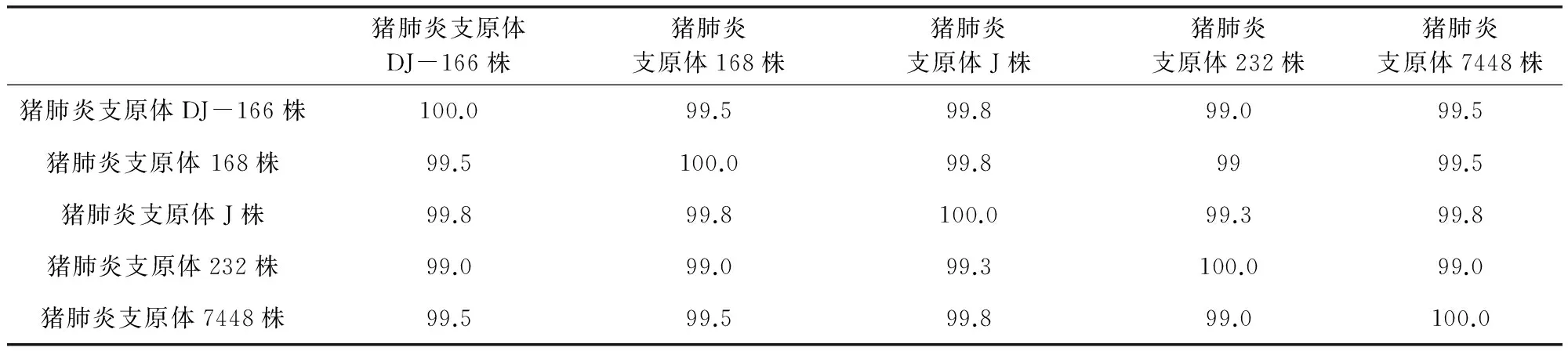
表1 分离的猪肺炎支原体DJ-166株同源性分析结果表
3.3.2 培养特性及形态学鉴定 分离株(DJ-166株)在液体培养基中生长,菌液轻度混浊,不形成菌膜;固体培养基上生长7~10 d,眼观可见针尖大小菌落,显微镜下观察为“煎蛋状”,中间致密、外周质地疏松。在接种培养基中加入青霉素和醋酸铊后,对菌液生长均无抑制,符合支原体特性。
3.3.3 生化特性鉴定 分离株(DJ-166株)不水解精氨酸;分解葡萄糖;菌落表面无红细胞吸附,呈阴性反应。符合猪肺炎支原体生化特性。
3.3.4 生长抑制试验 分离株(DJ-166株)在固体培养基上生长出细小透明菌落,且均能被猪肺炎支原体特异性血清所抑制,抑菌圈为3.2 mm;猪肺炎支原体27714株阳性对照血清抑菌圈为3.0 mm;阴性对照未出现抑菌圈;证明分离的菌株为猪肺炎支原体。
3.3.5 代谢抑制试验 猪肺炎支原体分离株(DJ-166株)接种含抗猪肺炎支原体血清的培养基,培养10 d,pH值无变化;猪肺炎支原体阴性对照的培养基颜色变黄,pH值由7.81下降至6.84,证明分离的菌株为猪肺炎支原体。
3.3.6 菌落免疫荧光试验 分离株(DJ-166株)经菌落免疫荧光试验呈阳性反应,可观察到清晰的菌落轮廓,荧光很强,呈黄绿色;猪鼻支原体菌落无可见荧光,呈阴性反应。证明分离的菌株为猪肺炎支原体。
3.4 致病性试验 猪肺炎支原体培养物气管注射4周龄健康易感猪,接种后28 d剖杀,结果见表2。

表2 分离株(DJ-166株)致病性试验结果表
由表2结果可见,分离株(DJ-166株)培养物接种试验猪,接种后18 d和21 d有2头出现轻微咳嗽,28 d剖杀可见肺部出现轻度病变,病变评分在1~3分之间,肺部病变平均评分1.75,说明分离株(DJ-166株)在培养基上传代后致病性较弱。
3.5 免疫原性试验 分离株(DJ-166株)培养物制备疫苗免疫健康易感猪后28 d攻毒,攻毒后28 d剖杀结果见表3。

表3 猪肺炎支原体DJ-166株免疫原性试验结果
由表3结果可见,分离株(DJ-166株)制备疫苗免疫猪后攻毒,攻毒对照组在攻毒后15 d相继出现咳嗽和气喘等猪肺炎支原体临床症状;28 d后剖检,免疫组平均肺炎病变减少76.9%。
4 讨论与小结
Mhp在猪群多呈慢性或隐性感染,可在猪呼吸道中长期存在[12]。由于猪肺炎支原体对培养基的营养要求非常苛刻,在一般的培养基中很难生长,特别是从猪体内进行支原体的分离更是非常困难[7]。本研究采用培养基连续传8代,经过3次克隆纯化获得一株肺炎支原体。按(DB32/T1461-2009)P36基因序列对分离株进行核苷酸序列测定,与国际标准株232株、J株、7448株同源性在99.0%~99.8%之间,与国内168株同源性99.5%。测序结果表明,试验成功分离出1株猪肺炎支原体菌株,命名为DJ-166株。
本试验分离的猪肺炎支原体DJ-166株经培养特性和生化鉴定,均符合猪肺炎支原体特性;生长抑制和代谢抑制试验结果表明,菌落和菌液均能被抗猪肺炎支原体血清抑制;菌落免疫荧光试验可观察到清晰的菌落轮廓,荧光很强,呈黄绿色,进一步表明分离菌株为猪肺炎支原体;在致病性试验中,个别猪在感染后20 d出现轻微咳嗽,剖杀可见肺部出现轻度猪肺炎支原体病变,说明菌株在培养基上传代后毒力减弱;在免疫原性试验中,采用分离的菌株制备灭活疫苗免疫猪,平均肺炎病变减少76.9%。分离获得具有较好免疫原性的菌株将对开展猪支原体肺炎疫苗的研究工作具有重要意义。
[1] 李彦明,张映.猪肺炎支原体生物学研究进展[J].动物医学进展,2003,24(3):25-27.
[2] 王华,张清,王君伟,等.猪支原体肺炎流行病学和诊断技术研究进展[J].动物医学研究进展,2009,30(9):73-77.
[3] 金升藻.猪支原体肺炎的诊断与综合防治[J].上海畜牧兽医通讯,2008,(6):33-35.
[4] 刘青海,车秀华,孙洪升.猪肺炎支原体的研究进展[J].畜牧兽医科技信息,2005,(6):12-13.
[5] DB32/T1461-2009.猪肺炎支原体检测PCR法[S].
[6] T.Stakenborg, J.Vicca, P.Butaye,etal. A Multiplex PCR to Identify PorcineMycoplasmasPren-sent in Broth Cultures[J]. Veterinary Research Communications,2006,30:239-247.
[7] 吴移谋,叶元康.支原体学(第2版) [M].北京:人民卫生出版社, 2008: 203-208.
[8] 刘茂军,邵国青,周勇岐,等.一株猪肺炎支原体强毒株的分离和鉴定[J].江苏农业学报,2009,25(2):308-310.
[9] Clyde W.A.Jr (1983). Growth inhibition tests. In: Methods in Mycoplasmology, Vol. 1, Razin S. & Tully J.G, eds. Academic Press, New York, USAand London, UK, 405-410.
[10]曹澍泽.兽医微生物学及免疫学技术[M].北京:北京农业大学出版社,1992:49-50.
[11]邵国青,刘茂军,孙佩元,等.猪气喘病人工发病模型的建立[J].微生物与感染, 2007, 2(4): 215-218.
[12]Eduardo F, Pijoan C,Scott D.Dynamies and persistence ofMycoplasmahyopneumoniaeinfection in pigs[J].Can J Vet Res,2005,69(3):223.
(编辑:侯向辉)
Isolation and Identification of Mycoplasma hyopneumoniae DJ-166 Strain
CHE Yan-jie,YU Fei,GAO Yu-mei,WANG Gui-hua*
(DabeinongGroupResearchCenterforAnimalMedicine,Beijing100195,China)
A suspected pig pneumonia pathological tissue was collected from a swine farm of Shanxi province, from which a strain was cloned and purified by CH medium culture. The strain was further identified to beMycoplasmahyopneumoniaeby PCR, multiple PCR, biochemical character and serological specificity experiment, then named after DJ-166 strain. After 8 generation stable culture on artificial synthetic medium, viable count reached 108CCU/mL. The culture showed weak pathogenicity when being injected into the swine by weasand. Immunogenicity test showed that the strains had good immunogenicity, and provided the necessary condition forMycoplasmalpneumoniavaccine research.
Mycoplasmahyopneumoniae; isolation and identification
车艳杰,从事兽用生物制品研发。
王贵华。E-mail:Wang gh@im.ac.cn
2015-11-16
A
1002-1280 (2016) 03-0006-05
S852.62

