安普霉素的研究进展
戴青,于丽娜,张璐,韩宁宁,徐嫄,赵晖
(中国兽医药品监察所,北京 100081)
安普霉素的研究进展
戴青,于丽娜,张璐,韩宁宁,徐嫄,赵晖*
(中国兽医药品监察所,北京 100081)
就安普霉素合成途径、抗菌活性、含量测定方法和临床应用等方面的研究进展进行了综述,以期为安普霉素的研究和开发提供参考。
安普霉素;合成途径;抗菌活性;含量测定;临床应用
安普霉素,又名阿普拉霉素,是由美国开发成功的一种新兽用抗生素,主要以硫酸安普霉素的形式应用于临床,其抗菌谱广,能防治猪大肠杆菌病以及其他敏感菌所致疾病,对鸡大肠杆菌、沙门氏菌及部分支原体感染也有效,是美国FDA推荐治疗大肠杆菌病的首选药物。安普霉素作为一种药物型饲料添加剂,可以增加畜禽体重和饲料转化率,促进生长发育,因而广泛应用于畜牧和养殖业。本文对安普霉素合成途径、抗菌活性、含量测定方法和临床应用等方面进行了综述,以期为安普霉素在我国深入开展相关研究与应用提供参考资料。
1 安普霉素的合成及代谢
安普霉素是黑暗链霉菌产生的多组分氨基糖苷类抗生素尼拉霉素复合物的一个组分[1-3],分子式为C21H41N5O11,结构见图1。安普霉素结构新颖,因其分子中含有一个稀有的辛二糖结构单元而异于其他氨基糖苷类抗生素,研究其生物合成途径,对增加安普霉素的产量以及开发含有辛二糖结构的新抗生素具有一定参考价值。
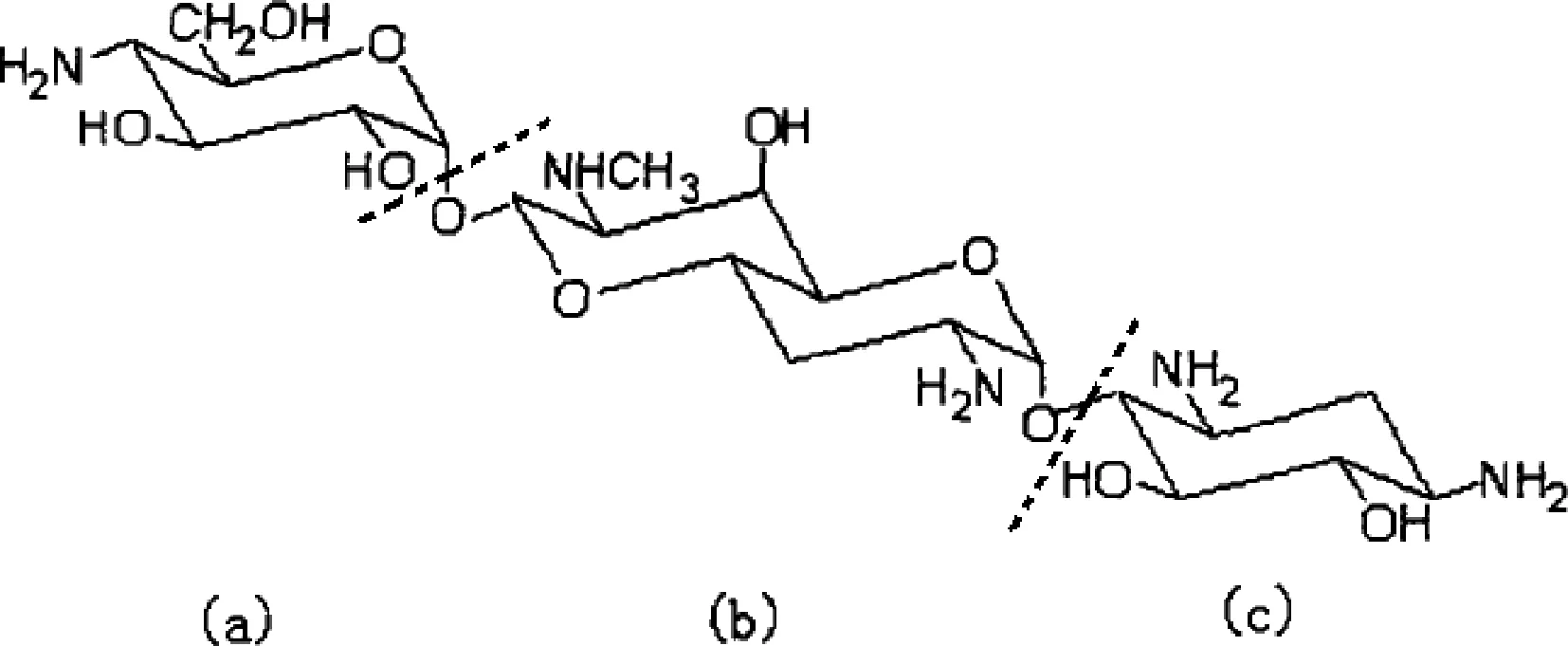
(a)4-氨基-4-脱氧-α-吡喃型葡萄糖;(b)辛二糖胺;(c)2-脱氧链霉胺图1 安普霉素的结构
李相丰等[4]用阻断变株将氨基葡萄糖、二脱氧链霉胺、巴龙霉胺、安普霉胺、八碳糖胺等前体物质进行了生物转化实验,推断得到安普霉素可能的生物合成途径:葡萄糖首先合成2-DOS、2-氨基葡萄糖,二者连接生成巴龙霉胺,巴龙霉胺经环合后生成安普霉胺,安普霉胺再与4-氨基-4-脱氧葡萄糖连接,最终生成了安普霉素。许铭翾等[5]向发酵培养基中添加不同的氨基酸以探究对安普霉素产量的影响,发现添加甘氨酸对其产量的促进作用明显,并进一步证实甘氨酸是安普霉素生物合成中的甲基供体,它供应了安普霉素中唯一的取代甲基—辛二糖环上C7’-N的甲基。
安普霉素结构中因包含多个氨基和羟基而表现出较强的极性,肌注或静注安普霉素后,血清蛋白结合率低,生物利用度高,代谢快,大多以原形的形式从肾脏排出,饮水给药主要以高浓度在肠道中发挥作用,大部分从粪便排出,而口服给药不易吸收,这可能与氨基糖苷类抗生素较难透过动物肠道壁有关。
胡振英等[6]给猪静注、肌注硫酸安普霉素以探究其体内过程和药代动力学,发现以剂量20 mg/kg
静脉注射后,猪血清中分布相半衰期为0.75 h,消除半衰期为3.2 h,体内药物运转符合二室开放模型,肌肉注射后达峰时间为0.856 h,,绝对生物利用度为88.8%;尚若峰等[7]以剂量20 mg/kg给猪口服硫酸安普霉素,试验测得达峰时间为5.12 h,消除半衰期为7.36 h,生物利用度为3.19%,给药后体内药物运转适合一室开放模型。表明硫酸安普霉素在猪体内能快速达到有效杀菌浓度,静脉注射后能较快分布于体内,消除较慢,肌肉注射易于被机体吸收利用,而口服给药吸收利用较低。考察安普霉素在畜禽体内的残留代谢规律,可以为制定休药期提供依据,并有助于临床安全合理用药。
2 安普霉素的抗菌活性
作为氨基糖苷类药物,安普霉素可阻碍原核生物核蛋白质合成,抑制有害菌在畜禽体内生长。安普霉素抗菌谱广,对多种革兰氏阴性菌特别是大肠杆菌和沙门氏菌有强大的抗菌作用,对革兰氏阳性菌和某些支原体也能表现出较强的抗菌作用。安普霉素体外抗菌活性见表1[8]。由表1可以看出,安普霉素对金葡菌和八叠球菌的最小抑菌浓度(MIC)值较低,对白色念珠菌的MIC值较高。
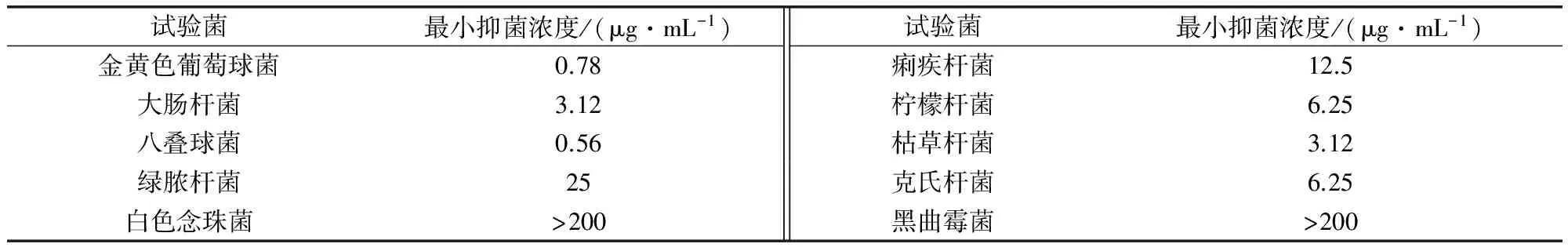
表1 安普霉素的体外抗菌活性
抗生素后效应(PAE)是评价抗菌药物活性的重要指标之一,PAE时间越长,其抗菌活性越强。孙志武等[9]考察了硫酸安普霉素对嗜水气单胞菌的体外抑菌效果,发现其MIC和MBC分别为0.5 μg/mL和1 μg/mL,抑菌效果在嗜水气单胞菌的调整期表现尤为明显,是静止期杀菌药物,PAE较长,具有明显的浓度依赖性,且不产生耐药性,这可能是由于安普霉素以高浓度在肠道中发挥作用,可影响病原菌的黏附能力,抑制主要致病因子的分泌[10],从而增强了机体抗感染的能力。黄宝明等[11]分别用2×MIC、4×MIC和8×MIC浓度的安普霉素作用于大肠杆菌,发现安普霉素体外PAE分别为1.15 h、2.04 h和3.27 h,体内PAE分别为3.46 h、4.49 h和5.77 h,实验证明其在体内、外对大肠杆菌均有较长的PAE,且随药物浓度增加PAE相应延长,呈剂量依赖性。
研究安普霉素的抗菌活性,对优化给药方案以及降低药物毒副作用也具有重要意义。β-内酰胺类药物对革兰氏阴性杆菌的PAE较短,且长时间单用一种药物易使细菌产生耐药性,王新等[12]采取安普霉素与氨苄西林、阿莫西林联合用药的方式,测定其对沙门氏菌、金葡菌及大肠杆菌的体内、外PAE,实验证明安普霉素与氨苄西林或阿莫西林联用对三种细菌体内、外PAE呈现相加或协同作用,临床上治疗大肠杆菌引起的感染时,采用安普霉素与β-内酰胺类药物联用的给药方案,可获得良好的治疗效果。
3 安普霉素的含量测定方法
3.1 抗生素微生物检定法 国际上采用管碟法和浊度法来测抗生素效价,而在国内,浊度法应用较少,多用管碟法测定。《中国兽药典》从2005年版开始正式收载浊度法,推进了此法在抗生素效价测定方面的应用。
鲁马媚等[13]用微生物浊度法检测安普霉素及制剂的含量,结果显示安普霉素浓度在3.6~6.0单位/mL之间时,其浓度的对数值与相应的吸光度呈直线相关,所建立的浊度法平均回收率为100.73%,平均可信限率为2.94%,RSD为0.31%。玛尔江等[14]同样采用浊度法测定硫酸安普霉素可溶性粉的含量,实验证明安普霉素浓度在2.9~7.2单位/mL之间时,其浓度的对数值与相应的吸光度呈直线相关,所建立的浊度法平均回收率为100.10%,平均可信限率为3.05%,RSD为0.23%,表明浊度法可用于安普霉素可溶性粉含量的测定。刘雅妮等[15]对比了浊度法与管碟法测定安普霉素效价的结果,发现采用浊度法,在4.0~9.5单位/mL的浓度范围内,安普霉素浓度的对数与吸光度值呈线性相关,平均回收率为100.53%,RSD为0.8%,与管碟法比较,结果一致。
3.2 旋光法 薛兴奎等[16]采用旋光法测定硫酸安普霉素发酵过程中和提取分离精制过程中中间体的浓度,平均回收率为99.93%,且硫酸安普霉素浓度与旋光度呈现良好线性关系,线性范围为500~2000 μg/mL,重复性实验得到硫酸安普霉素的浓度精密度为0.37%,结果表明用该法测硫酸安普霉素浓度所得结果准确,重现性好。史素萍等[17]用旋光法检测硫酸安普霉素注射液中安普霉素的含量,测得安普霉素在5~40 mg/mL的浓度范围内呈现良好线性关系,回收率为99.6%,实验证明旋光法可以简便而快速地检测安普霉素含量,且该方法重现性较好。
3.3 HPLC法 氨基糖苷类抗生素分子结构中因不含特征紫外基团而没有紫外吸收,传统HPLC-UV法测定含量应用受到限制。近年来,研究人员将高效液相和蒸发光散射检测器联用,可有效解决这一问题。宋志超等[18]采用HPLC-ELSD法测定硫酸安普霉素含量,发现对照品在进样量为0.4~10 μg范围内呈现良好线性关系,安普霉素回收率为99.5%~102.7%,结果表明该方法可用于硫酸安普霉素及其制剂的质量控制,同时也提高了样品检测的精确度。
莫文艳等[19]采用柱前衍生化-HPLC方法检测了三批次预混剂中硫酸安普霉素的含量,测定结果分别为24.42、24.39和24.63 mg/g,RSD分别为0.27%、0.49%和1.0%,表明该方法可以准确检测出预混剂中硫酸安普霉素的含量。
4 安普霉素的临床应用
安普霉素具有低残留量,低毒的特性,临床上广泛用于治疗由沙门氏菌、大肠杆菌引起的腹泻肠炎、结肠炎以及由巴杆菌引起的败血病等细菌性疾病,也可用作饲料添加剂,提高动物生产性能,促进动物生长,但目前还没有作为水产药物使用[20]。多年来,研究者利用肉鸡、仔猪等动物对安普霉素进行了大量的临床试验,以探究安普霉素的临床应用效果。
雷万均[21]给50头患黄痢病的仔猪肌肉注射硫酸安普霉素进行治疗,发现治愈率为90.0%,且不产生副作用,说明硫酸安普霉素治疗仔猪黄痢病疗效显著,具有应用价值。葛爱民等[22]分别以单倍、3倍和5倍治疗量来考察安普霉素对肉鸡新城免疫的效果,同时探究其对机体免疫机能的影响,实验证明推荐治疗剂量安普霉素对肉鸡新城疫的体液免疫无显著影响,胸腺、法氏囊和脾脏生理状况均表现良好,而3~5倍治疗量可降低新城疫抗体效价,同时影响疫苗的免疫效果,易对中枢免疫器官造成不可逆损伤,因此临床使用时不可随意加大安普霉素剂量,以免影响其免疫效果。
姚浪群等[23]在断奶仔猪的饲料中添加90 mg/kg安普霉素,发现其促生长作用显著,可增加采食量,提高饲料转化率,还可显著降低腹泻发生率。李世平[24]在肉仔鸡饲料中分别添加了25 mg/kg和50 mg/kg的安普霉素,发现日增重与饲料转化率均显著提高,并且在生长早期,25 mg/kg添加组肉仔鸡的生产性能优于50 mg/kg添加组。孙智武等[25]证实了饲料中添加适量的安普霉素可增加凡纳滨对虾的特定生长率、蛋白质效率和血清总蛋白、甘油三酯含量,降低血清尿酸水平,且对其生长不产生毒性效应。
5 展望
近些年来,随着兽用抗生素的广泛应用,动物疾病得到了较好控制,而与此同时,抗生素的滥用也导致了细菌耐药性的产生,动物肠道中的耐药细菌随粪便进入土壤,通过食物链进入人体后,耐药基因则能在人类、动物等多个群体之间相互扩散传播,导致人类细菌感染性疾病的治疗难度加大,危害人体健康[26]。安普霉素作为少数几种专抗革兰氏阴性菌的动物抗生素,结构新颖,具有广谱、高效、残留量低的特点,对畜禽毒性低,并可增加畜禽体重和饲料转换率。有研究显示,湖南猪源大肠杆菌对安普霉素耐药率为5.2%,新疆牛源大肠杆菌对安普霉素耐药率为12.5%,辽宁鸡源大肠杆菌对安普霉素耐药率为0[27-28],表明该药不易产生耐药性,是较为理想的兽用抗生素。
为了遏制抗生素耐药问题的蔓延,未来在应用安普霉素时仍应对细菌的耐药性进行监测,同时注意使用合理剂量,以指导临床合理用药,更好地防控耐药菌感染问题。近年来,我国在安普霉素合成途径、抗菌活性、含量测定、临床应用等方面的研究都取得了较大进展,随着基因工程、临床医学、分子生物学等学科的不断发展,以及药物浓度监测等技术的不断进步,相信安普霉素的研究与开发将更具应用价值。
[1] Borodina I, Scholler C, Eliasson A,etal. Metabolic network analysis of Streptomyces tenebrarius, a Streptomyces species with an active entner-doudoroff pathway[J]. Applied and Environmental Microbiology, 2005, 71(5): 2294-2302.
[2] Kharel M K, Basnet D B, Lee H C,etal. Isolation and characterization of the tobramycin biosynthetic gene cluster fromStreptomycestenebrarius[J]. FEMS Microbiology Letters, 2004, 230(2): 185-190.
[3] Park J W, Park S R, Han A R,etal. The nebramycin amino-glycoside profiles ofStreptomycestenebrariusand their characterization using an integrated liquid chromatography-electrospray ionization-tandem mass spectrometric analysis[J]. Analytica Chimica Acta, 2010, 661(1): 76-84.
[4] 李相丰, 何建勇, 田威, 等. 安普霉素生物合成途径的研究[J]. 中国抗生素杂志, 2002, 27(2): 97-100.
[5] 许铭翾, 朱颖旻, 金志坤, 等. 安普霉素的生物合成:辛二糖C7’-N上甲基的甘氨酸来源[J]. 中国科学, 2006, 36(1): 35-42.
[6] 胡振英, 尚若峰, 张新国, 等. 肌肉注射硫酸安普霉素在猪体内的药代动力学和生物利用度研究[J]. 中国兽药杂志, 2001, 35(5): 18-21.
[7] 尚若峰, 胡振英, 张新国, 等. 口服硫酸安普霉素在猪体内的药代动力学和生物利用度研究[J]. 中国兽医杂志, 2004, 40(3): 3-5.
[8] 武慧渊. 安普霉素产生菌的研究[D]. 沈阳:沈阳药科大学,1998.
[9] 孙智武, 黄燕华, 曹俊明, 等. 硫酸安普霉素对嗜水气单胞菌体外抑菌和体内抗感染研究[J]. 淡水渔业, 2012, 42(5): 33-37.
[10]Lane J A, Mehra R K, Carrington S D,etal. The food glycome: a source of protection against pathogen colonization in the gastrointestinal tract[J]. International Journal of Food Microbiology, 2010, 142(1): 1-13.
[11]黄宝明, 王新, 崔一喆. 安普霉素及其联合用药对大肠杆菌的PAE研究[J]. 黑龙江八一农垦大学学报, 2009, 21(6): 43-46.
[12]王新, 崔一喆, 黄宝明, 等. 安普霉素及其联合用药对3种细菌体内抗生素后效应的研究[J]. 中国畜牧兽医, 2010, 37(7): 186-188.
[13]鲁马媚, 周芷锦, 潘露冰. 微生物浊度法测定硫酸安普霉素及制剂含量的试验研究[J].浙江畜牧兽医, 2009, 34(4): 1-3.
[14]玛尔江, 沙吾烈, 古丽曼, 等. 微生物浊度法测定硫酸安普霉素可溶性粉含量的研究方法[J]. 新疆畜牧业, 2009(6): 18-19.
[15]刘雅妮, 顾欣, 蔡金华, 等. 微生物浊度法测定硫酸安普霉素效价的研究[J]. 上海畜牧兽医通讯, 2009(3): 4-5.
[16]薛兴奎, 卓文海, 刘翠玲, 等. 旋光法测定硫酸安普霉素的含量[J]. 齐鲁药事, 2006, 25(5): 288-289.
[17]史素萍, 李延团. 硫酸安普霉素注射液中硫酸安普霉素含量的测定[J]. 山东畜牧兽医, 2011, 32(2): 7-8.
[18]宋志超, 陈蔷, 班付国, 等. HPLC-ELSD法测定硫酸安普霉素含量的研究[J]. 河南畜牧兽医, 2009, 30(12): 7-9.
[19]莫文艳, 黄燕华, 曹俊明, 等. 柱前衍生化高效液相色谱法测定预混剂中硫酸安普霉素[J]. 药物分析杂志, 2015, 35(1): 80-83.
[20]中华人民共和国兽药典[M]. 2010版一部. 北京:中国农业出版社, 2010: 297-299.
[21]雷万均. 乙酰甲喹与硫酸安普霉素治疗仔猪黄痢病的疗效观察[J]. 中国畜牧兽医文摘, 2014, 30(1): 169.
[22]葛爱民, 王福红, 刘新勃. 不同剂量安普霉素对肉鸡新城疫免疫效果及机体免疫机能的影响[J]. 畜牧与兽医, 2014, 46(3): 84-87.
[23]姚浪群, 萨仁娜, 佟建明, 等. 安普霉素对仔猪内分泌的调控作用及血液生化指示的影响[J]. 动物营养学报, 2003, 15(2): 58-64.
[24]李世平. 略论不同剂量安普霉素对肉鸡免疫机能的作用[J]. 才智, 2011(25): 356.
[25]孙智武, 黄燕华, 王国霞, 等. 硫酸安普霉素对凡纳滨对虾生长、血清生化指标的影响及在组织内的残留[J]. 水产科学, 2013, 32(3): 139-141.
[26]张小莺. 兽医抗生素的合理使用与替代[J]. 中国畜牧业, 2015(22): 45-46.
[27]戴秀美, 常维山. 2012年我国部分地区猪源大肠杆菌耐药性分析[J]. 畜禽业, 2013(1): 50-52.
[28]夏利宁, 向发, 郭庆勇, 等. 新疆不同地区牛源大肠杆菌耐药性分析[J]. 中国畜牧兽医, 2014, 41(2): 203-207.
(编辑:李文平)
Research Progress of Apramycin
DAI Qing,YU Li-na,ZHANG Lu,HAN Ning-ning,XU Yuan,ZHAO Hui*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
In this paper, the research progress about synthetic route, antibacterial activity, content determination and clinical application of apramycin were reviewed in order to provide reference for the research and development of apramycin.
apramycin; synthetic route; antibacterial activity; content determination; clinical application
戴青,硕士,从事抗生素检验检测工作。
赵晖。E-mail: 171977364@qq.com
2015-05-13
A
1002-1280 (2016) 07-0066-04
S859.79

