SYBR GreenⅠ实时荧光PCR法检测禽活疫苗中禽网状内皮组织增生症病毒
黄小洁,杨承槐,刘丹,陈晓春,侯力丹,李启红,李慧姣,李俊平
(中国兽医药品监察所,北京 100081)
SYBR GreenⅠ实时荧光PCR法检测禽活疫苗中禽网状内皮组织增生症病毒
黄小洁,杨承槐,刘丹,陈晓春,侯力丹,李启红,李慧姣*,李俊平*
(中国兽医药品监察所,北京 100081)
为快速、准确检测禽活疫苗中的禽网状内皮组织增生症病毒(REV),根据REV p30基因上的一段保守序列,利用Primer Premier 5.0软件设计合成了1对特异性引物,建立了基于SYBR Green I 模式的实时荧光PCR 方法,并以常规PCR产物为标准品绘制了标准曲线,对方法的特异性、敏感性、重复性、与经典方法的符合率进行了评价。结果表明:扩增产物片段大小为222 bp,与预期片段大小相符,测序结果证实为REV靶序列;标准曲线具有良好的线性关系,相关系数为1.0,扩增效率为94.2%,溶解温度Tm=(86.0±0.50)℃,无引物二聚体;该方法只从REV阳性样本检出扩增信号,其他病原无扩增信号,特异性好;最低可检测26.97拷贝数的阳性标准品,比常规PCR敏感1000倍;组内变异系数、组间变异系数分别为0.79%~5.36%,1.61%~5.25%。运用建立的实时荧光PCR方法对17批禽用活疫苗进行检测,并与间接免疫荧光法(IFA)进行同步比较试验,结果两者符合率为100%。且实时荧光PCR法更快捷、更方便,结果判定更为直观可用于疫苗中REV污染情况的监测。
网状内皮组织增生症病毒;实时荧光PCR;禽活疫苗
禽网状内皮组织增生症(RE)是指由反转录病毒科网状内皮组织增生症病毒(REV)引起的禽类以急性网状细胞肿瘤、生长抑制综合症、淋巴组织和其他组织的慢性肿瘤形成为特征的一群病理综合症。REV属正反转录病毒科,γ反转录病毒属,为单股、正链、线性RNA。REVS基因组RNA是由两个30~40S的RNA亚单位的60~70复合体组成[1],分离株存在3个明显的亚型,网状内皮组织增殖病病毒 T株(REV-T 株)、脾坏死病毒(SNV)和鸭传染性贫血病毒(DIAV)、鸡合胞体病毒(CSV)[2],不同毒株具有相同的抗原性。
普遍认为疫苗中污染REV是引起该病传播和流行的主要原因,而且国内外均有因REV污染疫苗引起严重损失的案例和报道[3-6]。因此,为了保证病毒性生物制品安全有效,对禽源活疫苗进行REV污染检测是确保疫苗产品质量,防止REV传播的有效手段。本实验参考2010年版《中华人民共和国兽药典》[7]对禽源生物制品外源病毒检验的各项检验要求,建立了SYBR GreenⅠ实时荧光PCR法以检测禽活疫苗中禽网状内皮组织增生症病毒。
1 材料与方法
1.1 材料
1.1.1 病毒 REV MD-2株、传染性法氏囊病毒(IBD)、传染性支气管炎病毒(IB)、禽呼肠孤病毒(ARV)、新城疫病毒(NDV)、禽白血病(ALV)病毒均由本实验室保存。
1.1.2 SPF鸡胚 9日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司
1.1.3 主要试剂 高纯度质粒小提中量试剂盒、琼脂糖凝胶DNA回收试剂盒、蛋白酶K溶液、Top10感受态细胞购于天根生化科技有限公司;OMEGA总RNA提取试剂盒,购于OMEGA公司;pMD18-T载体、Ex Taq DNA聚合酶、dNTPs、Maker Ⅴ、T4 DNA连接酶;SYBR®Premix Ex TaqTM试剂盒、PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒均购自大连宝生物(Takara)工程有限公司;琼脂糖购自Invitrogen公司;无水乙醇、苯酚、氯仿、异戊醇均购自国药集团。
1.1.4 其他材料 抗REV特异性血清由中国兽医药品监察所生产;FITC标记的兔抗鸡Ig G购自Sigma公司;SPF鸡胚购自梅里亚维通实验动物技术有限公司。
1.1.5 禽活疫苗样品 鸡痘活疫苗6批(鹌鹑化弱毒株);鸡新城疫、传染性支气管炎二联活疫苗2批;鸡传染性法氏囊病活疫苗2批;鸡新城疫中等毒力活疫苗(I系)3批;传染性喉气管炎活疫苗1批;小鹅瘟活疫苗(GD)株1批;鸭瘟活疫苗1批;鸡马立克氏病火鸡疱疹病毒活疫苗1批。
2 方法
2.1 制作鸡胚成纤维细胞 参照《中华人民共和国兽药典》[7]附录方法制作。
2.2 REV SYBY GreenⅠ实时荧光PCR 的建立
2.2.1 病毒增殖 REV MD-2株接种鸡胚成纤维细胞,放于5%CO2、37 ℃培养箱培养, 每隔3 d传代一次,连传2代,-80 ℃保存。2.2.2 引物设计 在p30基因上选取一段保守序列,用Primer Version 5.00软件设计引物,由华大基因(中国北京)合成,扩增目的基因片段长度为222 bp。引物序列如下:上游引物:5’-CGAGCGAGAAATAGAAGC-3’;下游引物:5’ -GTCCGATAAGCCTGATAGA-3’。
2.2.3 标准品的制备
2.2.3.1 前病毒DNA提取 用酚-氯仿法[8]提取REV的前病毒DNA。2.2.3.2 PCR扩增 在25 uL体系中进行:反应管中依次加入ddH2O 16.3 μL,10×Buffer 2.5 μL,dNTP 2 μL,上游引物1 μL,下游引物1 μL,ExTaq酶0.2 μL,病毒DNA 2 μL。反应在94 ℃预变性2 min,然后按以下参数(变性:94 ℃ 30 s;退火:55 ℃ 30 s;延伸:72 ℃ 30 s)进行30个循环,循环结束后72 ℃延伸10 min,同时以ddH2O为阴性对照。
2.2.3.3 标准质粒制备 将鉴定正确的PCR 产物采用普通琼脂糖凝胶DNA回收试剂盒进行纯化回收,回收产物与pMD-18T载体进行连接,连接产物转化到大肠杆菌(Top10),通过克隆、筛选,选择出阳性菌液,送测序,测序正确的的菌液用质粒提取试剂盒提取质粒做为标准品。
2.2.3.4 反应条件和反应体系 参照试剂盒说明采用SYBR Green I 染料法,按照Takara 试剂盒说明推荐的反应体系,以最小的Ct 值和最高的荧光值(ΔRn)及熔解曲线不出现非特异性峰、最大程度提高扩增效率为标准,25 uL反应体系的条件为:95 ℃ 30 s ;95 ℃ 5 s;55 ℃ 30 s;72 ℃ 30 s ,共40个循环,最后进行溶解曲线分析。反应体系见表1。

表1 SYBR Green I 实时荧光PCR反应体系
2.2.4 标准曲线的建立 分别以经过回收纯化的标准质粒作为标准品,用BECKMAN紫外分光光度计测定标准质粒的D260 nm、D280 nm值及在260 nm条件下的核酸浓度,并计算D260 nm与D280nm的比值。根据浓度与拷贝数之间的换算关系:拷贝数=浓度×阿伏加德罗常数/(一个碱基对的平均分子质量×总长度),阿伏加德罗常数为6.02×1023,计算出标准品的拷贝数。用双蒸水将标准品进行10倍连续稀释,并选取7个稀释梯度的标准品,进行SYBR Green I实时PCR检测,构建标准曲线。
2.2.5 特异性试验 使用OMEGA 公司总RNA提取试剂盒提取REV、IBD、IB、ND、ARV 、ALV的RNA,按照PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒说明操作将上述RNA合成cDNA,应用已建立的SYBR GreenⅠ实时荧光定量PCR方法进行检测,验证方法的特异性。
2.2.6 重复性试验 选取3批10倍连续稀释的6个稀释梯度的标准品作为模板,应用已建立的SYBR GreenⅠ实时荧光PCR方法进行检测,对同一批次,6个稀释梯度的标准品进行3次批内重复;不同批次,相同稀释度的标准品进行3次批间重复,得出Ct值并计算Ct值的变异系数CV。
2.2.7 敏感性试验 取7个稀释度的标准品,应用已建立的SYBR GreenⅠ实时荧光PCR方法在BIO-RAD IQTM5实时荧光定量PCR仪上进行扩增,以出现标准扩增曲线的最高稀释倍数的模板Ct值来推算其最小检出量。
2.3 普通PCR敏感性试验 用2.1.2建立的常规PCR方法对2.1.7中7个稀释度的标准品进行检测,并与SYBR Green I 实时PCR 检测结果进行比较。
2.4 荧光定量PCR法与间接免疫荧光方法(IFA)最低病毒检出量比较 将REV MD-2株进行10倍连续稀释,取0.01 TCID50、0.1 TCID50、1 TCID50、10 TCID50四个梯度病毒含量的病毒接种CEF细胞,放入5%CO2、37 ℃培养箱培养1~5 d,每天收集上清,分别运用实时荧光PCR法和间接免疫荧光法IFA方法[7]进行检测,确定两种方法对病毒的最低检出量。
2.5 临床初步应用 分别运用建立的SYBR GreenⅠ实时荧光PCR方法和IFA法,对17批禽活疫苗样品进行检测,比较两种方法检测结果的符合率。
3 结果
3.1 病毒PCR扩增结果 采用设计的引物对提取的DNA进行常规PCR扩增,PCR产物用1.2%琼脂糖凝胶进行电泳,出现222 bp的特异性扩增条带,与预计的目的片段大小一致。
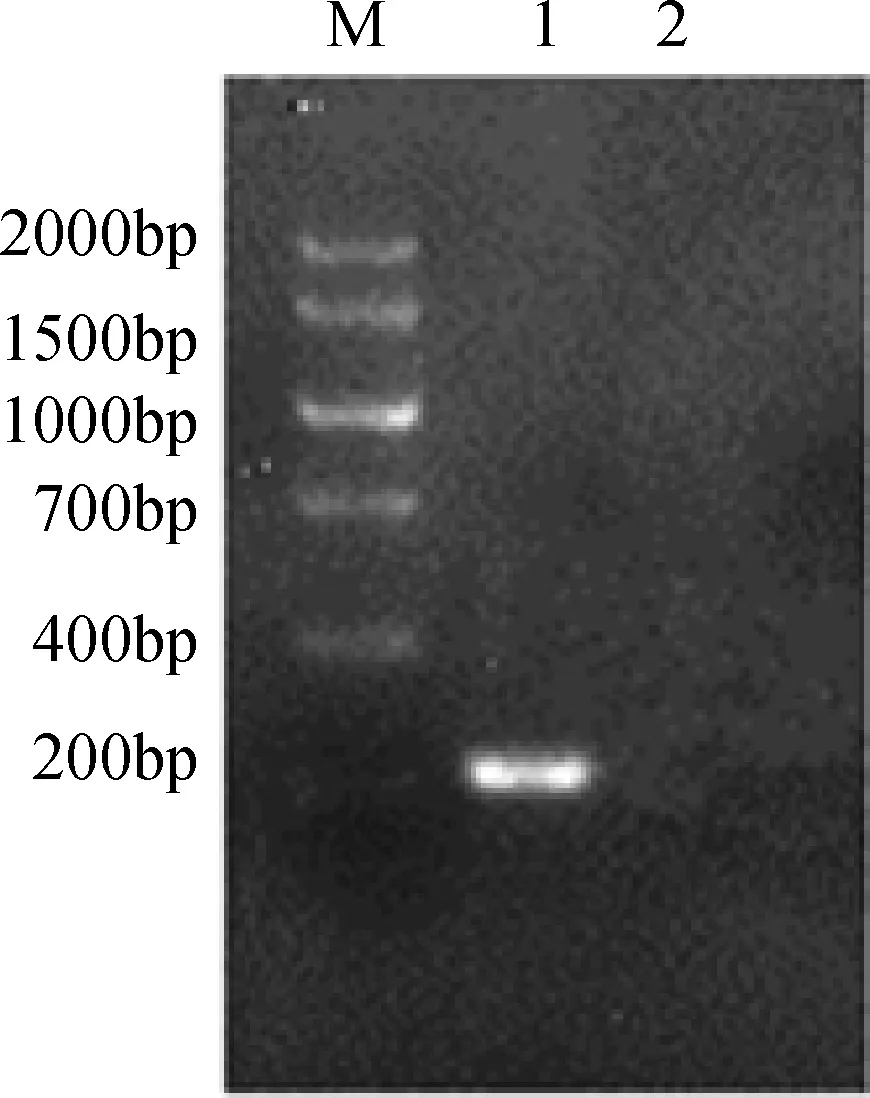
M:Marker V;1:REV MD-2株;2:去离子水图1 MD-2株PCR扩增结果
3.2 荧光定量PCR引物的验证 以标准质粒为模板进行实时荧光PCR反应,对反应产物进行的熔点曲线分析表明,荧光定量PCR产物的Tm=(86.0±0.50)℃,无引物二聚体,只出现了一个特异性的吸收峰(图2),该引物反应性能良好。
3.3 SYBR Green I 实时荧光PCR扩增曲线和标准曲线 用BECKMAN紫外分光光度计测定标准质粒的D260nm/D280nm值为1.99,浓度为65.65 μg/mL,根据浓度与拷贝数的换算关系,标准质粒的拷贝数为2.697×1011copies /μL。3.3.1 标准曲线的构建 选取2.697×109~2.697×103copies/μL共7个稀释梯度的标准品作为模板进行荧光定量PCR反应,生成扩增曲线(图3)。对扩增曲线进行处理绘制出荧光定量反应的标准曲线(图4),标准曲线公式为y=-3.768x-4.541,其斜率为-3.768,截距为-4.541,相关系数为1.0,反应扩增效率为94.2%。
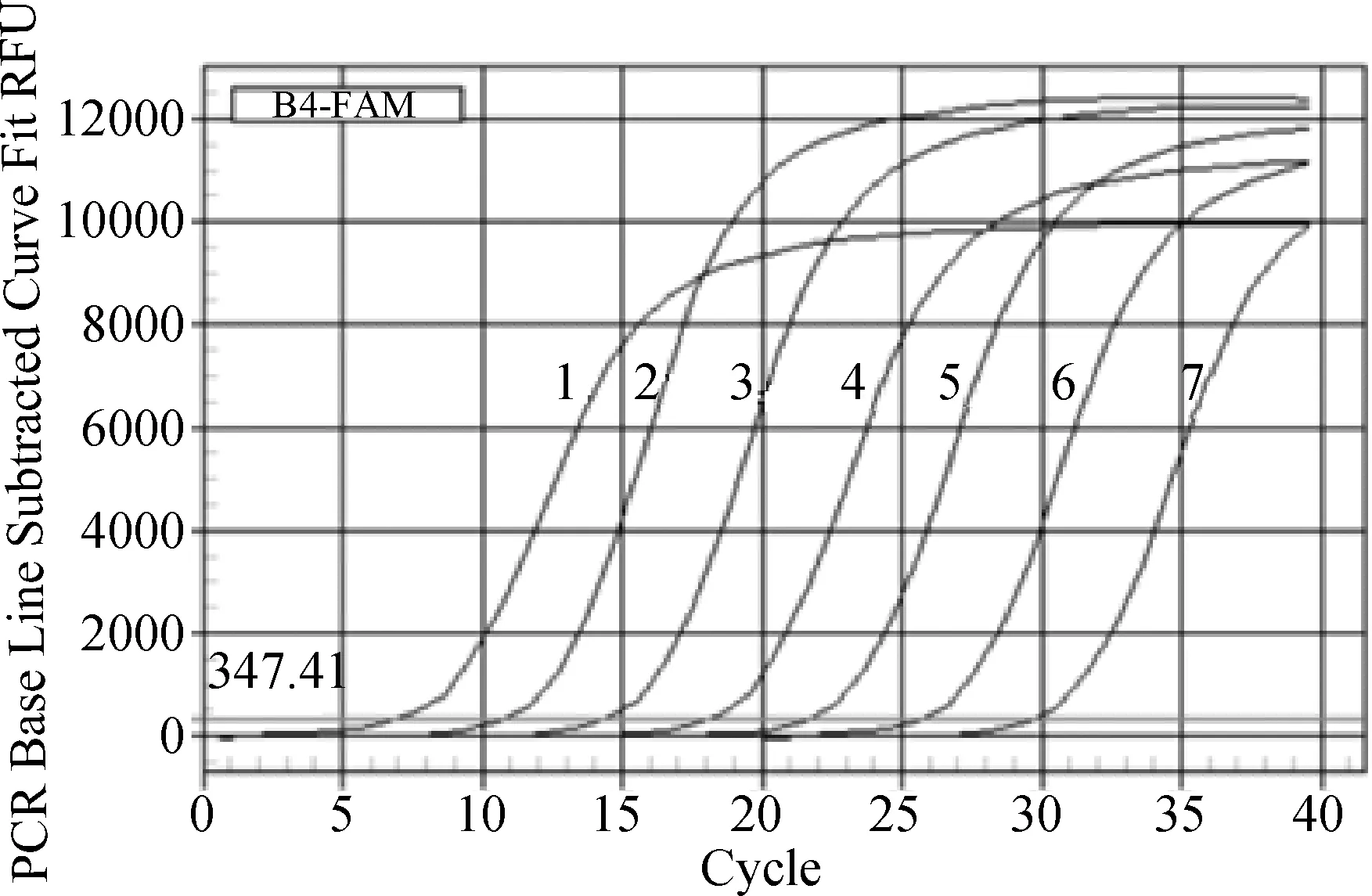
1-7:2.697×109~2.697×103 copies/μL标准品图3 荧光定量PCR扩增曲线

FAM E= 94.2% Squared=1.000 Slope=-3.768 y-Intercept=-4.541图4 荧光定量PCR标准曲线
3.3.2 特异性试验结果 应用已建立的荧光定量PCR方法,对REV与IBD、IB、ARV、NDV、ALV一起作为模板进行荧光定量PCR反应,结果表明,只有REV出现了明显的扩增曲线,其余样品均没有出现扩增曲线(图5),表明检测方法的特异性良好。
1:REV 2:IBD 3:IB 4:ARV 5:NDV 6:ALV图5 荧光定量PCR特异性试验结果
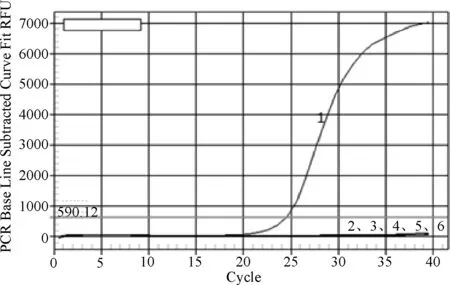
3.3.3 重复性试验结果 选取2.697×107~2.697×102copies/μL共6个稀释梯度的标准品为模板进行荧光定量PCR反应,对标准品分别做3次批内、批间重复,获得扩增曲线(图6和图7)。PCR扩增结束后获得样品Ct值,组内变异系数为0.79%~5.36%;组间变异系数为1.61%~5.25%,符合重复性实验要求。

图6 批内重复试验结果

图7 批间重复试验结果
3.3.4 敏感性试验结果 将标准品进行10倍连续稀释,取2.697×106~2.697×100copies/μL 7个稀释度的标准品做为模板,在实时荧光定量PCR仪上进行扩增,结果显示,该方法最低可检出2.697×101copies/μL的标准品(图8)。3.4 常规PCR敏感性试验结果 常规PCR对标准品的最低检出量为2.697×104copies/μL(图9),荧光定量PCR的敏感性是常规PCR的1000倍。

1-7:2.697×106~2.697×100 copies/μL标准品图8 荧光定量PCR敏感性试验结果

1-7:2.697×106~2.697×100copies/μL;8:去离子水;M:Marker V图9 常规PCR敏感性试验结果
3.5 实时荧光PCR法和IFA方法最低病毒检出量结果 实时荧光PCR方法最低能在0.1 TCID50的REV感染CEF细胞后2 d检出,而IFA方法只能在1 TCID50的REV感染CEF后3 d检出(表1)。
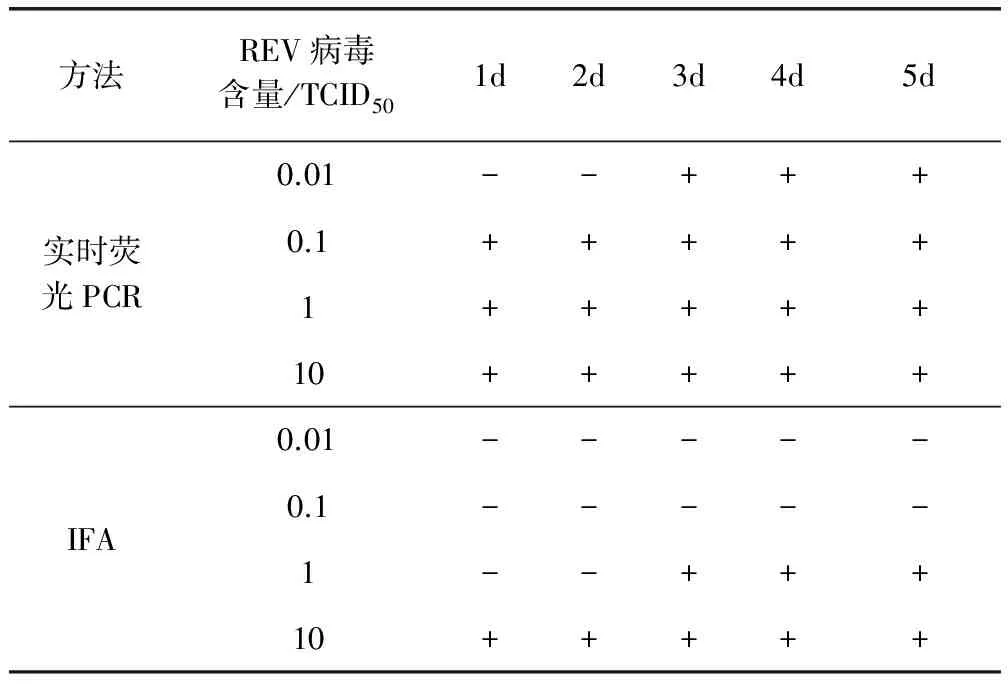
表1 实时荧光PCR和IFA法最低病毒检出量结果
-表示阴性;+表示阳性
3.6 IFA方法检测疫苗中的REV结果 有1批疫苗(鸡马立克氏病火鸡疱疹病毒活疫苗)出现特异性绿色荧光,其余16批被检样品接种孔均未出现特异性绿色荧光(图10)。

A.阳性样品检测结果; B.阴性样品检测结果图10 疫苗样品IFA检测结果
3.7 实时荧光PCR法检测结果及与IFA方法的检测结果比较 图11显示,1批鸡马立克氏病火鸡疱疹病毒活疫苗样品经实时荧光PCR检测出现扩增曲线,拷贝数为9.5×106copies/μL,其余16批疫苗样品均未出现扩增曲线,与IFA方法检测结果一致,符合率达到100%。
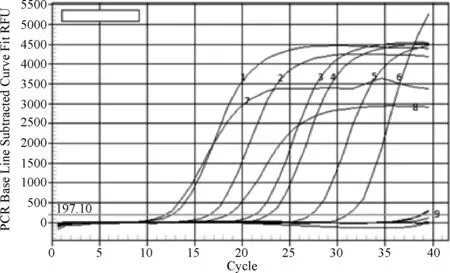
1~6:2.697×109~2.697×104copies/μL模板; 7:REV阳性血清; 8:鸡马立克氏病火鸡疱疹病毒活疫苗样品; 9:其他样品图11 疫苗样品荧光定量PCR检测结果
4 讨论
根据2010年版《中华人民共和国兽药典》中外源病毒检验要求,我国疫苗外源病毒检验主要有鸡胚检查法、细胞检查法和鸡检查法等三种方法。一般情况下,只需采用鸡胚检查法和细胞检查法进行外源病毒检验,如检验无结果或结果可疑时,才使用鸡检查法[9]。本实验室成功建立了REV IFA检测方法,已被《中国兽药典》收录,完善了我国禽活疫苗检验方法,为疫苗质量监管提供有力的技术手段。然而,此方法需要对疫苗样品进行中和处理(不同种类疫苗处理方法不同),接种CEF传代,再进行IFA检测,耗时比较长,需要约两周左右的时间。并且操作过程中,容易出现因洗涤不彻底而存在非特异荧光,影响结果判定。近年来,实时荧光定量PCR法因其特异性好、灵敏度高、快速简便、高精度、高通量、易于标准化等优点,广泛被运用于病原检测研究中。国内有采用REV LTR片段设计引物,建立基于 SYBR Green I 模式的实时荧光 PCR 方法(Real-time PCR SYB)[10]的报道,其敏感性是普通PCR的1000倍。
本研究从p30基因上选取一段片段为222 bp保守片段设计引物,片段长度适中,符合荧光定量片段扩增的要求。引物特异性好,重复实验变异系数低,敏感性高,与LTR片段相似,敏感性是普通PCR的1000倍,避免了常规PCR敏感性不高及凝胶成像仪分辨率低等原因造成结果假阴性的问题。与经典的IFA方法比较,实时荧光PCR方法最低能在0.01 TCID50的REV感染CEF细胞后的3 d检出,而IFA方法只能在1 TCID50的REV感染CEF后的3 d检出,由此可见,实时荧光PCR方法敏感性高于IFA法。IFA方法不仅耗时长,且步骤繁琐,检验结果容易受到细胞培养、荧光染色等多种因素的影响。实时荧光PCR法不需要对样品进行任何处理,直接从样本中提取RNA,体外反转录成cDNA即可检测,可在2 h 内对样品做出定性和定量的检测和鉴定,整个操作过程一天内可完成,结果可疑当天便可重检。本试验运用建立的实时荧光PCR方法对疫苗样品进行检测,结果与IFA方法的检测结果完全符合。
综上所述,实时荧光PCR法操作简单、快捷,敏感性高,结果可定量,用于活疫苗REV外源病毒检测结果与经典方法结果完全符合,说明运用该方法对活疫苗进行REV外源病毒检可行性强。本次实验样品数据比较少,我们将在后续的实验中增加样品检测量,积累更为丰富的检测数据。
[1] Saif Y M.禽病学[M]. 北京:中国农业出版社,2012.
[2] 李井春.禽网状内皮组织增殖症研究进展[J]. 现代畜牧兽医,2011(6):34-36.[3] Jackson C A,Dunn S E,Smith D I,etal. "Nakanuke" and reticuloendotheliosis in chickens following vaccination with herpes virus of turkeys(HVT)[J]. Aust Vet J,1977,53(9):457-459.
[4] Kawamura H,Wakabayashi T,Yamaguchi S,etal.Inoculation experiment of Marek's disease vaccine contaminated with a reticuloendotheliosis virus[J]. Natl Inst Anim Health Q, 1976, 16(4): 135-140.
[5] Yuasa N,Yoshida I,Taniguchi T. Isolation of a reticuloendo theliosis virus from chickens inoculated with Marek's disease vaccine [J]. Natl Inst Anim Health Q, 1976, 16(4): 141-151.
[6] Wei K,Sun Z,Zhu S,etal.Probable congenital transmission of reticuloendotheliosis virus caused by vaccination with contaminated vaccines [J].PloS One, 2012, 7(8):e43422.
[7] 中华人民共和国兽药典[M].北京:中国农业出版社,2010.
[8] Morgan R A, Cornetta K, Anderson W F. Applications of the polymerase chain reaction in retroviral-mediated gene transfer and the analysis of gene-marked human TIL cells[J]. Hum Gene Ther, 1990, 1:135-149.
[9] 李启红,杨承槐, 刘丹, 等.鸡马立克病活疫苗中污染禽网状内皮织组增生症病毒检测方法的建立[J]. 中国兽医杂志, 2014,48(11):81-84.
[10]李莉莉.检测禽网状内皮组织增生症病毒的间接免疫荧光试验建立及应用[D].扬州大学,2014.
(编辑:李文平)
Detection of Avian Reticuloendotheliosis Virus of Avian Live Vaccine by SYBR Green Real-time PCR
HUANG Xiao-jie,YANG Cheng-huai,LIU Dan,CHEN Xiao-chun,HOU Li-dan,LI Qi-hong,LI Hui-jiao*,LI Jun-ping*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
In order to detect avian reticuloendotheliosis virus(REV) of avian live vaccine quickly and accurately,a pair of specific primer was designed and synthesized using Primer Premier 5.0 according to conservative sequence of REV p30 gene in this study. The real-time PCR method based on the SYBR Green I pattern(Real-time PCR)was developed.The standard curve was constructed by using the product of conventional PCR,the specificity, sensitivity, reproducibility and the coincidence rate to IFA were evaluated. The result showed that the length of the PCR product was 222 bp as expected and the amplified sequence was approved to be identical with the REV target sequence. The standard curve had a good linear relationship, the correlation coefficient was 1.0 and the amplification efficiency was 94.2%. Melting peak appeared at (86.8±0.5)℃ without primer-dimer. This method only detected amplified signals from REV positive sample,so it was identified to have good specificity. The standard curve covered a linear range of 2.697×109~2.697×103copies. The minimum copy of the positive sample detected was 26.97, 1000 times more sensitive than the conventional PCR. The coefficient of variations (CVs) of intra assay and inter assay were in the range of 4.80%~5.72% and 0.75%~3.87%, respectively. The real-time PCR was used to detect 17 batches of avian live vaccine, comparing with indirecting immunofluorescence(IFA).The results showed that the coincidence rate of these two methods was 100%. This real time PCR method has been proven to be a useful tool for the detection of REV in avian live vaccine because it was more rapid,more convenient and more intuitive.
REV;real-time PCR;avian live vaccine
黄小洁,从事实验动物管理工作。
李慧姣,E-mail: lihuijiao@ivdc.org.cn;李俊平, E-mail: lijunping@ivdc.org.cn
2015-05-28
A
1002-1280 (2016) 07-0007-07
S855.3

