五加芪粉长期毒性试验研究
卞愧,高艳艳,周德刚
(国家兽用药品工程技术研究中心/洛阳惠中兽药有限公司,河南洛阳471003)
五加芪粉长期毒性试验研究
卞愧,高艳艳,周德刚
(国家兽用药品工程技术研究中心/洛阳惠中兽药有限公司,河南洛阳471003)
为考察五加芪粉对动物的安全性,采用大鼠进行长期毒性试验。设五加芪粉高、中、低(8.4、2.1、0.84 g/kg/d)剂量组及空白对照组,给药量分别相当于鸡每日临床用量的100倍、25倍、10倍;给药第14日、第28日及停药第14日,各组抽取10只(雌雄各半)大鼠,取尾静脉血进行血液学检测和血液生化指标测定,对心、肝、脾、肺、肾、胃肠、睾丸、卵巢等脏器进行组织病理学检查。结果显示:各剂量组大鼠的体重、脏器与体重比值和血液学指标、血液生化指标与空白对照组均无显著性差异(P>0.05),心、肝、脾、肺、肾、胃肠、睾丸、卵巢等脏器组织病理学检查均未见明显病理变化。研究表明五加芪粉临床应用安全。
五加芪粉;长期毒性;大鼠
五加芪粉由洛阳惠中兽药有限公司联合其他几家公司研制,是农业部2015年9月批准的三类新兽药,现已在市场上销售使用。五加芪粉由黄芪、刺五加组成,经提取、纯化、浓缩、喷雾干燥等工艺加工制成,具有补中益气、扶正祛邪的功效,用于提高禽的机体免疫力,配合疫苗使用提高疫苗免疫效果。本研究在前期急性毒性试验的基础上,参照《中药、天然药物长期毒性研究技术指导原则》的相关规定[1],对其长期用药的安全性进行评价。
1 材料与方法
1.1 材料
1.1.1 药品 五加芪粉:批号20120203,规格50 g:165 g生药,由洛阳惠中兽药有限公司提供。临用前用纯化水配成0.84、0.21、0.084 g/mL的溶液。
1.1.2 实验动物 4周龄Wistar大鼠120只,清洁级,雌雄各半,体重180~220 g,购自北京维通利华实验动物技术有限公司,许可证号:SCKX(京)2012-0001。
1.1.3 主要仪器与试剂 PUS-2018G型半自动生化分析仪,南京普朗新技术有限公司;XF9080A动物自动血液细胞分析仪,南京普朗医用设备有限公司;DT-1000天孚牌电子天平,常熟市金羊砝码仪器有限公司;JA2003电子天平:上海上平仪器有限公司。
谷丙转氨酶(ALT)测试盒(批号20120413)、谷草转氨酶(AST)测试盒(批号20120413)、尿素氮(BUN)测试盒(批号20120415)、血清(浆)、尿肌酐(Cr)测试盒(批号20120409)、总蛋白(TP)测试盒(批号20120412)、白蛋白(ALB)测试盒(批号20120412)、葡萄糖(GLU)测试盒(批号20120416)和甘油三酯(TG)测试盒(批号20120412),均购自南京建成生物工程研究所。
1.2 方法
1.2.1 分组及给药 选用健康大鼠120只,随机分为4个组,每组30只,雌雄各半,分笼饲养,每笼5只,用双染色法进行编号标记[2-4]。由实验室前期对五加芪粉急性毒性试验研究结果可知,以最大给药量(即24 g/kg体重)给药后,小鼠未见任何异常与死亡,依据兽药研究技术指导原则汇编(2006-2011年)中《兽药30天和90天喂养试验指导原则》以及不同种类动物间用药剂量换算公式[5](即大鼠是鸡用药量的1.4倍,且靶动物鸡临床拟推荐剂量为每1 L水0.2 g)设计给药剂量,即五加芪粉低剂量组0.84 g/kg/d、中剂量组2.1 g/kg/d、高剂量组8.4 g/kg/d和空白对照组,给药各组分别以鸡每日临床10倍、25倍、100倍剂量的五加芪粉给大鼠灌胃,按10 mL/kg体重的用量,每天上午灌胃给药1次,空白对照组灌服同体积的纯化水。具体试验分组和给药剂量见表1。
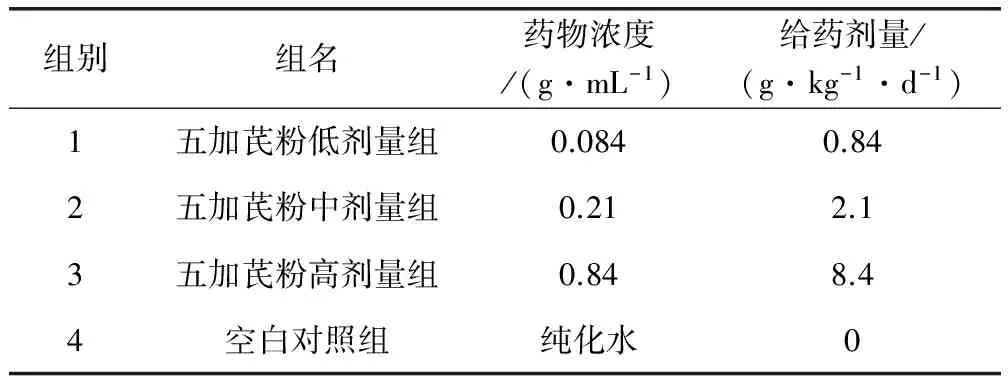
表1 试验分组和给药剂量
1.2.2 观察指标[6-8]
1.2.2.1 一般观察 试验期间逐日观察并记录大鼠的精神状态、行为表现、采食情况、粪便形态。
1.2.2.2 体重影响 每周逐只称重1次,并根据体重变化调整灌胃量,连续给药28 d,观察至给药结束后14 d。
1.2.2.3 血液学检查及血液生化指标测定 给药第14日、第28日及停药第14日,各组抽取10只(雌雄各半)大鼠,取尾静脉血进行血液学检测和血液生化指标测定,血液学检查指标包括白细胞数(WBC)、红细胞数(RBC)、血细胞比容(HCT)、血红蛋白含量(HGB)、血小板总数(PLT);血液生化检查指标包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮(BUN)、肌酐(Cr)、血清总蛋白(TP)、血清白蛋白(ALB)、血葡萄糖(GLU)和甘油三酯(TG)。
1.2.2.4 剖检情况 给药第28日及停药第14日,将采血后的10只大鼠处死,进行系统解剖,肉眼观察其组织器官,同时取其心、肝、肾、肺、脾等脏器进行称重,计算脏/体比值。

1.2.2.5 病理学检查 其余大鼠停药继续喂养,于第14日处死,随机取高剂量组和空白对照组大鼠各10只,并取其心、肝、脾、肺、肾、胃肠、睾丸、卵巢作组织病理学检查。
2 结果与分析
2.1 一般观察 整个试验过程中,四组大鼠精神状态、行为表现、采食情况均正常,粪便呈棕黑色颗粒状。恢复期亦未出现明显的异常。
2.2 对体重的影响 给药期间及给药后,各剂量组大鼠与空白对照组相比,每周体重无明显差异(P>0.05),结果见表2。
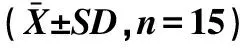
表2 五加芪粉对大鼠体重的影响
注:“*”表示与空白对照组相比,差异显著(0.01 2.3 对血液学指标的影响 给药期间及给药后,各剂量组大鼠血液学指标均在正常范围,与空白对照组相比无显著差异(P>0.05),结果见表3。 表3 各组大鼠血液学指标 2.4 对血液生化学指标的影响 给药期间及给药后,各剂量组大鼠血液生化指标均在正常范围,与空白对照组相比无显著差异(P>0.05),结果见表4。 表4 各组大鼠血液生化指标 2.5 对大鼠内脏器官及脏/体比值的影响 五加芪粉连续灌胃第28日及停药第14日解剖观察,各组大鼠心、肝、脾、肺、肾、胃肠等脏器均无肉眼可见的病理变化。各组大鼠心、肝、脾、肺、肾与体重比值在正常范围,与空白对照组相比,无明显差异(P>0.05),结果见表5。 表5 五加芪粉对大鼠脏/体比的影响 2.6 组织病理学检查 H.E染色后镜检观察,高剂量组大鼠的心、肝、脾、肺、肾、胃肠、睾丸、卵巢与空白对照组相比,均未见异常的病理变化。 五加芪粉以8.4、2.1、0.84 g/kg 3个剂量,28 d连续给大鼠灌胃给药,试验观察期间,各组动物的精神状态、行为表现、采食、粪便均正常。各给药组动物的增重、血液学指标、血液生化指标与空白对照组比较均无显著性差异(P>0.05)。解剖后,各组动物的心、肝、脾、肺、肾、胃肠等脏器均无肉眼可见的病理变化,心、肝、脾、肺、肾、胃肠等脏器与体重比值与空白对照组相比,无明显差异(P>0.05);H.E染色后镜检观察,高剂量组大鼠的心、肝、脾、肺、肾、胃肠、睾丸、卵巢与空白对照组相比,均未见异常的病理变化。宋艳春等[9]对Wistar大鼠静脉、腹腔注射刺五加注射液(总黄酮含量:5 mg/mL)16.0、40.0 mL/kg,连续28 d,研究表明大鼠在给药期间、给药结束时及恢复期间在饮食、饮水、活动、毛发、呼吸、排泄等方面与空白对照组比较均无显著性差异;体重增长率、各主要器官脏器系数、血细胞和血液生化指标均无显著影响;病理组织学检查亦未见毒性病理改变,此结论与本文研究结果一致。刘阳等[10]对Wistar大鼠灌服黄芪煎剂(180、90、45 g/kg),连续90 d,研究表明,对大鼠的一般状况,血、尿常规,主要脏器质量及其系数均无影响;心、肝、脾、肺、肾脏无病理变化,此研究结果亦与本文研究结果一致。张丽等[11]对Wistar大鼠灌服复方黄芪胶囊(5、3、1 g/kg),连续12周,研究表明大鼠在给药期间,各组动物的活动、毛色、摄食、粪便及体重增长与空白对照组比较无显著性差异;常规血液学、血液生化指标、心电图及心率均无显著性差异;心、肝、脾、肺、肾脏、肠、肾上腺等脏器未见病理形态变化。 五加芪粉以8.4 g/kg(以鸡临床日用量的100倍),连续给药28 d并未对大鼠产生毒副作用,停药14 d内未见由蓄积毒性引起的后遗效应。因此,五加芪粉临床应用安全。 [1] 国家食品药品监督管理局. 中药、天然药物长期毒性研究技术指导原则[Z]. [2] 农业部兽药审评中心.兽药研究技术指导原则汇编(2006-2011年)[M].北京:化学工业出版社,2012:3. [3] 李仪奎.中药新药的长期毒性试验(一)[J].中药新药与临床药理,1994,5(2): 50-54. [4] 李仪奎.中药新药的长期毒性试验(二)[J].中药新药与临床药理,1994,5(3): 52-55. [5] 赵伟,孙国志.不同种实验动物间用药量换算[J].畜牧兽医科技信息,2010,5(32):52-53. [6] 沈建忠.动物毒理学[M].北京:中国农业出版社,2002:99-102. [7] 袁伯俊,廖明阳,李波.药物毒理学实验方法与技术[M].北京:化学工业出版社,2007:212-231. [8] 陈奇.中药药理方法学[M]. 北京:人民卫生出版社,1993:119-120. [9] 宋艳春,刘湘梅,李秀娟,等.刺五加注射液对大鼠长期毒性试验的研究[J].药物评价研究,2003,1(33):1-4. [10]刘阳,张云鹏,孙影,等.中药黄芪长期毒性试验研究[J].现代中西医结合杂志,2009,18(29):3545-3549. [11]张丽,李灵芝,龚海英.复方黄芪胶囊长期毒性试验研究[J].武警医学院学报,2005,14(2):108-110. (编辑:侯向辉) Experimental Study on Long-Term Toxicity of Wujiaqi Powder BIAN Kui,GAO Yan-Yan,ZHOU De-gang (LuoyangHuizhongAnimalMedicineCoLtd,NationalResearchCenterforVeterinaryMedicine,Luoyang,Henan471003,China) In order to observe the applied reliability of Wujiaqipowder, the long-term toxicity experiment was conducted in rats. Three treatment groups(8.4,2.1,0.84 g/kg/d)of Wujiaqi powder and blank control group were divided up,the dose amount was equivalent to 10,25,100 times of clinical chicken dosage.10 male and female rats in each group were randomly extracted after administration for 14 d,28 d and at 14 d after drug discontinuance.The tail venous blood was collected for determining the hematology and blood biochemical major indicators.The heart,liver,spleen,lung,kidney,gastrointestinal,testicle and ovary were performed the histopathological examination.The results showed that the major indicators of body weight,viscera and weight ratio,hematology and blood biochemical in each dose group had no statistically significant differences with the control group(P>0.05),no obvious histopathological changes were found in the heart,liver,spleen,lung,kidney,gastrointestinal,testicle and ovary.The research inferred that Wujiaqipowder is safe in clinical application. Wujiaqipowder; long-term toxicity;rats 卞愧,硕士,从事新兽药研发工作。E-mail:kuibianok@163.com 2016-05-31 A 1002-1280 (2016) 07-0041-05 S853.76
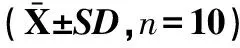
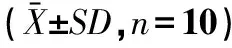
3 讨论与小结

